Biologické oleje se liší od minerálních olejů („normální“ nafty) v molekulární strukturu a vlastnosti.

Běžné ropné nafty je mixure jednoduchých uhlovodíků, s průměrnou chemický vzorec C12H23 (viz níže), ale komponenty se může pohybovat v rozmezí přibližně od C10H20 (dodecane) C15H28(pentadecane). Naproti tomu biologické oleje jsou „triglyceridy“ (klasifikované jako „estery“) jako glyceryl trilinoleát uvedený níže:
| C12H23, dodecane | triglyceridů: glyceryl trilinoleate |
Vzhledem k jejich velké velikosti a následné velké mezimolekulární atrakce, viskozity biologických olejů je obvykle příliš vysoká pro použití v běžných vznětových motorů. Biologické oleje také hořet o něco méně snadno, a s sootier plamenem než ropné nafty. Biologické oleje mohou být použity v konvenčních vznětových motorů, pokud jsou zahřáté na snížení jejich viskozity, ale to vyžaduje pomocný elektrický ohřívač, dokud se motor zahřeje. Pro tyto resony vyžadují bilogické oleje zpracování pro použití jako bionafta.
biologický olej je ester, což je typ organické sloučeniny, která má níže uvedenou atomovou vazbu.
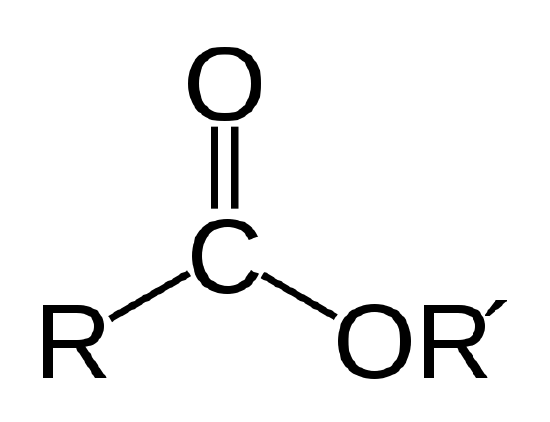 esterové vazby. R A R‘ představují řetězce atomů uhlíku a vodíku. R = -CH3 a R‘ = -C18H35O2 pro methyl stearát v Příkladu 1, |
glycerol |
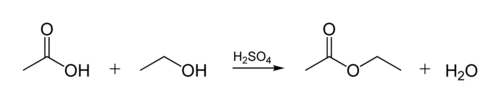
esterové vazby v biologických olejů je vytvořena, když glycerolu molekuly reaguje s organickými kyselinami. Molekula glycerolu má řetězec 3 atomů uhlíku, každý s an-OH (alkoholovou) skupinou. Níže uvedený obrázek ukazuje, jak organický alkohol reaguje s organickou kyselinou. Organičtí chemici zkrátí molekulární struktury-čáry“ cik-cak „na obrázku představují uhlíkové řetězce s atomem C na každém“ cik „nebo“cak“. Každý uhlík má 4 vazby, a pokud je zobrazeno méně než 4, předpokládá se, že jdou na atomy H. Takže alkohol C2H5OH (ethanol) a kyseliny octové (nebo ethanoic kyselina, CH3COOH) v Obrázek:
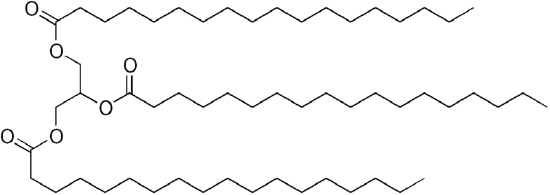
Od glycerol má 3 -OH skupiny, 3 dlouhé řetězce organických „mastné kyseliny“ připojit, aby se objemné „triglycerid“.
Ale stejně snadno, jako estery mohou být vyrobeny z alkoholů a kyselin, mohou přejít alkoholů nebo kyselin. V přítomnosti silné báze katalyzátor, jako NaOH, triglyceridů může reagovat s 3 malé molekuly alkoholu, jako je methanol (CH3OH), které nahrazují glycerol „páteř“, takže 3 samostatné estery nižší molekulární hmotnosti
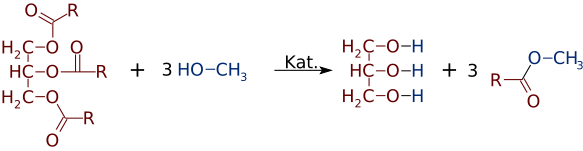
Dost často směs dvou nebo více produktů je tvořen. Například, když se rostlinný olej reaguje s metanolem, pouze jeden nebo dva z kyseliny mohou být přemístěny z glycerinu, produkující pouze 1 nebo 2 Fame.
C3H5(C18H35O2)3 + NaOH + 2 CH3OH → C3H5(C18H35O2)2(OH) + 2 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 1 CH3OH → C3H5(C18H35O2)(OH)2 + 1 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 3 CH3OH → C3H5(OH)3 + 3 C17H35COOCH3
Obvykle, velký přebytek methanolu a hydroxidu sodného se přidá tak, že reakce produkuje maximální množství SLÁVY.
ale v případě transesterifikace, i když žádný z reaktantů není zcela spotřebován, nedochází k dalšímu zvýšení množství produktů. Říkáme, že taková reakce není dokončena. Když směs produktů se vyrábí nebo reakci nemusí jít do dokončení, účinnost reakce je obvykle hodnoceny z hlediska procent výtěžku požadovaného produktu. Teoretický výtěžek se vypočítá za předpokladu, že veškeré omezující činidlo se převede na produkt. Experimentálně určí hmotnost produktu je pak v porovnání s teoretický výnos a vyjádřené jako procento:

NAPŘÍKLAD 1, Když 100.0 g C3H5(C18H35O2)3 plyn a 15,0 g CH3OH jsou smíchány při 55°C s NaOH katalyzátor, reagují na formu 90.96 g C17H35COOCH3 methyl stearát bionafty. Vypočítejte procentní výnos.
řešení musíme vypočítat teoretický výtěžek NH3, a proto musíme nejprve zjistit, zda je N2 nebo H2 omezujícím činidlem. Pro vyváženou rovnici,
C3H5(C18H35O2)3 + NaOH + 3 CH3OH → C3H5(OH)3 + 3 C17H35COOCH3 stearin + hydroxid sodný + 3 CH3OH → glycerol + 3 methyl stearát
stechiometrický poměr reaktantů,
 počáteční množství obou činidel areand
počáteční množství obou činidel areand  poměr počáteční množství je tedy
poměr počáteční množství je tedy , Protože tento poměr je méně než
, Protože tento poměr je méně než  , tam je nadbytek CH3OH. Stearin je omezující činidlo. Proto musíme použít 0, 1122 mol stearin a 0, 3366 mol CH3OH (spíše než 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have
, tam je nadbytek CH3OH. Stearin je omezující činidlo. Proto musíme použít 0, 1122 mol stearin a 0, 3366 mol CH3OH (spíše než 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have so that
so that We can organize these calculations in a table:
We can organize these calculations in a table:
| C3H5(C18H35O2)3(s) | + 3 CH3OH (l) | → 1 C3H5(OH)3 (l) | + 3 C18H35O2)3CH3(s) | ||
|---|---|---|---|---|---|
| m, g | 100.0 g | 15.00 g | 90.96 g | ||
| M, g/mol | 891.5 | 32.04 | 298.5 | 92.1 | |
| n present, mol | 0.1122 mol | 0.4682 mol | |||
| n actual, mol | 0.1122 | 0.3366 | 0.1122 | 0.3366 | |
| m actual, mass | 100.0 | 10.78 | 10.33 | 100.47 |
The percent yield is then
Transesterification is a classic example of a reaction which does not go to completion.