- Host-Specifické Interakce Mezi Rhizobium a Rostlin Partnery
- Určitý a Neurčitý Uzlík Rozvoj
- Růst Symbiotické Buňky Zahrnuje Zesílení Hostitelského Genomu do Endoreduplikaci Cyklů
- různé osudy bakterií fixujících dusík
- Host Peptidy Řídí Bacteroid Diferenciace
- NCR247: příklad Vícecílového efektoru hostitele
- Závěr
- Prohlášení o střetu zájmů
- Poděkování
Host-Specifické Interakce Mezi Rhizobium a Rostlin Partnery
bakterie, která forma dusíku-stanovení symbióze s vikvovité rostliny, které patří do různých skupin α – a β-proteobacteria se souhrnně nazývají rhizobia (Chen et al., 2003; MacLean et al., 2007). Mnoho α-proteobakterií se zabývá dlouhodobými interakcemi s vyššími eukaryoty. Tyto interakce sahají od povrchové kolonizace přes fakultativní symbiotické vztahy až po povinný intracelulární patogen nebo endosymbiontový životní styl. Symbiotické genů potřebných pro uzlík formace, hostitelské buňky infekce a fixace dusíku byly získány laterální genový přenos, který je hlavním zdrojem genetické rozmanitosti rhizobia. Proto by rhizobie mohla být úzce spjata s patogeny (jako je Agrobacterium nebo Brucella)než navzájem. Rhizobie mívají velké genomy (až 10.5 Mbp), které jsou v rychle rostoucí rhizobii rozptýleny na více replikonech (MacLean et al ., 2007). Například, Sinorhizobium meliloti, endosymbiont Medicago druhů, má tri-rozešli genomu; 3.65 Mbp chromozomu a dva megaplasmids, pSymA a pSymB (1.35 a 1,68 Mbp), z nichž oba jsou nezbytné a nést většinu symbiotických genů. Mnoho kmenů s. meliloti však obsahuje další pomocné plazmidy střední velikosti, a proto genom s. meliloti může obsahovat až 9 000 genů (Barnett et al ., 2001; Capela a kol., 2001). V kontrastu k rhizobia, obligátní endosymbionts hmyzu obvykle mají silně snížena (160-450 Kb), genom, který zajišťuje jejich množení a kódy pro několik specifických biosyntetických drah včetně těch, uspokojující hostitele je třeba (Moran et al., 2008; cena a kol., 2011). Tyto neuvěřitelně redukované genomy jsou nicméně amplifikovány kompenzující snížený genom s obsahem polyploidní DNA.
partneři rostlin rhizobia patří do čeledi Leguminosae / Fabaceae. Symbióza fixující dusík se vyvinula v několika liniích, ale ne všechny luštěniny tvoří symbiózu. Dosud je známo 12 000 nodulovaných druhů luštěnin a každý má svůj vlastní Rhizobium partner(y). Symbióza je vyvolána hladem dusíku hostitelské rostliny, která si musí vybrat svého partnera Rhizobium z miliard bakterií v rhizosféře. Toho je dosaženo tím, vylučování flavonoidů signální molekuly z kořene, který působí jako chemo-atraktanty, ale především jako induktory z Rhizobium hrbolky geny (Podívejte se, 2013). Tyto geny jsou potřebné pro produkci bakteriálních signálních molekul; faktory Nod (NFs), které spouštějí vývojový program uzlů v hostitelské rostlině (Walker a Downie, 2000). NFs jsou lipochitooligosaccharide molekuly, které nesou hostitele specifické substituce na terminálu zbytků cukru a charakteristické řetězce lipidů, které jsou uznávány LysM-typ hostitel receptory a jsou nutné jak pro uzlík rozvoj a bakteriální infekce. Je zajímavé, že starověké symbióza rostlin půdy s arbuskulární mykorhizní (AM) houby pracuje s podobnými lipochitooligosaccharide signální molekuly, Myc faktory, které jsou vnímány podobné, ale různé LysM-typ receptorů jako NFs (Abdel-Lateif et al., 2012; Oldroyd, 2013). Myc faktory a NFs aktivovat společný signální dráhy, ale po zapojení společné symbiotických genů zachovány v rostlinách, cesty odchýlit; jedna vede k hrbolky, druhý na AM symbiózu.
infekce rostlin a tvorba uzlů jsou složité procesy; Faktory Nod hrají zřetelné role v organogenezi uzlíků a infekci kořenových vlasů. Kromě faktorů Nod jsou pro účinnou infekci rozhodující různé bakteriální povrchové polysacharidy (Fraysse et al ., 2003). Ve většině luštěniny, rhizobia zadejte hostitele přes kořenové vlásky, kde invaginaci plasmatické membrány infekce závit (IT) je vytvořen, který obsahuje množí bakterie a rostou směrem ke kořenové kůry. Méně častý a starodávný způsob infekce nastává prasklinami na povrchu kořenů některých luštěnin.
Určitý a Neurčitý Uzlík Rozvoj
Uzlík rozvoj vyžaduje mitotické reaktivace kortikální buňky, což vede k uzlík primordium formace, které pak rozlišuje na dusík-stanovení kořenové uzliny poskytování microaerobic stavu, v centrální zóně pro fungování kyslík citlivé nitrogenase enzymu v bacteroids. V závislosti na přechodné a perzistentní povaze proliferace hostitelských buněk mohou být uzliny buď určeného nebo neurčitého typu (Terpolilli et al., 2012; Kondorosi a kol., 2013). Determinované uzliny nemají meristém a obsahují homogenní populaci symbiotických buněk. Determinované uzliny se vyvíjejí například na kořenech Phaseolus vulgaris a Lotus japonicus.
naopak aktivní dělení buněk je udržováno v neurčitých uzlech. Uzlík meristém je přítomen v apikální oblasti (oblast I), které je neustálé vytváření nových buněk vyvolává kontinuální růst a protáhlý výrůstek tvaru. Buňky opouštějící meristém se již nerozdělují a vstupují do diferenciační fáze. Infekce se vlákno uvolní bakterie do submeristematic buňky, které diferencují postupně po 12-15 vrstvy buněk infekce zóny (zóna II), což vede k rozvoji dusíku-stanovení symbiotické buňky v uzlu zóny III (Obrázek 1; Franssen et al., 1992). Medicago sativa, m. truncatula, Vicia sativa a Pisum sativum jsou příklady rostlin tvořících neurčité uzliny.
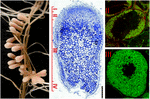
obrázek 1. Struktura kořenových uzlů fixujících dusík vytvořených v symbióze s. meliloti – m. truncatula. Na podélném uzlovém úseku jsou vyznačeny různé zóny uzlů: (I) meristém, (II) infekční zóna, (III) zóna fixace dusíku, (IV) zóna stárnutí. Symbiotické buňky v zóně II obsahují rozlišování endosymbionts zatímco v zóně III hostitelskou cytoplazmou je plně nabitý dlouho dusíku-stanovení bacteroids. Endosymbionty obarvené Syto9 mají zelenou fluorescenci.
Růst Symbiotické Buňky Zahrnuje Zesílení Hostitelského Genomu do Endoreduplikaci Cyklů
Extrémní rostlinné buňky rozšíření lze pozorovat v obou určitý a neurčitý uzliny. Cytoplazma symbiotické buňky fixující dusík hostí asi 50 000 bacteroidů. Pro uložení tak vysokého počtu endosymbiontů rostou hostitelské buňky. V uzlinách m. truncatula je objem buněk fixujících dusík 80krát větší než objem diploidních meristematických buněk. Růst infikovaných buněk dochází postupně v zóně II a je důsledkem opakované endoreduplikaci (ER) genomu bez mitózy. V zóně II buněčného cyklu stroje je stále aktivní, ale nedostatek mitotické cyclins inhibuje mitózu a transformuje mitotických cyklů k endoreduplikaci cyklů (Cebolla et al., 1999). Toho je dosaženo přepínačem buněčného cyklu CCS52A protein, který destrukcí mitotických cyklinů indukuje opakovaná kola duplikace genomu vedoucí k tvorbě postupně rostoucích polyploidních buněk (Roudier et al ., 2003; Kondorosi a Kondorosi, 2004). V Medicago druhů úrovní ploidie může dosáhnout 64C což představuje 64-krát vyšší obsah DNA ve srovnání s haploidní buňky (C odpovídá obsah DNA haploidní; Vinardell et al., 2003). Down-regulaci CCS52A v M. truncatula neměl žádný vliv na primordium formace, ale bylo škodlivé pro uzlík diferenciace naznačuje, že ER cykly a tvorbu velkých vysoce polyploidních buněk jsou nezbytné pro uzlík fungování (Vinardell et al., 2003). Zajímavé je, že kortikální buňky obsahující AM houby jsou také polyploidní, stejně jako obří kořenové buňky krmící hlístice (Favery et al., 2002; Žánr a kol., 2008). Podobně, hmyz symbiotické buňky, bakteriocyty nesoucí intracelulární endosymbionty jsou také velké a polyploidní (Nakabachi et al., 2010). V krytosemenných rostlin, polyploidie je časté a konkrétní zdědil vzor polyploidie v různých orgánech, tkáních a typech buněk naznačují, že by to mohlo být hlavním zdrojem specializované fyziologii hostitelské buňky (Nagl, 1976; Edgar et al., 2014). Vedle buněčného růstu, mnohočetných genových kopií, může nedostatek kondenzace chromozomů přispět k vyšším transkripčním a metabolickým aktivitám. Nicméně, asociace polyploidie u různých buněčných funkcí naznačuje vliv polyploidie také na architektuře nucleosomes a na epigenomu ovládání k aktivaci nebo represi specifických genomových regionů. Proto polyploidních genomů obsah symbiotické buňky se zdá být předpokladem pro uzlík diferenciace a pro vyjádření nejvíce symbiotických hostitelské geny (Maunoury et al., 2010).
různé osudy bakterií fixujících dusík
bakterie uvolňované z IT jsou přítomny v hostitelské cytoplazmě jako organely podobné struktury, nazývané symbiosomy. Bakterie nemají přímý kontakt s cytoplazmou, protože jsou obklopeny peribakteriální membránou, známou také jako symbiozomová membrána (SM). Bacteroid, SM a prostor mezi nimi tvoří symbiosom (Catalano et al ., 2004). SM během svého vzniku odráží jeho původ plazmatické membrány, pozdější modifikace jeho složení otevírají nové, specializované role na rozhraní host-endosymbiont (Limpens et al ., 2009; Ivanov a kol., 2012; Brear a kol., 2013; Sinharoy et al., 2013). Na bacteroids množit se v rostoucí hostitelské uzlík buňky do určité hustoty buněk, přizpůsobit endosymbiotic životní styl a microaerobic podmínky a zralý na dusík-stanovení bacteroids. Forma a fyziologie bacteroidů se však u různých luštěnin může výrazně lišit. V některých luskovin hostí, dusík-stanovení bacteroids mají stejnou morfologii jako kultivované buňky; tento typ bacteroids může vrátit k volně žijící formy. V jiných asociacích jsou bacteroidy nevratně transformovány na polyploidní, zvětšené, nekultivovatelné endosymbionty. Tyto nevyléčitelně diferencované bacteroids mohou být protáhlé a dokonce i rozvětvené a 5 – až 10-krát delší, než je free-živé buňky, nebo mohou být kulovité, 8-nejméně 20-krát zesílen genomu, v závislosti na hostiteli (Mergaert et al., 2006; Nakabachi a kol., 2010). Terminální diferenciace bacteroids je hostitel řízené, se vyvinul v několik větví rodiny Leguminosae uvedením hostitele výhodu a pravděpodobně vyšší symbiotické výkon (Oono et al., 2010). Terminální diferenciace bakterií je nejlépe objasněna v symbióze s. meliloti – m. truncatula. V M. truncatula uzlíky, nejvíce viditelné akce terminálu bacteroid diferenciace se vyskytují v zóně II. Násobení bacteroids zastaví uprostřed zóny II, kde buňka prodloužení a jednotné zesílení více replicons tím, endoreduplikaci cykly začínají. Po 2-3 vrstvy buněk na hranici zóny II a III (tzv. interzone) náhlý růst bacteroids je viditelné, dosahující prakticky jejich konečné velikosti, nicméně, dusíku-fixace probíhá pouze v zóně III.
Host Peptidy Řídí Bacteroid Diferenciace
Porovnání uzlík transcriptomes luštěnin s reverzibilní a ireverzibilní bacteroid diferenciace odhalena existence několik stovek malých genů, které byly přítomny pouze v genomu těchto hostitelských rostlin, kde bacteroid diferenciace byla terminálu. V m. truncatula produkují uzlové buňky nejméně 600 symbiotických peptidů specifických pro uzliny (sympateps). Geny sympatep jsou aktivovány pouze v polyploidních symbiotických buňkách infikovaných s. meliloti (Kevei et al ., 2002; Mergaert a kol., 2003), nicméně některé sady v dřívějších, jiné v pozdějších fázích vývoje uzlíků. Velká část, více než 500 genů kóduje peptidy bohaté na cystein (NCR) specifické pro uzliny (Mergaert et al., 2003; Alunni et al., 2007; Nallu et al., 2014). NCR peptidy jsou zaměřeny na bacteroids a při jejich dodání do endosymbionts byl zablokován, bacteroid diferenciace byla zrušena prokazující, že peptidy jsou zodpovědné za terminální diferenciace. S. meliloti bacteroids (Van de Velde et al., 2010). Odrůda s vysokou sekvencí a charakteristické vzorce exprese genů NCR naznačují rozmanitost jejich funkcí,způsobů působení a bakteriálních cílů v různých stádiích zrání bakterií (Obrázek 2). Proč však hostitelská buňka produkuje arzenál NCRs? Jaká může být výhoda tak rozmanitého peptidového repertoáru? Je nutné pro interakci hostitele s různými bakteriemi? Symbiotické partnery, M. truncatula jsou S. meliloti a. S. medicae, nicméně v půdě existuje nespočet kmen variant obou druhů. M. truncatula je také zastoupena v mnoha různých ekotypů a přístupy se liší v číslo, sekvence, a výraz profilu NCR geny a v jejich symbiotické interakce s různými. S. meliloti a. S. medicae kmenů (Nallu et al., 2014; Roux a kol., 2014). Zatímco uzlík obsahuje jediný typ bakterie, různé uzliny na stejném kořenovém systému mohou mít odlišné bakteriální populace. Je možné, že rostlina rozpoznávající různé endosymbionty manipuluje s repertoárem peptidů specifickým pro kmen. Tyto rozdíly mohou přidat další úroveň kontroly pro specifičnost host-symbiont a tím pro účinnost nodulace.

obrázek 2. Diferenciální exprese genů sympatep v uzlinách m.truncatula. Černý signál: in situ hybridizace, modrý signál: Gus aktivita sympatometických gusových fúzí v transgenních uzlinách.
přestože sympatepy představují jedinečné peptidové třídy, jejich struktury se podobají antimikrobiálním peptidům (AMPs). Zesilovače se širokým spektrem mikrobiální aktivity zabíjející buňky jsou nejčastěji kationty vyvolávající buněčnou smrt tvorbou pórů, narušením membrány a následnou lýzou mikrobiálních buněk. Skutečnost, že schopnost buněčného dělení je definitivně ztracena během diferenciace endosymbiontu, naznačuje, že alespoň některé sympatepy mají antimikrobiální aktivity. Léčba bakterií syntetickými kationtovými NCRs skutečně vyvolala rychlou a účinnou eliminaci různých gramnegativních a grampozitivních bakterií, včetně důležitých lidských a rostlinných patogenů (Van de Velde et al ., 2010; Tiricz et al., 2013). Tento ex-planta smrtící účinek koreluje s permeabilization mikrobiální membrány, nicméně, symPEPs v jejich přirozeném prostředí – v uzlu buňky – nemají permeabilize bakteriální membrány a ne zabít endosymbionts. S největší pravděpodobností jsou koncentrace peptidů v uzlinách významně nižší než koncentrace aplikované v in vitro testech. Navíc kationické peptidy jsou produkovány spolu s aniontové a neutrální peptidy ve stejné buňce, a možné kombinace několika desítek či stovek peptidů s různými náboje a hydrofobnosti může neutralizovat přímý baktericidní efekt kationtové peptidy.
zapojení zesilovačů nebo peptidů podobných AMP není jedinečné pro symbiózu Rhizobium-luštěniny. V weevil Sitophilus, symbiotické buňky produkují antimikrobiální peptid coleoptericin-(coca-ColA), která vyvolává vývoj obří vláknité endosymbionts tím, že inhibuje dělení buněk a chrání sousední hmyzí tkáně, bakteriální invaze (Login et al., 2011). V tomto systému jeden peptid je dostatečná pro rozlišení obligátní vertikálně přenášeny endosymbiont na rozdíl od uzlíky, které pracují se stovkami symPEPs a může hostit nesčetné kmen varianty jako jejich endosymbionts. Na mšice-Buchnera symbióza, hostitelské buňky také produkují bacteriocyte-specifické peptidy včetně cystein bohaté peptidy (závazná podniková pravidla), které se podobají Medicago NCR peptidy, avšak funkce těchto symbiotických peptidy nebyly hlášeny, ale přesto (Shigenobu a Stern, 2013).
NCR247: příklad Vícecílového efektoru hostitele
Transkriptomová analýza M. truncatula uzliny v různých fázích jejich vývoje, laser microdissection z uzlík regionů, in situ hybridizace, immunolocalization vybraných peptidů a symPEP promotor-reportér genových fúzí v transgenních uzlíky umožňují mapování činnosti jednotlivých peptidů v symbiotické buňky od počátku infekce až do konce fixace dusíku státu. NCR247 je exprimován ve starších buněčných vrstvách zóny II a v interzóně, kde se zastaví dělení bakteriálních buněk a dochází k pozoruhodnému prodloužení endosymbiontů (Farkas et al ., 2014). Tento malý kationtový peptid účinně zabíjel různé mikroby in vitro a analýza in silico ukázala jeho extrémní kapacitu vazby na proteiny. NCR247 značený FITC vstoupil do bakteriálního cytosolu, kde byly možné jeho interakce s četnými bakteriálními proteiny. Závazné partnery, byly identifikovány léčbu S. meliloti bakterie nebo bacteroids s StrepII/FLAG-tagged peptidy následuje afinitní chromatografie a identifikace interakci partnerů s LC-MS/MS a Západní analýzy (Farkas et al., 2014).
jedním z interaktorů byl protein ftsz buněčného dělení, který hraje klíčovou primární roli v buněčném dělení. Je známo, že řada antibiotických peptidů vykazuje baktericidní nebo bakteriostatický účinek interakcí s FtsZ, inhibuje jeho polymeraci, čímž brání správné tvorbě Z-kruhu a septa (Handler et al., 2008). NCR247 byl společně čištěn s FtsZ z bakteriální cytoplazmy a bylo prokázáno, že narušuje tvorbu septa. NCR035 vykazuje in vitro také baktericidní účinek a vyroben ve stejném symbiotické buňky jako NCR247 hromadí na dělení přepážky, která označuje současný nebo po sobě jdoucí účinek těchto peptidů a vývoj více hostitelských strategií k potlačení endosymbiont šíření. Další studie ukázala, že exprese důležité dělení buněk, genů, včetně genů potřebných pro Z-ring funkce, byly silně oslabené buňky ošetřeny NCR247 (Penterman et al., 2014). Předúprava bakterií se subletálními koncentracemi NCR247 zrušila lokalizaci FITC-NCR035 do septa a vyvolala prodloužení buněk (Farkas et al ., 2014).
ribozomální proteiny byly nejhojnějšími interakčními partnery NCR247. Bylo pozorováno, že NCR247 silně inhibuje syntézu bakteriálních proteinů v závislosti na dávce jak in vivo, tak in vitro (Farkas et al ., 2014). Tyto výsledky naznačují, že jeden způsob peptidového účinku NCR247 je vázán na ribozomy jak v bakteriálních buňkách, tak v bakteriálních buňkách. Zajímavé je, že v bakteriích byl pozorován změněný vzorec a snížená složitost interagujících proteinů. Tedy obecné vyjádření úrovně ribozomální proteiny byla v průměru 20-krát nižší v bacteroids než ve free-živé buňky s různou relativní hojnost přepisy jednotlivých ribozomální proteiny. Ribozomu diverzifikace v bacteroids může mít významnou roli tím, že přispívá k pokročilé překladu specifických proteinů, čímž podporuje specializované, energeticky náročné fyziologii velmi hojný fixace dusíku funkce.
groel chaperon byl také přímým interagujícím partnerem ncr247 (Farkas et al., 2014). Z 5 Groelových proteinů postačuje GroEL1 nebo GroEL2 k přežití, zatímco GroEL1 exprimovaný na vysoké úrovni v uzlu je nezbytný pro symbiózu (Bittner et al., 2007). Je zapotřebí pro úplnou aktivaci nodulačních genů a sestavení nitrogenázového komplexu. GroEL má extrémní funkční všestrannost interakcí se stovkami proteinů. Na NCR247-GroEL1 interakce může mít důsledky přímo na GroEL, ale nepřímo také na GroEL substráty a související biologické procesy. Absence GroEL1 výrazně ovlivněny bakteriální infekce a údržba a diferenciace bacteroids prokazující obecnou potřebu GroEL1 ve všech fázích dusíku stanovení uzlík rozvoj.
zapojení peptidů GroEL a hostitel v interakcích mikrob-hostitel není jedinečné pro symbiózu Rhizobium-luštěniny. V symbiotických buňkách weevil interaguje coleoptericin-a (ColA) také s Groelem (Login et al., 2011). GroEL také hraje důležitou roli při udržování endosymbiontů (Moran, 1996; Kupper et al., 2014). Jako většina symbiotické systémy jsou dosud neprozkoumané a high-propustnost genomické a proteomic tools jsou jen v poslední době k dispozici, můžeme pouze předvídat, že peptidy hostitele zprostředkované endosymbiont diferenciace, podobně genomu amplifikace hostitelské buňky a nevyléčitelně diferencované endosymbionts jsou obecné strategie symbiózy.
Závěr
Symbiotické a patogenní bakterie použít podobné přístupy k interakci se svými hostiteli a přežít v hostitelských buňkách, i když výsledky těchto interakcí jsou nápadně odlišné. Rostliny a zvířata mohou vytvářet vrozené imunitní odpovědi na mikroorganismy při vnímání MAMP (molekulární vzory spojené s mikroorganismy). Toto vnímání má za následek aktivaci signálních kaskád a produkci antimikrobiálních efektorů. Hostitelské peptidy podobné AMP, jako je M. truncatula NCR peptidy nebo antimikrobiální peptid weevil ColA hrají klíčovou a mnohostrannou roli při kontrole množení a diferenciace endosymbiontů, čímž omezuje přítomnost bakterií na symbiotické buňky. Hostitelské organismy tedy využívají tyto efektorové peptidy ke zkrotení a dokonce k pronájmu vybraných mikrobiálních útočníků pro službu.
Prohlášení o střetu zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být vykládány jako potenciální střet zájmů.
Poděkování
Práce v našich laboratořích je podporován pomocí“SYM-BIOTICS“ Advanced Grant Evropské Výzkumné Rady na Éva Kondorosi (grant číslo 269067) a TÁMOP-4.2.2.A-11/1 / KONV-2012-0035 podporováno Evropskou unií a spolufinancováno Evropským sociálním fondem.
Abdel-Lateif, k., Bogusz, D., and Hocher, v. (2012). Role flavonoidů v zřízení kořeny rostlin endosymbioses s arbuskulární mykorhizní houby, rhizobia a Francie bakterie. Signál Rostlin. Chovej se. 7, 636–641. doi: 10.4161 / psb.20039
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Alunni, B., Kevei, Z., Redondo-Nieto, M., Kondorosi, A., Mergaert, P., and Kondorosi, E. (2007). Genomic organization and evolutionary insights on GRP and NCR genes, two large nodule-specific gene families in Medicago truncatula. Mol. Plant Microbe Interact. 20, 1138–1148. doi: 10.1094/MPMI-20-9-1138
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Barnett, M. J., Fisher, R. F., Jones, T., Komp, C., Abola, A. P., Barloy-Hubler, F., et al. (2001). Nukleotidová sekvence a predikované funkce celého megaplasmidu Sinorhizobium meliloti pSymA. Proc. Natle. Acad. Věda. U. S. A. 98, 9883-9888. doi: 10.1073 / pnas.161294798
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Bittner, A. N., Foltz, A., a Oke, V. (2007). Pro životaschopnost a úspěšnou symbiózu v Sinorhizobium meliloti je nutný pouze jeden z pěti genů groEL. J. Bacteriol. 189, 1884–1889. doi: 10.1128 / JB.01542-06
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Brear, E. M., Day, D. A., and Smith, P. M. (2013). Iron: an essential micronutrient for the legume-Rhizobium symbiosis. Front. Plant Sci. 4:359. doi: 10.3389/fpls.2013.00359
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Catalano, C. M., Lane, W. S., and Sherrier, D. J. (2004). Biochemical characterization of symbiosome membrane proteins from Medicago truncatula root nodules. Electrophoresis 25, 519–531. doi: 10.1002/elps.200305711
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Capela, D., Barloy-Hubler, F., Gouzy, J., Bothe, G., Ampe, F., Batut, J., et al. (2001). Analýza chromozomální sekvence luštěniny symbiont Sinorhizobium meliloti kmen 1021. Proc. Natle. Acad. Věda. U. S. A. 98, 9877-9882. doi: 10.1073 / pnas.161294398
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Cebolla, A., Vinardell, J. M., Kiss, E., Oláh, B., Roudier, F., Kondorosi, A., et al. (1999). Mitotický inhibitor ccs52 je nutný pro endoreduplikaci a ploidy-dependentní zvětšení buněk v rostlinách. EMBO J. 18, 4476-4484. doi: 10.1093/emboj/18.16.4476
CrossRef Úplné Znění
Chen, W. M., Moulin, L., Bontemps, C., Vandamme, P., Béna, G., a Boivin-Masson, C. (2003). Symbiotická fixace dusíku luštěninami β-proteobakteriemi je v přírodě rozšířená. J. Bacteriol. 185, 7266–7272. doi: 10.1128 / JB.185.24.7266-7272.2003
CrossRef Úplné Znění
Edgar, B. a., Zielke, N., a Gutierrez, C. (2014). Endocycles: opakující se evoluční inovace pro růst post-mitotických buněk. Adresa. Reverend Mol. Buňka. Biol. 15, 197–210. doi: 10.1038/nrm3756
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Farkas, A., Maróti, G., Dürgõ, H., Györgypál, Z., Lima, R. M., Medzihradszky, K. F., et al. (2014). Symbiotický peptid Medicago truncatula NCR247 přispívá k diferenciaci bakterií prostřednictvím více mechanismů. Proc. Natle. Acad. Věda. U. S. A. 111, 5183-5188. doi: 10.1073 / pnas.1404169111
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Favery, B., Complainville, A., Vinardell, J. M., Lecomte, P., Vaubert, D., Mergaert, P.,et al. (2002). The endosymbiosis-induced genes ENOD40 and CCS52a are involved in endoparasitic-nematode interactions in Medicago truncatula. Mol. Plant-Microbe Interact. 15, 1008–1013. doi: 10.1094/MPMI.2002.15.10.1008
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franssen, H. J., Vijn, I., Yang, W. C., and Bisseling, T. (1992). Developmental aspects of the Rhizobium-legume symbiosis. Plant Mol. Biol. 19, 89–107. doi: 10.1007
CrossRef Full Text
Fraysse, N., Couderc, F., and Poinsot, V. (2003). Surface polysaccharide involvement in establishing the Rhizobium–legume symbiosis. Eur. J. Biochem. 270, 1365–1380. doi: 10.1046/j.1432-1033.2003.03492.x
CrossRef Full Text
Genre, A., Chabaud, M., Faccio, A., Barker, D. G., and Bonfante, P. (2008). Sestava prepenetračního aparátu předchází a předpovídá kolonizační vzorce arbuskulárních mykorhizních hub v kořenové kůře Medicago truncatula a Daucus carota. Rostlinná Buňka 20, 1407-1420. doi: 10.1105 / tpc.108.059014
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Handler, a. a., Lim, J. E., a Losick, R. (2008). Peptidový inhibitor cytokineze během sporulace u Bacillus subtilis. Molo. Mikrobiol. 68, 588–599. doi: 10.1111 / j. 1365-2958. 2008. 06173.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ivanov, S., Fedorova, E. E., Limpens, E., De Mita, S., Genre, A., Bonfante, P.,et al. (2012). Rhizobium–legume symbiosis shares an exocytotic pathway required for arbuscule formation. Proc. Natl. Acad. Sci. U.S.A. 109, 8316–8321. doi: 10.1073/pnas.1200407109
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kevei, Z., Vinardell, J. M., Kiss, G. B., Kondorosi, A., and Kondorosi, E. (2002). Proteiny bohaté na glycin kódované genovou rodinou specifickou pro uzliny se podílejí na různých stádiích vývoje symbiotických uzlin v Medicago spp. Molo. Rostlinný Mikrob Interaguje. 15, 922–931. doi: 10.1094 / MPMI.2002.15.9.922
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Kondorosi, E., a Kondorosi, A. (2004). Endoreduplikaci a aktivace anafázi podporující komplex během symbiotické buňky vývoje. FEBS Lett. 567, 152–157. doi: 10.1016 / j. febslet.2004.04.075
Pubmed Abstract / Pubmed Full Text/CrossRef Full Text
Kondorosi, e., Mergaert, P., and Kereszt, a. (2013). Paradigma pro endosymbiotický život: buněčná diferenciace bakterií Rhizobium vyvolaná faktory hostitelských rostlin. Annu. Rev. Mikrobiol. 67, 611–628. doi: 10.1146/annurev-micro-092412-155630
CrossRef Úplné Znění
Kupper, M., Gupta, S. K., Feldhaar, H., Hrubá, R. (2014). Univerzální role chaperonin GroEL v interakcích mikroorganismů a hmyzu. FEMS Mikrobiol. Lette. 353, 1–10. doi: 10.1111/1574-6968.12390
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Limpens, E., Ivanov, S., van Esse, W., Voets, G., Fedorova, E., a Bisseling, T. (2009). Medicago N2-stanovení symbiosomes získat endocytic identity značky Rab7 ale zpoždění pořízení vakuolární identity. Rostlinná Buňka 21, 2811-2828. doi: 10.1105 / tpc.108.064410
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Přihlášení, F. H., Balmand, S., Vallier, A., Vincent-Monégat, C., Vinař, A., Weiss-Gayet, M., a kol. (2011). Antimikrobiální peptidy udržují endosymbionty hmyzu pod kontrolou. Věda 334, 362-365. doi: 10.1126 / věda.1209728
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
MacLean, A. M., Financ, T. M., a Sadowsky, M. J. (2007). Genomy symbiotických bakterií fixujících dusík luštěnin. Rostlinný Fyziol. 144, 615–622. doi: 10.1104/s. 107.101634
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Maunoury, N., Redondo-Nieto, M., Bourcy, M., Van de Velde, W., Alunni, B., Laporte, P., et al. (2010). Diferenciace symbiotických buněk a endosymbiontů je spojena se dvěma transkriptomovými přepínači v Nodulaci Medicago truncatula. PLoS ONE 5: e9519. doi: 10.1371 / deník.pone.0009519
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Mergaert, P., Nikovics, K., Kelemen, Z., Maunoury, N., Vaubert, D., Kondorosi, A., et al. (2003). Román rodina v Medicago truncatula skládající se z více než 300 uzlík-specifické geny kódující malé, vylučován polypeptidy s konzervovaným cystein motivy. Rostlinný Fyziol. 132, 161–173. doi: 10.1104/pp.102.018192
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mergaert, P., Uchiumi, T., Alunni, B., Evanno, G., Cheron, A., Catrice, O.,et al. (2006). Eukaryotic control on bacterial cell cycle and differentiation in the Rhizobium-legume symbiosis. Proc. Natl. Acad. Sci. U.S.A. 103, 5230–5235. doi: 10.1073/pnas.0600912103
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Moran, N. A. (1996). Zrychlená evoluce a Mullerova ráčna u endosymbiotických bakterií. Proc. Natle. Acad. Věda. U. S. A. 93, 2873-2878. doi: 10.1073 / pnas.93.7.2873
CrossRef Úplné Znění
Moran, N. a., McCutcheon, J. P., a Nakabachi, A. (2008). Genomika a vývoj dědičných bakteriálních symbiontů. Annu. Reverend Genet. 42, 165–690. doi: 10.1146 / annurev.genete.41.110306.130119
CrossRef Úplné Znění
Nakabachi, A., Koshikawa, S., Miura, T., a Miyagishima, S. (2010). Velikost genomu Pachypsylla venusta (Hemiptera: Psyllidae) a ploidie jeho bacteriocyte, symbiotické hostitelské buňky, která se chová intracelulární prospěšné bakterie s nejmenším buněčného genomu. Býk. Entomol. Rez.100, 27-33. doi: 10.1017/S0007485309006737
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Nagl, W. (1976). Endoreduplikace DNA a polyteny chápány jako evoluční strategie. Příroda 261, 614-615. doi: 10.1038/261614a0
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Nallu, S., Silverstein, K. a., Zhou, P., Young, N. D., and Vandenbosch, K. a. (2014). Vzory divergence velké rodiny peptidů bohatých na cystein v uzlinách Medicago truncatula. Plant J. 78, 697-705. doi: 10.1111 / tpj.12506
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Oldroyd, G.E. (2013). Mluvte, příteli a zadejte: signalizační systémy, které podporují prospěšné symbiotické asociace v rostlinách. Adresa. Rev. Mikrobiol. 11, 252–263. doi: 10.1038/nrmicro2990
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Oono, R., Schmitt, I., Sprent, J. I., and Denison, R. F. (2010). Multiple evolutionary origins of legume traits leading to extreme rhizobial differentiation. New Phytol. 187, 508–520. doi: 10.1111/j.1469-8137.2010.03261.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Penterman, J., Abo, R. P., De Nisco, N. J., Arnold, M. F., Longhi, R., Zanda, M.,et al. (2014). Peptidy hostitelských rostlin vyvolávají transkripční odpověď na řízení buněčného cyklu Sinorhizobia meliloti během symbiózy. Proc. Natle. Acad. Věda. U. S. A. 111, 3561-3566. doi: 10.1073 / pnas.1400450111
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Cena, D. R., Duncan, R. P., Shigenobu, S., Wilson, a. C. (2011). Genomová expanze a diferenciální exprese transportérů aminokyselin na symbiotickém rozhraní mšice / buchnera. Molo. Biol. Evol. 28, 3113–3126. doi: 10.1093/molbev/msr140
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Roudier, F., Fedorova, E., Lebris, M., Lecomte, P., Györgyey, J., Abad, P.,et al. (2003). The Medicago species A2-type cyclin is auxin regulated and involved in meristem formation but dispensable for endoreduplication-associated developmental programs. Plant Physiol. 131, 1091–1103. doi: 10.1104/pp.102.011122
CrossRef Full Text
Roux, B., Rodde, N., Jardinaud, M. F., Timmers, T., Sauviac, L., Cottret, L.,et al. (2014). Integrovaná analýza exprese rostlinných a bakteriálních genů v symbiotických kořenových uzlinách pomocí mikrodisekce laserového zachycení spojené se sekvenováním RNA. Závod J. 77, 817-837. doi: 10.1111 / tpj.12442
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Shigenobu, a. S., a. Stern, D. L. (2013). Mšice vyvinuly nové vylučované proteiny pro symbiózu s bakteriálním endosymbiontem. Proc. Biol. Věda. 280, 20121952. doi: 10.1098 / rspb.2012.1952
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Sinharoy, S., Torres-Jerez, I., Bandyopadhyay, K., Kereszt, A., Pislariu, C. I., Nakashima, J., et al. (2013). Regulátor transkripčního faktoru C2H2 diferenciace symbiozomů potlačuje transkripci genu sekreční dráhy VAMP721a a podporuje vývoj symbiozomu v Medicago truncatula. Rostlinná Buňka 25, 3584-3601. doi: 10.1105 / tpc.113.114017
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Terpolilli, j. J., Hood, G. A., and Poole, P. S. (2012). What determines the efficiency of N(2)-fixing Rhizobium-legume symbioses? Adv. Microb. Physiol. 60, 325–389. doi: 10.1016/B978-0-12-398264-3.00005-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tiricz, H., Szûcs, A., Farkas, A., Pap, B., Lima, R. M., Maróti, G.,et al. (2013). Antimicrobial nodule-specific cysteine-rich peptides induce membrane depolarization associated changes in Sinorhizobium meliloti. Appl. Env. Microbiol. 79, 6737–6746. doi: 10.1128/AEM.01791-13
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Van de Velde, W., Zehirov, G., Szatmari, A., Debreczeny, M., Ishihara, H., Kevei, Z.,et al. (2010). Plant peptides govern terminal differentiation of bacteria in symbiosis. Science 327, 1122–1126. doi: 10.1126/science.1184057
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vinardell, J. M., Fedorova, E., Cebolla, A., Kevei, Z., Horvath, G., Kelemen, Z.,et al. (2003). Endoreduplikaci zprostředkované anafázi podporující komplex aktivátor CCS52A je nutné pro symbiotické diferenciaci buněk v Medicago truncatula uzliny. Rostlinná Buňka 15, 2093-2105. doi: 10.1105 / tpc.014373
Pubmed Abstraktní | Pubmed Plný Text | CrossRef Úplné Znění
Walker, S. a., a Downie, J. a. (2000). Vstup Rhizobium leguminosarum bv. viciae do kořenových chloupků vyžaduje minimální specificitu faktoru Nod, ale následný růst infekční nitě vyžaduje nodO nebo uzel. Molo. Rostlina-Mikrob Interaguje.13, 54–62. doi: 10.1094 / MPMI.2000.13.7.754
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text