Léková Forma: injekční
Lékařsky přezkoumány Drugs.com. Naposledy aktualizován dne 22. Prosince 2020.
- Nežádoucí Účinky
- Dávkování
- Odborné
- Interakce
- Těhotenství
- Další
Rx.
Sterilní Intravenózní Roztok
- Inamrinon Popis
- Inamrinon – Klinická Farmakologie
- Farmakokinetika
- Farmakodynamika
- Indikace a Využití pro Inamrinon
- kontraindikace
- Varování
- bezpečnostní Opatření
- Obecné
- laboratorní testy
- lékové Interakce
- chemické interakce
- Karcinogeneze, Mutageneze, Poškození Fertility
- Těhotenství
- kojící matky
- pediatrické použití
- nežádoucí účinky
- léčba nežádoucích účinků
- Předávkování
- Inamrinon Dávkování a způsob Podání
- chemické interakce
- jak se Inamrinon dodává
- VIAL LABEL
- More about inamrinone
- Related treatment guides
Inamrinon Popis
Inamrinon Injekce USP představuje novou třídu srdeční inotropní látky odlišné od digitalisových glykosidů nebo katecholaminy. Inamrinon laktátu je určen chemicky 5-Amino-6(1H)-one 2-hydroxypropanate a má následující strukturu:
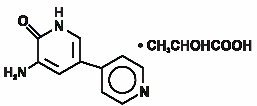
Inamrinon je světle žlutá krystalická sloučenina s molekulovou hmotností 187.20 a molekulární vzorec C10H9N3O. Každý mol kyseliny mléčné, má molekulovou hmotnost 90.08 a empirický vzorec z C3H6O3. Rozpustnost Inamrinonu při pH 4,1, 6,0 a 8,0 je 25, 0,9 a 0,7 mg / ml.
inamrinon injection je čirý žlutý sterilní roztok dostupný ve 20 mL injekčních lahvičkách pro intravenózní podání. Jeden mL obsahuje inamrinoni laktát odpovídající 5 mg Inamrinonu a 0,25 mg disiřičitanu sodného přidaného jako konzervační látka ve vodě pro injekci. Všechny dávky vyjádřené v příbalové informaci jsou vyjádřeny jako báze, Inamrinon. PH se upraví na 3,2 až 4,0 kyselinou mléčnou nebo hydroxidem sodným. Celková koncentrace kyseliny mléčné se může pohybovat mezi 5 mg a 7,5 mg.
Inamrinon – Klinická Farmakologie
Inamrinon je pozitivní inotropní agent s vazodilatační aktivitou, různé ve struktuře a způsobu účinku buď z digitalisových glykosidů nebo katecholaminy.
mechanismus jeho inotropních a vazodilatačních účinků nebyl zcela objasněn.
pokud jde o jeho inotropní účinek, experimentální důkazy naznačují, že se nejedná o beta-adrenergní agonistu. Inhibuje aktivitu fosfodiesterázy cyklického adenosinmonofosfátu (c-AMP) myokardu a zvyšuje buněčné hladiny c-AMP. Na rozdíl od digitalisu neinhibuje aktivitu adenosintrifosfatázy sodno-draselné.
vzhledem ke své vazodilatační aktivitě inamrinon snižuje afterload a preload svým přímým relaxačním účinkem na hladkou svalovinu cév.
Farmakokinetika
Po intravenózní bolus (1 až 2 minuty) injekce 0,68 mg/kg do 1,2 mg/kg zdravým dobrovolníkům, Inamrinon měl distribuční objem 1,2 l/kg, a po rozdělovací fáze half-life asi 4,6 minut v plazmě, měl na mysli zjevné prvního řádu terminální eliminační poločas asi 3,6 hodin. U pacientů s městnavým srdečním selháním léčených infuzemi Inamrinon průměrná zdánlivá prvního řádu terminální eliminační poločas byl přibližně 5,8 hodin.
Inamrinon byl v jedné studii 10% až 22% vázán na bílkoviny lidské plazmy ultrafiltrací in vitro a v jiné studii 35% až 49% vázán buď ultrafiltrací nebo rovnovážnou dialýzou.
primární cesta vylučování u člověka je močí jako Inamrinon a několik metabolitů (N-glykolyl, N-acetát,O-glukuronid a N-glukuronid). U normálních dobrovolníků bylo přibližně 63% perorální dávky Inamrinonu značeného 14C vyloučeno močí po dobu 96 hodin. V prvních 8 hodinách bylo 51% radioaktivity v moči Inamrinon s 5% jako N-acetát, 8% jako N-glykolát a méně než 5% pro každý glukuronid. Přibližně 18% podané dávky bylo vyloučeno stolicí za 72 hodin.
ve 24hodinové neradioaktivní intravenózní studii bylo 10% až 40% dávky vyloučeno močí jako nezměněný Inamrinon, přičemž N-acetyl metabolit představoval méně než 2% dávky.
V městnavé srdeční selhání pacienti po úvodní bolusovou dávku, plazmatické hladiny v ustáleném stavu asi 2,4 mcg/mL, byli schopni být udržována infuzí 5 mcg/kg/min do 10 mcg/kg/min. V některých městnavé srdeční selhání u pacientů, spojené s poruchou renální a jaterní perfuze, je možné, že plazmatické hladiny Inamrinon se může zvýšit během infuze období; proto u těchto pacientů, může být nezbytné monitorovat hemodynamické odezvy a/nebo drog úrovni. Hlavní opatření z odpovědi pacienta patří srdeční index, plicní kapilární tlak v zaklínění, centrální žilní tlak, a jejich vztah k plazmatické koncentrace. Kromě toho může být užitečné měření krevního tlaku, výdeje moči a tělesné hmotnosti, stejně jako klinické příznaky, jako je orthopnoe, dušnost a únava.
Farmakodynamika
U pacientů s depresí funkce myokardu, Inamrinon produkuje rychlé zvýšení srdečního výdeje v důsledku jeho inotropní a vazodilatační akce.
po jednorázové intravenózní bolusové dávce Inamrinonu 0.75 mg/kg 3 mg/kg u pacientů s městnavým srdečním selháním, dávce maximální zvýšení srdečního výdeje dojít (o 28% na 0,75 mg/kg až o 61% na 3 mg/kg). Maximální účinek nastává během 10 minut při všech dávkách. Trvání účinku závisí na dávce, trvá přibližně 1/2 hodiny při dávce 0,75 mg / kg a přibližně 2 hodiny při dávce 3 mg / kg.
za stejný rozsah dávek, plicní kapilární tlak v zaklínění a celkové periferní rezistence show dávce klesá (průměrný maximální pokles o 29% v plicní kapilární tlak v zaklínění a 29% v systémové vaskulární rezistence). Při dávkách do 3 mg / kg bylo pozorováno snížení diastolického tlaku v závislosti na dávce (až o 13%). Průměrný arteriální tlak klesá (9,7%) v dávce 3 mg/kg. Srdeční frekvence je obecně nezměněna.
změny hemodynamických parametrů jsou udržovány během kontinuální intravenózní infuze a poté několik hodin.
Inamrinon je účinný u plně digitalizovaných pacientů, aniž by způsoboval známky toxicity srdečního glykosidu. Jeho inotropní účinky jsou aditivní k účinkům digitalisu. V případě flutteru/fibrilace síní je možné, že Inamrinon může zvýšit míru komorové odpovědi kvůli jeho mírnému zvýšení vedení A / V. V těchto případech se doporučuje předchozí léčba digitalisem.
bylo pozorováno zlepšení funkce levé komory a zmírnění městnavého srdečního selhání u pacientů s ischemickou chorobou srdeční. Ke zlepšení došlo bez vyvolání příznaků nebo elektrokardiografických příznaků ischémie myokardu.
při konstantní srdeční frekvenci a krevním tlaku dochází ke zvýšení srdečního výdeje bez měřitelného zvýšení spotřeby kyslíku v myokardu nebo změn rozdílu arteriovenózního kyslíku.
inotropní aktivita je udržována i po opakovaných intravenózních dávkách Inamrinonu. Podávání inamrinonu vyvolává hemodynamické a symptomatické přínosy u pacientů, kteří nejsou uspokojivě kontrolováni konvenční terapií diuretiky a srdečními glykosidy.
Indikace a Využití pro Inamrinon
Inamrinon injekce je pro krátkodobé řízení městnavé srdeční selhání. Z důvodu omezených zkušeností a potenciálu pro závažné nežádoucí účinky (viz NEŽÁDOUCÍ ÚČINKY), Inamrinon by měl být používán pouze u pacientů, kteří mohou být pečlivě sledováni a kteří dostatečně nereagovali na digitalis, diuretika a/nebo vazodilatancia. Zkušenosti s intravenózním Inamrinonem v kontrolovaných studiích nepřesahují 48 hodin opakovaných bolusů a / nebo kontinuálních infuzí.
Ať už ústně, průběžně intravenózně, nebo přerušovaně intravenózně, ani Inamrinon ani žádné jiné cyklické-AMP-dependentní inotrope bylo prokázáno v kontrolovaných studiích, aby byly bezpečné nebo účinné při dlouhodobé léčbě městnavého srdečního selhání. V kontrolovaných studiích chronické perorální terapie s různými tyto látky (včetně Inamrinon), příznaky nebyly důsledně zmírnit, a cyklické-AMP-dependentní inotropika jsou trvale spojena se zvýšeným rizikem hospitalizace a smrti. Zdálo se, že pacienti se symptomy NYHA třídy IV jsou zvláště ohroženi.
kontraindikace
Inamrinon je kontraindikován u pacientů s přecitlivělostí na něj.
je také kontraindikován u pacientů, o nichž je známo, že jsou přecitlivělí na bisulfity.
Varování
Obsahuje disiřičitanu sodného, siřičitanu, který může způsobit alergické reakce zahrnující anafylaktické příznaky a život ohrožující nebo méně závažné astmatické příhody v určitých vnímavých lidí. Celková prevalence siřičitanové citlivosti v obecné populaci není známa a pravděpodobně nízká. Citlivost na siřičitany je pozorována častěji u astmatiků než u neastmatických lidí.
bezpečnostní Opatření
Obecné
Inamrinon by neměl být používán u pacientů s těžkou aortální nebo plicní onemocnění chlopní namísto chirurgické úlevu obstrukce. Stejně jako ostatní inotropní látky může zhoršit obstrukci výtokového traktu při hypertrofické subaortální stenóze.
Během intravenózní terapie s Inamrinon, krevní tlak a tepová frekvence by mělo být sledováno a rychlost infuze zpomalit nebo zastavit u pacientů ukazuje, nadměrné snížení krevního tlaku.
pacienti, kteří dostávali intenzivní diuretickou léčbu, mohou mít nedostatečný srdeční plnicí tlak, aby adekvátně reagovali na Inamrinon, v takovém případě může být indikována opatrná liberalizace příjmu tekutin a elektrolytů.
supraventrikulární a ventrikulární arytmie byly pozorovány u léčené populace s velmi vysokým rizikem. Zatímco Inamrinon sám o sobě nebyl prokázán jako arytmogenní, potenciál arytmie, přítomný při městnavém srdečním selhání samotném, může být zvýšen jakýmkoli lékem nebo kombinací léků.
byla zaznamenána trombocytopenie a hepatotoxicita (viz nežádoucí účinky).
použití při akutním infarktu myokardu
nebyly provedeny žádné klinické studie u pacientů v akutní fázi postmyokardiálního infarktu. Proto se Inamrinon v těchto případech nedoporučuje.
laboratorní testy
tekutiny a elektrolyty
změny tekutin a elektrolytů a funkce ledvin by měly být během léčby Inamrinonem pečlivě sledovány. Zlepšení srdečního výdeje s výslednou diurézou může vyžadovat snížení dávky diuretika. Ztráta draslíku v důsledku nadměrné diurézy může předisponovat digitalizované pacienty k arytmiím. Hypokalémie by proto měla být korigována doplňováním draslíku před použitím Inamrinonu nebo v jeho průběhu.
lékové Interakce
V relativně omezené zkušenosti, žádné nežádoucí klinické projevy byly pozorovány u pacientů, u kterých Inamrinon byl používán současně s těmito léky: glykosidy; lidokain, chinidin; metoprolol, propranolol; hydralazin, prazosin; isosorbid dinitrát, nitroglycerin; chlorthalidon, kyselina ethakrynová, furosemid, hydrochlorothiazid, spironolakton; kaptopril; heparin, warfarin; doplňky draslíku; inzulín; diazepam.
byl hlášen jeden případ nadměrné hypotenze, pokud byl Inamrinon užíván současně s disopyramidem.
dokud nejsou k dispozici další zkušenosti, souběžné podávání s disopyramidem by mělo být prováděno s opatrností.
chemické interakce
chemická interakce nastává pomalu po dobu 24 hodin, kdy je intravenózní roztok Inamrinonu smíchán přímo s roztoky obsahujícími dextrózu (glukózu). Inamrinon by proto neměl být před injekcí ředěn roztoky, které obsahují dextrózu (glukózu).
chemická interakce nastává okamžitě, o čemž svědčí tvorba sraženiny, když je furosemid injikován do intravenózní linie infuze Inamrinonu. Furosemid by proto neměl být podáván intravenózně obsahujícími Inamrinon.
Karcinogeneze, Mutageneze, Poškození Fertility
Tam byl žádný náznak karcinogenní potenciál s Inamrinon když byl podáván perorálně po dobu dvou let potkanům a myším v dávkách až do maximální tolerované dávce 80 mg/kg/den.
myším mikronukleárním testu (na 7,5 až 10-násobek maximální dávky pro člověka) a ovarií Čínského křečka chromozomové aberace byly pozitivní, což naznačuje, jak klastogenní potenciál a potlačení počet polychromatických erytrocytů. Nicméně, test Ames Salmonella, studie myších lymfomů a kultivovaná analýza metafázy lidských lymfocytů byly všechny negativní. Klastogenní účinky jsou na rozdíl od negativních výsledků získaných ve studiích fertility samců a samic potkanů a třígenerační studie na potkanech, obě s perorálním dávkováním.
v těchto studiích bylo pozorováno mírné prodloužení březosti potkanů při dávkách 50 mg / kg / den a 100 mg / kg / den. Dystokie se vyskytla u přehrad, které dostávaly 100 mg / kg / den, což mělo za následek zvýšený počet mrtvě narozených dětí, sníženou velikost vrhu a špatné přežití mláďat.
Těhotenství
Teratogenní Účinky – Těhotenství Kategorie C
V novozélandské bílé králíky, Inamrinon bylo prokázáno, že vyrábět plodu, kosterních a hrubý vnější malformace v perorálních dávkách 16 mg/kg a 50 mg/kg, které byly toxické pro králíka. Studie u francouzských králíků Hy / Cr s perorálními dávkami do 32 mg / kg / den tento nález nepotvrdily. Žádné malformace byly pozorovány u potkanů, kteří dostávali Inamrinon intravenózně v maximální dávka 15 mg/kg/den (přibližně doporučená denní intravenózní dávka u pacientů s městnavým srdečním selháním). Neexistují adekvátní a dobře kontrolované studie u těhotných žen. Inamrinon by měl být používán během těhotenství pouze tehdy, pokud potenciální přínos odůvodňuje potenciální riziko pro plod.
kojící matky
při podávání Inamrinonu kojícím ženám je třeba postupovat opatrně, protože není známo, zda se vylučuje do mateřského mléka.
pediatrické použití
bezpečnost a účinnost u dětských pacientů nebyla stanovena.
nežádoucí účinky
trombocytopenie: Intravenózní injekce Inamrinonu vedla ke snížení počtu krevních destiček pod 100 000 / mm3 nebo k normálním limitům u 2, 4 procenta pacientů.
je častější u pacientů léčených dlouhodobou léčbou. Dosud v pečlivě sledovaných klinických studiích u pacientů, jejichž počet krevních destiček nebyl ponechán v depresi, nebyly pozorovány žádné krvácivé jevy.
snížení počtu krevních destiček je závislé na dávce a objevuje se v důsledku zkrácení doby přežití krevních destiček. Několik pacientů, u kterých se během léčby Inamrinonem vyvinula trombocytopenie, podstoupilo vyšetření kostní dřeně, která byla normální. Neexistují žádné důkazy týkající se snížení počtu krevních destiček s imunitní odpovědí nebo s faktorem aktivujícím destičky.
Gastrointestinální Účinky: Gastrointestinální nežádoucí účinky hlášené s Inamrinon během klinické použití, zahrnovaly nauzeu (o 1,7%), zvracení (0.9%), bolest břicha (o 0,4%) a anorexie (o 0,4%).
Kardiovaskulární Účinky: Kardiovaskulární nežádoucí účinky hlášené s Inamrinon patří arytmie (3%) a hypotenze (1.3%).
jaterní toxicita: U psů, na IV dávkách 9 mg/kg/den a 32 mg/kg/den, Inamrinon ukázal dávce závislá hepatotoxicita se projevuje buď jako enzym, nadmořskou výšku nebo jaterní buňky, nekrózy nebo obojí. Hepatotoxicita byla pozorována u člověka po dlouhodobém perorálním podání a byla pozorována v omezené míře (0, 2%) po intravenózním podání Inamrinonu. Vzácně byly také hlášeny zvýšené hladiny enzymů a bilirubinu a žloutenka.
hypersenzitivita: u pacientů léčených perorálním Inamrinonem po dobu přibližně dvou týdnů byly hlášeny několik zjevných hypersenzitivních reakcí. Známky a příznaky byly variabilní, ale součástí perikarditida, pleuritida a ascites (1 případ), myozitida s intersticiální zastínění na hrudníku x-ray a zvýšená sedimentace (1 případ) a vaskulitidy s nodulární plicní hustoty, hypoxemie, a žloutenka (1 případ). První pacient zemřel, ne nutně na možnou reakci, zatímco poslední dva ustoupili přerušením léčby. Žádný z případů byly rechallenged tak, aby přiřazení Inamrinon není jisté, ale možné hypersenzitivní reakce by měla být zvážena u každého pacienta, udržuje delší dobu na Inamrinon.
Obecně: Další nežádoucí účinky pozorované v intravenózní Inamrinon klinických studiích patří horečka (0.9%), bolest na hrudi (0.2%), a pálení v místě vpichu (o 0,2%).
léčba nežádoucích účinků
snížení počtu krevních destiček: Asymptomatické snížení počtu krevních destiček (<150 000/mm3), může být obrácená do jednoho týdne po snížení dávky léku. Dále, bez změny dávkování léku, počet se může stabilizovat na nižších než před lékem bez klinických následků. Při rozhodování o úpravách dávkování se doporučuje počet krevních destiček před lékem a časté počty krevních destiček během léčby.
Pokud se počet krevních destiček vyskytne méně než 150 000 / mm3, lze zvážit následující kroky:
* Udržujte celkovou denní dávku beze změny, protože v některých případech se počet stabilizoval nebo se vrátil na úroveň před léčbou. * Snížení celkové denní dávky. * Přerušte podávání Inamrinonu, pokud podle klinického úsudku lékaře riziko převyšuje potenciální přínos.
Gastrointestinální Vedlejší Účinky: Při gastrointestinální nežádoucí účinky byly pozorovány zřídka s intravenózní terapie, by měla závažné nebo oslabující ty, které se vyskytují, lékař může chtít snížit dávku nebo ukončit léku na základě obvyklého prospěch-riziko úvahy.
jaterní toxicita: Z dosavadních klinických zkušeností s intravenózním podáním byla hepatotoxicita pozorována vzácně. Pokud akutní označeny změny v jaterní enzymy se vyskytují spolu s klinickými příznaky, což naznačuje, idiosynkratické reakce přecitlivělosti, Inamrinon terapie by měla být okamžitě ukončena.
Pokud se vyskytnou méně než výrazné změny enzymů bez klinických příznaků, měly by být tyto nespecifické změny hodnoceny individuálně. Lékař může chtít pokračovat v Inamrinonu, snížit dávkování nebo přerušit léčbu na základě obvyklých úvah o přínosu a riziku.
Předávkování
smrt byla hlášena s masivní náhodné předávkování (840 mg v průběhu tří hodin po počáteční bolus a infuze) Inamrinon, i když příčinná souvislost je nejistá. Během přípravy a podávání přípravku je třeba dbát na pečlivost.
dávky Inamrinonu mohou vyvolat hypotenzi kvůli jeho vazodilatačnímu účinku. Pokud k tomu dojde, podávání Inamrinonu by mělo být sníženo nebo přerušeno. Není známo žádné specifické antidotum, ale měla by být přijata obecná opatření pro podporu oběhu.
U krys LD50 Inamrinon, jako laktát, sůl, byl 102 mg/kg nebo 130 mg/kg intravenózně ve dvou různých studiích a 132 mg/kg orálně (intragastrically); jako suspenze ve vodném guma tragant orální LD50 bylo 239 mg/kg.
Inamrinon Dávkování a způsob Podání
Načítání dávky Inamrinon injekce by měly být podávány tak, jak je dodán (neředěný). Infuze Inamrinonu mohou být podávány v normálním nebo napůl normálním fyziologickém roztoku do koncentrace 1 mg / mL až 3 mg / ml. Zředěné roztoky by měly být použity do 24 hodin.
Inamrinon injekce mohou být podávány do běhu dextróza (glukóza) infuzí přes Y-Konektor, nebo přímo do hadičky, kde je vhodnější.
chemické interakce
chemická interakce nastává pomalu po dobu 24 hodin, kdy je intravenózní roztok Inamrinonu smíchán přímo s roztoky obsahujícími dextrózu (glukózu). Inamrinon by proto neměl být před injekcí ředěn roztoky, které obsahují dextrózu (glukózu).
chemická interakce nastává okamžitě, o čemž svědčí tvorba sraženiny, když je furosemid injikován do intravenózní linie infuze Inamrinonu. Furosemid by proto neměl být podáván intravenózně obsahujícími Inamrinon.
pro podání injekce Inamrinonu se doporučuje následující postup:
1. Zahajte terapii nasycovací dávkou 0, 75 mg / kg podávanou pomalu po dobu 2 až 3 minut.
|
LOADING DOSE DETERMINATION 0.75 mg/kg (undiluted) |
||||||||||
|
Patient Weight in kg |
||||||||||
|
mL of undiluted Inamrinone Injection |
||||||||||
2. Continue therapy with a maintenance infusion between 5 mcg/kg/min and 10 mcg/kg/min.
3. Based on clinical response, an additional loading dose of 0.75 mg/kg may be given 30 minutes after the initiation of therapy.
4. Rychlost infuze se obvykle pohybuje od 5 mcg/kg/min do 10 mcg/kg/min takové, že doporučená celková denní dávka (včetně nakládky dávkách) není vyšší než 10 mg/kg. Omezený počet pacientů studovaných při vyšších dávkách podporuje dávkovací režim až do 18 mg / kg / den pro zkrácené trvání léčby.
následující tabulka rychlosti infuze může být použita k zajištění správného výpočtu.
pro využití grafu musí být koncentrace použitého infuzního roztoku Inamrinonu 2,5 mg / mL (2500 mcg / mL). Tato koncentrace se připraví smícháním roztoku Inamrinonu se stejným objemem ředidla(normální nebo poloviční normální fyziologický roztok).
| * Ředění: K přípravě 2,5 mg/mL koncentrace, doporučuje se pro infuze mix Inamrinon se stejným objemem rozpouštědla. Například, smíchejte tři 20 mL lahviček Inamrinon (3 x 20 mL = 60 mL) 60 mL ředicího roztoku na celkový objem 120 mL konečného 2,5 mg/mL roztok Inamrinon. | ||||||||||
|
Inamrinone IV INFUSION RATE (mL/hr) CHART Using 2.5 mg/mL Infusion Concentration* |
||||||||||
|
Patient Weight in kg |
||||||||||
|
Dosage: 5.0 mcg/kg/min |
||||||||||
|
7.5 mcg/kg/min |
||||||||||
|
10.0 mcg/kg/min |
||||||||||
Example: A 70 kg patient would require a loading dose of 10.5 mL of undiluted Inamrinone. If the physician selects a dose of 7.5 mcg / kg / min pro infuzi by průtok byl 13 mL / h při koncentraci 2, 5 mg/mL Inamrinonu.
5. Rychlost podávání a doba trvání léčby by měla být upravena podle odpovědi pacienta. Lékař může chtít snížit nebo titrovat infuzi směrem dolů na základě klinické odpovědi nebo nepříznivých účinků.
lze očekávat, že výše uvedené dávkovací režimy umístí plazmatickou koncentraci Inamrinonu u většiny pacientů na přibližně 3 mcg / ml. Zvýšení srdečního indexu ukazuje lineární vztah k plazmatické koncentraci v rozmezí 0.5 mikrogramů / mL až 7 mikrogramů / ml. Při vyšších plazmatických koncentracích nebyla pozorována žádná pozorování.
zlepšení stavu Pacienta se může projevit zvýšením srdečního výdeje, snížení plicní kapilární tlak v zaklínění, a takové klinické odpovědi jako zmírnění dušnosti a zlepšení v jiné příznaky srdečního selhání, jako ortopnoe a únava.
monitorování centrálního žilního tlaku (CVP) může být cenné při hodnocení hypotenze a řízení rovnováhy tekutin. Předchozí korekce nebo úprava tekutin / elektrolytů je nezbytná pro dosažení uspokojivé odpovědi s Inamrinonem.
parenterální léčivé přípravky by měly být vizuálně kontrolovány a neměly by se používat, pokud jsou pozorovány částice nebo změna barvy.
jak se Inamrinon dodává
Inamrinon injekce USP se dodává v jednodávkových injekčních lahvičkách po 20 mL sterilního, čirého žlutého roztoku jednotlivě v krabičce. NDC 55390-042-10.
jeden 1 mL obsahuje inamrinoni laktas odpovídající inamrinonum 5 mg.
Chraňte před světlem. Obal je odolný proti světlu pro ochranu během skladování. Uchovávejte v krabičce až do doby použití.
uchovávejte při kontrolované pokojové teplotě 15 ° až 30°C (59° až 86°F).
Manufactured by: Manufactured for:
Ben Venue Laboratories, Inc. Bedford Laboratories™
Bedford, OH 44146 Bedford, OH 44146
August 2002 AMR-P01
VIAL LABEL

Vial Label 100 mg/20 mL
| Inamrinone Inamrinone injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Bedford Laboratories (884528407)
Registrant – Ben Venue Laboratories (004327953)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Ben Venue Laboratories Inc. | 004327953 | MANUFACTURE(55390-042) | |
More about inamrinone
- Side Effects
- During Pregnancy
- Dosage Information
- Drug Interactions
- Drug class: inotropic agents
Related treatment guides
- Heart Failure
Medical Disclaimer