téměř Ve všech Fe–S proteiny, Fe centra jsou tetraedrické a terminálu ligandy jsou thiolato síry center z cysteinyl zbytků. Sulfidové skupiny jsou buď dvou-nebo tří-koordinované. Nejběžnější jsou tři různé druhy klastrů Fe-S s těmito vlastnostmi.
2Fe–2S clustersEdit

nejjednodušší polymetalických systému clusteru, je tvořena dvěma ionty železa překlenul o dva sulfid ionty a koordinuje čtyři cysteinyl ligandy (v Fe2S2 ferredoxins) nebo dva cysteines a dva histidines (v Rieske proteiny). Oxidované proteiny obsahují dva ionty Fe3+, zatímco redukované proteiny obsahují jeden iont Fe3+ a jeden iont Fe2+. Tyto druhy existují ve dvou oxidačních stavech (FeIII) 2 a FeIIIFeII. Doména síry železa CDGSH je také spojena s klastry 2Fe-2S.
4Fe–4S clustersEdit
obyčejný motiv obsahuje čtyři ionty železa a čtyři sulfid ionty umístěny na vrcholy kuban-typ clusteru. Centra Fe jsou obvykle dále koordinována cysteinylovými ligandy. Proteiny přenosu elektronů (ferredoxiny) mohou být dále rozděleny na ferredoxiny s nízkým potenciálem (bakteriální typ) a vysokým potenciálem (HiPIP). Ferredoxiny s nízkým a vysokým potenciálem souvisejí s následujícím redoxním schématem:

V HiPIP clusteru dopravu mezi (Fe4S42+) a (Fe4S43+). Potenciály tohoto redoxního páru se pohybují od 0,4 do 0,1 V. v bakteriálních ferredoxinech jsou dvojicí oxidačních stavů (Fe4S4+) a (Fe4S42+). Potenciály tohoto redoxního páru se pohybují od -0,3 do -0,7 V. dvě rodiny klastrů 4Fe-4S sdílejí oxidační stav Fe4S42+. Rozdíl v redoxních párech je přičítán stupni vodíkové vazby, který silně modifikuje zásaditost cysteinylthiolátových ligandů. V nitrogenáze se podílí další redoxní pár, který je stále více redukující než bakteriální ferredoxiny.
některé klastry 4Fe-4S vážou substráty a jsou tedy klasifikovány jako enzymové kofaktory. V akonitáze se klastr Fe–S váže na jedno centrum Fe, které postrádá thiolátový ligand. Shluk neprochází redoxem, ale slouží jako katalyzátor Lewisovy kyseliny k přeměně citrátu na isocitrát. V radikálních enzymech SAM se shluk váže a redukuje S-adenosylmethionin za vzniku radikálu, který se podílí na mnoha biosyntézách.
klastry 3Fe–4SEDIT
proteiny také obsahují centra, která mají o jedno železo méně než běžnější jádra. Tři sulfidové ionty přemostily dva ionty železa, zatímco čtvrtý sulfid přemostil tři ionty železa. Jejich formální oxidační stavy se mohou lišit od+ (forma all-Fe3+) do 2-(forma all-Fe2+). V řadě proteinů železa a síry může být shluk reverzibilně přeměněn oxidací a ztrátou jednoho iontu železa na shluk. Např., neaktivní forma akonitázy má a je aktivována přidáním Fe2+ a redukčního činidla.
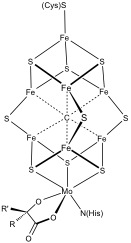
jiné klastry Fe–Sedit
složitější polymetalické systémy jsou běžné. Příklady zahrnují jak klastry 8Fe, tak 7FE v nitrogenáze. Oxid uhelnatý dehydrogenáza a-hydrogenáza mají také neobvyklé shluky Fe-S. V hydrogenázách vázaných na membránu tolerantních k kyslíku byl nalezen speciální 6 cysteinem koordinovaný shluk.