první biologický lék, humanizovaný inzulín (5.8 kDa), byl dostupný v roce 1982 po příchodu biotechnologie a znamenal novou éru ve farmaceutickém průmyslu. Moderní pokroky v biotechnologii umožňují rozsáhlé syntézy biologických látek více či méně nákladově efektivním způsobem. Když jsem kdysi začal s velkým peptidy a rekombinantní proteiny, biologických materiálů, dnes zahrnují širokou škálu dalších subjektů, jako jsou protilátky, monoklonální protilátky, a více nedávno, nanobodies a související objekty, rozpustné receptory, rekombinantní DNA, protilátka-lék konjugáty (ADCs), fúzní proteiny, dne imunoterapeutik, a syntetické vakcíny.
„vycházející hvězdu“ biologických léků bylo zachytit rostoucí pozornost farmaceutických odborníků a analytici, jak tento alternativní lék objev paradigma představuje významné obchodní výzvou pro více tradiční malé molekuly léčiv paradigma vymezující farmaceutického průmyslu pro více než století.
vyvstává tedy otázka: ztrácejí malé molekuly „přitažlivost“ jako výzkumné objekty pro objevování drog v moderním světě biologického pokroku? Někteří odborníci se zůstat optimistický o potenciálu malých molekul vést závod v budoucnosti farmaceutické potrubí, ostatní vnímají, že „peníze se mění kapsy“, a malé molekuly výzkum bude stále více opomíjen ze strany akcionářů a investorů ve prospěch biologických materiálů.
abychom zjistili, kam směřuje průmysl, začněme nejprve trochou statistik. Po dobu 7 let (2010-2017) USA. Úřad pro kontrolu potravin a léčiv (FDA) schválil celkem 262 nových molekulárních entit (NMEs), s výjimkou několika diagnostických zobrazovacích činidel a 1 analogu inzulínu (ref). Zdá se, že 76% z nich jsou malé molekuly (199), přičemž pouze čtvrtina je biologická. Zajímavé je, že neexistuje žádný zjevný růst v biologických NMEs schválení vzhledem k malé molekuly jako obě kategorie therapeutics jsou trendy v docela podobným způsobem, jak je znázorněno na obrázku níže. Nicméně, protože biologických materiálů, jsou cenově velmi odlišně od malých molekul (jsou dražší), obraz je jiný, když se podíváme na celkové prodeje a příjmy růst: v období od roku 2011 do roku 2017 biologické tržeb vzrostla o 70% a dosáhl $232 miliard. Podíl na celkovém farmaceutickém trhu, který biologics drží, se zvýšil ze 16% v roce 2006 až na 25% v roce 2016, bez zjevných známek zpomalení (ref).
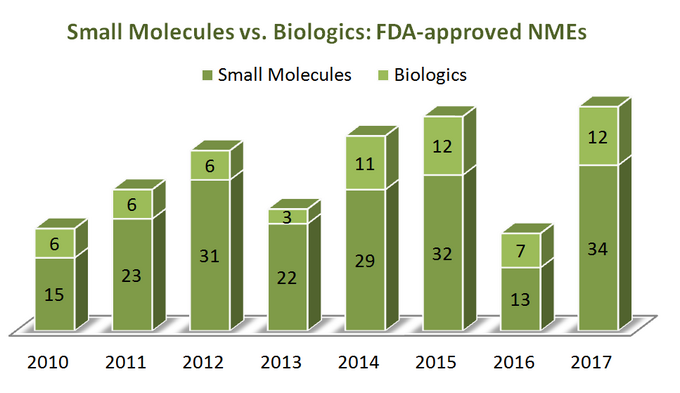
Zatímco tam jsou výrazné výhody biologics přes malé molekuly v několika ohledech (například, jejich hluboké selektivity), věci nejsou „černé a bílé“ při porovnání těchto dvou skupin léčiv, jejich atributy, jako oba z nich mají podstatné výhody a nevýhody, aby zvážila při strategickém rozhodování. Takže se zdá, trochu politováníhodné vidět, jak četné zprávy na vedlejší kolej SMs, když ve srovnání s biologickými ve snaze o „čerstvosti“ jejich názory.
uvedená tabulka shrnuje některé silné a slabé aspekty obou kategorií (ref, ref) ilustruje výzvy a příležitosti k dispozici v obou „táborů“ (poznámka: barvy: šedá-bez zjevného výhodu ani v jednom táboře; zelená-výhodné situace; žlutá-nevýhodné situace):
Malé Molekuly |
Biologics |
|---|---|
|
Obecné vlastnosti |
|
|
Nízké molekulární váhy (0,1 – 1 kDa); obvykle chemicky a tepelně stabilní, široký rozsah polarity. |
velmi velké molekulové hmotnosti > 1 kDa; obecně polární, citlivé na teplo, snadno degradovány (s výjimkou některých dlouho žijících druhů, jako jsou monoklonální protilátky) |
|
Selektivity, bezpečnosti, |
|
|
Spíše promiskuitní, obvykle se váží na různé off-target stránek, vykreslování vedlejší účinky nebo toxicitu. A konečně, biologičtí vývojáři měli snazší získání patentů, protože v oboru, kdy byly objeveny současné trháky, bylo málo nebo vůbec žádné. |
Velmi specifické cíle, obecně nižší toxicitě (s jednou významnou výjimkou, že se z imunogenicity, která může vážně ovlivnit efektivitu, bezpečnost a dispozice biologických látek). |
|
propustnost Buněk |
|
|
SMs vázat s cíli, jako je G-protein-coupled receptory (GPCRs), ligand-gated iontové kanály a receptory tyrosin kinázy na extracelulární nebo intracelulární domény. Mohou přistupovat k cílům v intracelulárních oblastech, cytosolům, jádrům a dokonce i cílům CNS, odděleným těsnou hematoencefalickou bariérou (BBB). |
velká část farmakologických cílů je zakotvena, a proto je biologům nepřístupná. Zejména, když přijde na centrální nervový systém (CNS), přítomnost krve-bariéra mozku je hlavní překážkou na cestě nějaké molekuly větší než 600 Da omezení až 98% SMs a prakticky všech biologických materiálů. |
|
Dodávka |
|
|
do značné Míry spadají do „Pravidlo pěti“ pro perorální absorpci, takže je vhodný pro orální dodání. Další permeabilita střevním epitelem je primárně zprostředkována kombinací pasivní difúze a paracelulárního transportu. |
Vnitřní nestability a vysoké molekulové hmotnosti činí téměř všech biologických ústně neaktivní. Většinou probíhá invazivní dodávka nebo alternativní neinvazivní technologie. |
|
Rozdělení |
|
|
SMs zprávy jsou distribuovány prostřednictvím krevního oběhu, což umožňuje dosažení vybrat koncentrace rychle. |
Pro větší molekuly (např. >10 kDa) a pomalejší (100-500 krát) lymfatický systém se stává dominantní v procesu distribuce. Větší biologics šířit prostřednictvím krve a lymfatického systému pohybu konvektivní transport, receptorem zprostředkovanou endocytózu, fagocytóza a pinocytóza. Výsledkem této situace je, že větší biologických materiálů mají delší poločas-omezené objemy distribuce, a potřebují více času k dosažení maximální koncentrace, ve srovnání se SMs. |
|
Dispozice (metabolismus) |
|
|
Most SMs jsou odstraněny pomocí non-cílené orgánů-prostřednictvím cytochromu nebo non-cytochromu metabolismus, renální filtrace, nebo fekální vylučování. |
Biologics mít těsnější interakce s cíli, takže jejich ustanovení jsou přímo ovlivněny jejich závazné (receptor-mediated drug disposition), včetně prověření biologických proteázy a peptidázy. |
|
lékové interakce |
|
|
SMs jsou náchylné k lékových interakcí, které mohou nastat v důsledku přítomnosti současně užívaných léků, které ovlivňují jejich transport, metabolismus, transport, nebo eliminační cesty. |
biologové jsou méně náchylní k tradičním lékovým interakcím, protože podléhají metabolismu a eliminaci jako endogenní substráty. Existují však zdokumentované změny enzymů metabolizujících léky zprostředkované cytokiny, proto je třeba posoudit lékově biologické interakce v případě, že by léčivo mohlo ovlivnit expresi metabolických enzymů. |
|
Obchodní aspekty |
|
|
Nízké ceny pro SM drogy. |
typicky velmi vysoké ceny biologických ošetření. To je považováno za jeden z důvodů, proč se zdá, že biologové přinášejí lepší celkové ekonomické výnosy ve srovnání s SMs. |
|
Vysoká míra opotřebení (2009 studie RP Skupiny ukázal, že pouze 7,1% SMs vstupem do preklinické testování nakonec dosáhl na trhu). |
Relativně nízká míra opotřebení (stejné RP Skupiny studie odhalila, 24,4% z preklinické fázi biologics přežil až do tržní fázi). |
|
Severe competition from chemical generics after patents expiration. |
Biologics developers face less severe competition from biosimilars, after patents expiration. |
|
Simpler drug discovery/development process. |
More expensive and complex drug discovery and development process, compared to biologics. |
Vzhledem k výše uvedenému srovnání, je zřejmé, že biologics nejsou „všelékem“ a průmysl nebude ovládán biologickými v dohledné budoucnosti, spíše konkurenční rovnováha bude zachována mezi malé molekuly, biologické materiály a hybridní formy therapeutics, jako ADCs-s místní nadvládu každý formulář ve více vhodných terapeutických oblastí, případy použití, atd.
Kromě toho, níže je seznam několika ovladače průmyslu, které se hraje na straně malých molekul a může mít vliv na rovnováhu sil v celkové farmaceutickém trhu ve prospěch chemické výchozí body:
vzestup umělé inteligence (AI) v drug discovery
Následující objevy v hluboké učení algoritmů (2012) a v poslední době, vytvoření generativní sporné sítí (GANs), možnost aplikace excel v řadě výzkumných úkolů, zájem v různých AI technologií vyletěl skoro v každém odvětví. Mnoho nástrojů poháněných umělou inteligencí se rychle stalo komerčním mainstreamem, jako jsou chatboty, osobní asistenti, autopiloti atd.– což je skutečný důkaz koncepce proveditelnosti AI.
Lék objev není výjimkou, aby tento „AI-řízený trend“, a počet začínajících se snaží aplikovat AI zvýšit léčiv v různých způsobů, jak se podstatně více než jen několik let poté, co dosáhl více než sto aktivních firem k dnešnímu dni (tady je seznam některých z nich).
je zajímavé, že většina startupů řízených umělou inteligencí je zaměřena spíše na objevování malých molekul než na biologii, což pravděpodobně není překvapující. Historicky, dokonce i výpočetní metody bez AI (cheminformatika) byly primárně používány pro terapie malými molekulami kvůli jejich podstatně jednodušším molekulárním strukturám a interakčním vzorcům.
níže uvedené schéma ukazuje odhadované statistiky pro 61 aktivně výrobce léčiv začínajících rozvíjení nebo použití specializovaných AI-nástroje v jejich výzkumu workflow. Jak vidíte, polovina všech společností (51%, 31 startupů) je zaměřena na malé molekuly, zatímco pouze 23% (14 startupů) se podílí na objevování / vývoji biologických léků (protilátky, vakcíny atd.). Disproporce na malé molekuly, je také dobře ilustruje množství VC prostředků získaných kolektivně 61 přezkoumána AI-řízený startech (zveřejněny kol) – kde 770 milionů bylo investováno do těchto společností zapojených v malých molekul a jen o něco více než 200 milionů eur bylo vyčleněno pro biologics zaměřené startupy-jak je uvedeno níže.
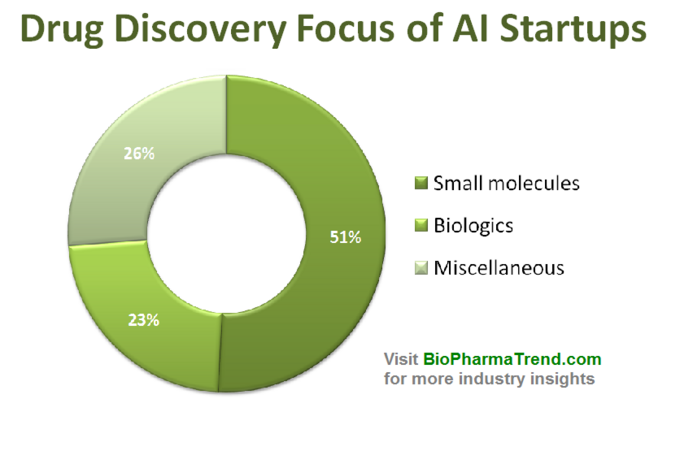
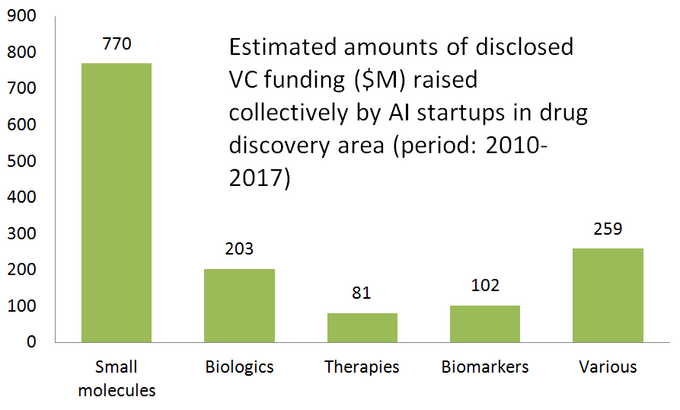
Tato situace naznačuje, že nedávné pokroky v AI algoritmy a trend použít strojového učení pro rané fázi farmaceutického výzkumu mají tendenci řídit více růst v malých molekul léčiv, ve srovnání s biologickými objev-alespoň pro teď. To by mohlo vést k větší budoucí investice do malé molekuly zaměřené projekty podpořené AI-řízené technologie.
Dosažení „undruggable“ cíle
Tak důležitých cílů, jako je například, protein-protein interakce (Ipp), jsou tradičně dominují biologics (mAbs) jako potenciální aktéry, zatímco malé molekuly byly dlouho považovány za nevhodné v tomto případě, vzhledem k jejich malé velikosti.
S pokroky v farmakogenomika, tato situace se může změnit poměrně rychle, po schválení maravirok (514 Da) a tirofibanu (441 Da). Bylo zjištěno, výpočetně že SMs může mít relativně vysoké afinity ke konkrétním rozhraní bílkovin, a co je důležitější, mohou modulovat ‚vnitřně neuspořádaných proteinů regionů spojené se souborem komplexních systémů onemocnění. Zde je jedna zajímavá obálka tohoto tématu shrnující některé důležité poznatky o strojích PPI získaných v posledních desetiletích.
Další rychle rostoucí oblastí pro objev léku s malými molekulami je cílení na ribonukleovou kyselinu (RNA). Toto téma bylo uvedeno v „Top 7 Trends In Pharmaceutical Research In 2018“, a také tam byl podrobný přehled tématu v buněčné chemické biologii a pěkný průmysl zakrýt v C&EN.
Další svěží nápad, aby se uvolnil sílu malých molekul byla projednána v nedávné články, Cílená protein rozpad jsou nově, jak malé molekuly vypadat a chovat se, zveřejněné v C&CS v roce 2018. Strategie je rozvíjet bifunkční malé molekuly schopen trasy cílený protein úplně proteazom, mobilní koše-odstranění stroje, místo toho jen, že inhibuje protein je akční jako v „tradiční“ přístup.
Překonání omezení screeningu technologií
hodně výzkumný potenciál malých molekul nebyl zatím realizován v důsledku různých technologických omezení screeningu přístupů používaných pro určování počáteční body v drug discovery programy.
Jeden takový příklad je fenotypová screening, který zažívá renesanci v dnešní době v důsledku několika technologický pokrok, včetně zvýšení schopnosti rozvíjet fyziologicky relevantní mobilní modely, výstupy, a sofistikované detekční technologie pomáhá odhalit mechanismy působení (MoA) efektivněji, čímž se minimalizuje nejistotu. Na druhé straně implementace technik profilování ve velkém měřítku a výpočetních metod nabízí novou úroveň systémové analýzy a porozumění fenotypům malých molekul.
dalším slibným screeningovým paradigmatem je použití knihoven kódovaných DNA (DELs). Díky svému jedinečnému uspořádání poskytuje technologie DEL vhodný způsob testování stovek milionů a dokonce miliard nových molekul v cílových programech pro objevování drog. I když tato technologie není bez problémů (např. omezení DNA-kompatibilní chemie, nejistoty promítání hity, atd.), oblast je rychle roste a je dokonce považován za „revoluční“ pro malé molekuly léčiv.
Překonání synthesizability bariéru
Jeden z úrazu kameny v raném stadiu malých molekul léčiv je omezení synteticky dostupné chemické prostoru-zatímco hodně slibné chemické nápady mohou být generovány výpočetně, nebo jinak, tam je vždy riziko, že syntetizovat celou řadu sloučenin k ověření takových nápadů by bylo nákladné, nebo dokonce nerealizovatelná.
nedávné pokroky v této oblasti byly opět provedeny pomocí softwaru založeného na AI, který nabízí výkon plánování syntézy na lidské úrovni. Například, BenevolentAI nedávno publikoval článek v Nature, který popisuje, jak se používá hluboké neuronové sítě v kombinaci s moderní strom, vyhledávací algoritmy plánovat syntézy nových molekul s pozoruhodnou úspěšnost a rychlost.
Několik zajímavých kryt ups s bohatou komentáře byly zveřejněny zde a zde Derek Lowe poskytnout trochu více nahlédnout do této fascinující oblasti organické a medicinální chemie.
empiričtější strategie byla vyvinuta chemickým producentem Enaminem, který je známý jako skutečný chemický prostor a v současné době zahrnuje více než 3.8 miliard synteticky přístupných a prohledávatelných molekul pro průzkum hitů a další úkoly léčivé chemie. Koncept se scvrkává na použití nastavit interně validovaných chemických trasy (přes 100 reakcí) na velký bazén chemických stavebních bloků k dispozici na vlastním skladě (nad 100 tisíc sloučenin) – s cílem kombinovat je v kombinacích k vytvoření kaskády větší „vést“ nebo „drog jako“ molekuly. Jakmile určitý stupeň reprodukovatelnosti a výnos je dosaženo v dostatečně velké sadě experimentů (alespoň 80%), dále výpočetní výčet koná vybudovat širší chemické prostoru na základě experimentálně potvrzených případů.
Nový R&D trhů a role malé molekuly
všichni ve Všech, jeden může přehlédnout nebo špatně velikost a růstový potenciál malých molekul potrubí, jak bylo uvedeno během panelové diskuse v Interphex. V současné době je v R&D aktivní přibližně 8000 malých molekul, což je 25% růst za posledních pár let. Výše uvedené faktory růstu mohou vést k dalšímu zrychlenému růstu v tomto odvětví.
je také důležité si uvědomit, že malé molekuly drogy, by mohla hrát důležitou roli v některé příští generace léků, což je závislé na malé molekuly potrubí. Například v případě terapie kmenovými buňkami mohou malé molekuly vyvolat terapeutické reakce.
jak bylo zdůrazněno během Cphi Severní Americe MilliporeSigma Jeffrey Shumway, produkty s malými molekulami mají tendenci být složitější a měnit jejich roli v (bio)farmaceutickém průmyslu.
Konečně, budoucí oblasti pro malé molekuly je protilátka-lék konjugátů a souvisejících objektů, který se ukázal jako nadějný třída therapeutics vzhledem k přirozené sbližování dvou léčiv paradigmata a více technologické trendy.
zřeknutí se odpovědnosti: informace jsou určeny pouze pro všeobecné povědomí a nejedná se o právní/finanční/akciové obchodování/lékařské poradenství jakéhokoli druhu. Čtete je na vlastní vůli a jakékoli použití těchto informací je na vaše vlastní riziko. Je to vaše povinnost hodnotit užitečnost a bezpečnost informací v tomto příspěvku, a Internetu obecně, a jak to platí pro váš vlastní situaci a pak konzultovat příslušné odborníky pro profesionální poradenství v případě potřeby.
témata: Trendy v oboru