
Sau (Larry) Lee, Ph.d., Náměstek Ředitele Úřadu pro Zkoušení a Výzkum a Předseda nově Vznikající Technologie, Tým, Kancelář Farmaceutické Kvality, CDER
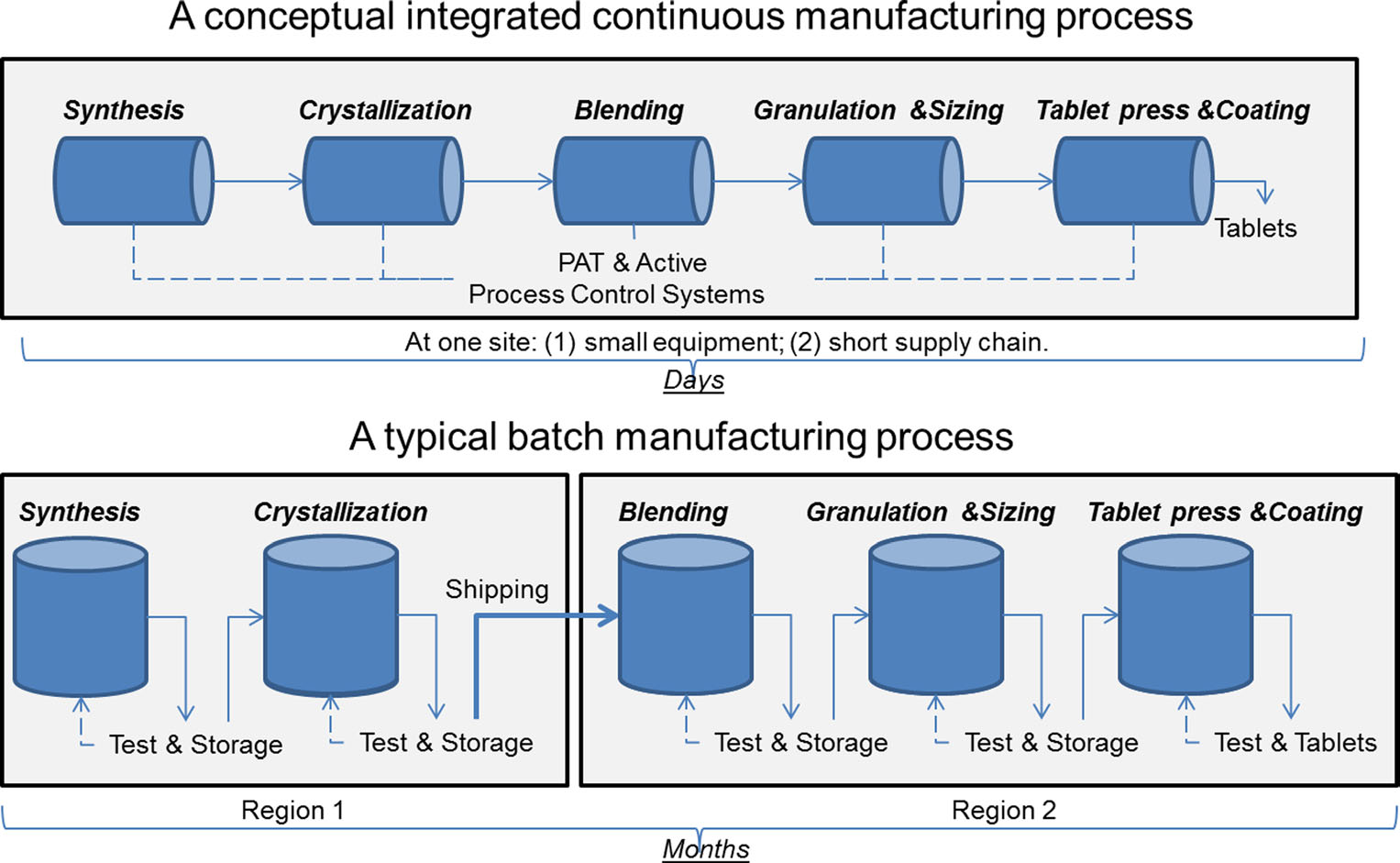 a comparison of continuous manufacturing and batch manufacturing. Obrázek se svolením Sau Lee. J. Pharm Innov (2015) 10: 191-199.
a comparison of continuous manufacturing and batch manufacturing. Obrázek se svolením Sau Lee. J. Pharm Innov (2015) 10: 191-199.Pro více než 50 let, léčiv byly vyrobeny pomocí metody známé jako „dávkové výroby,“ multi-step, zdlouhavý proces, který zahrnuje použití nemotorný, ve velkém měřítku zařízení. Nicméně, nedávné pokroky v technologii výroby vedly farmaceutický průmysl zvážit odklon od výrobní šarže na rychlejší, efektivnější proces známý jako kontinuální výroby. FDA je aktivní kroky k usnadnění farmaceutického průmyslu je zavádění vznikajících technologií, včetně kontinuální výroby, zlepšení kvality výrobků a řešení mnoha z příčin nedostatek léků a vzpomíná.
Batch vs. continuous manufacturing
Batch manufacturing zahrnuje více diskrétních kroků. Po každém kroku procesu se výroba obvykle zastaví, takže vzorky mohou být testovány offline na kvalitu. Někdy během těchto „hold times“ mezi kroky, materiál může být skladován v kontejnerech nebo odeslán do jiných zařízení po celém světě k dokončení výrobního procesu. To může přidat týdny nebo měsíce do doby zpracování. U některých účinných látek, které jsou citlivé na životní prostředí, může také představovat riziko degradace. Kromě toho, pokud poptávka po určitém léku vzroste, může zvýšená výroba vyžadovat větší vybavení. Toto rozšíření zařízení vyžaduje více fyzického prostoru, větší stopu a více času a peněz.
naproti tomu léčiva, která jsou vyráběna kontinuální výrobou, se přesouvají nonstop v rámci stejného zařízení, což eliminuje dobu držení mezi kroky. Materiál je přiváděn přes montážní linku plně integrovaných komponent. Tato metoda šetří čas, snižuje pravděpodobnost lidské chyby a může pružněji reagovat na změny trhu. Aby byla zohledněna vyšší poptávka, může nepřetržitá výroba běžet delší dobu, což může snížit pravděpodobnost nedostatku léků.
oba typy výroby podléhají stejným standardům kontroly kvality, ale monitorování je automatizované v nepřetržitých výrobních zařízeních a bývá častější než v dávkové výrobě. Stejně jako všechny technologie, kontinuální výrobní zařízení mohou zažít opotřebení, ale automatické sledování může odhalit problémy dlouho předtím, než dojde k selhání. Takové monitorování může také pomoci předpovědět délku života zařízení, což vede k lepší proaktivní údržbě.
konečně může kontinuální výroba umožnit flexibilnější sledování a sledování, což by bylo výhodou v případě selhání produktu. Například při dávkové výrobě je specifické množství (nebo šarže) léčiva definováno velikostí zařízení, které jej vyrobilo. V kontinuální výrobě může být množství (nebo šarže) vymezeno časovým razítkem, množstvím vyrobeného léčiva nebo množstvím surového vstupního materiálu. Tyto metody sledování umožňují výrobci izolovat menší množství vadného materiálu v případě selhání procesu, což vede k menšímu množství odpadu a menší šanci na nedostatek.
náročné, ale vyplatí přechod
Několik odvětví, jako jsou chemický a petrochemický průmysl—již prošly výrobním vývoj a použití efektivní kontinuální technologií, aby bezpečně vyrábět produkty. Ale pro farmaceutický průmysl je přechod na kontinuální výrobu stále v raných fázích z několika důvodů. Za prvé, počáteční náklady na takový přechod mohou být vysoké. Do důchodu staré šarže zařízení, nákup nových technologií a školení zaměstnanců, jak ji používat, a obnova infrastruktury odvětví je nákladné, vyžaduje seriózní závazek z drogového výrobce. Ekonomické analýzy přesto ukázaly potenciální významné dlouhodobé úspory. Kromě toho musí některé technologie ještě dozrát, než budou komerčně životaschopné. U některých typů léčiv, jako jsou biologické produkty, nemusí technologie jejich výroby kontinuální výrobou dosud existovat. Probíhá výzkum zaměřený na řešení těchto a dalších výzev. Výrobci léčiv navíc stále vnímají regulační nejistotu, která může zpozdit schválení produktu při použití nové výrobní technologie.
vzhledem k tomu, že průmysl zvažuje, jak provést přechod, FDA poskytuje zdroje a informace, které pomáhají usnadnit přechod. Agentura například spolupracuje s biomedicínským Úřadem pro pokročilý výzkum a vývoj, programem v rámci amerického ministerstva zdravotnictví a sociálních služeb, který pomáhá financovat a podporovat výzkum v této oblasti. Školíme také naše kontrolní pracovníky a provádíme interní výzkum rizikových oblastí spojených s nepřetržitou výrobou, abychom mohli lépe posoudit související technologie.
vedu multidisciplinární tým v rámci nově vznikajícího technologického programu v kanceláři Farmaceutické kvality CDER. Program byl zřízen za účelem pomoci průmyslu, zavádění inovačních technologií s cílem zlepšit kvalitu výrobků a modernizaci průmyslu, ve snaze řešit základní příčiny nedostatek léků nebo připomíná. Nově vznikající technologický Program se zaměřuje nejen na kontinuální výrobní technologie, ale také na další pokroky, jako je 3D tisk, nové dávkové formy a nové kontejnerové systémy. V rámci tohoto programu, spolupracujeme s průmyslem na počátku procesu vývoje nových technologií, a diskutovat o jakýchkoli očekávaných regulačních nebo vědeckých otázkách, které mohou být součástí budoucí aplikace.
Mnoho společností aplikuje na nově Vznikající Technologie Program, pokud jde o jejich zájem na kontinuální výrobu. FDA dokument s názvem, Rozvoj nových Technologických Aplikací na Modernizaci Farmaceutické Výrobní Základny Pokyny pro Průmysl poskytuje informace a poradenství o tom, jak pracovat s agenturou již v procesu vývoje.
Přečtěte si více o snahách FDA o modernizaci výroby léčiv v hlasovém blogu FDA.