biologiset öljyt eroavat molekyylirakenteeltaan ja ominaisuuksiltaan maaöljyistä (”tavallinen” dieselpolttoaine).

yleinen maaöljydiesel on yksinkertaisten hiilivetyjen sekoitusta, jonka keskimääräinen kemiallinen kaava on c12h23 (alla), mutta komponentit voivat vaihdella suunnilleen välillä c10h20 (dodekaani) ja c15h28(pentadekaani). Sen sijaan biologiset öljyt ovat” triglyseridejä ”(luokitellaan” estereiksi”) kuten alla esitetty glyseryylitrilinoleaatti:
| c12h23, dodekaani | a triglyseridi: glyseryylitrilinoleaatti |
niiden suuren koon ja siitä johtuvien suurten molekyylien välisten houkutusten vuoksi biologisten öljyjen viskositeetti on yleensä liian korkea käytettäväksi tavanomaisissa dieselmoottoreissa. Biologiset öljyt myös palavat hieman vähemmän helposti ja nokisemmalla liekillä kuin maaöljydiesel. Biologisia öljyjä voidaan käyttää perinteisissä dieselmoottoreissa, jos ne esilämmitetään viskositeetin vähentämiseksi, mutta tämä vaatii lisälämmittimen, kunnes moottori lämpenee. Näitä resoneja varten bilogiset öljyt vaativat jalostusta käytettäväksi biodieselinä.
biologinen öljy on esteri, joka on eräänlainen orgaaninen yhdiste, jolla on alla esitetty atomin sidos.
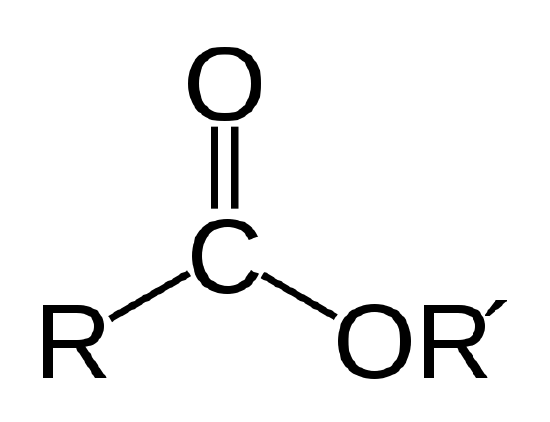 esteriyhteys. R ja R’ edustavat hiili-ja vetyatomien ketjuja. R = -CH3 ja R’ = -C18h35o2 Metyylistearaatille esimerkissä 1 |
glyseroli |
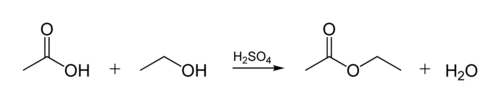
esterisidos biologisissa öljyissä syntyy, kun glyserolimolekyyli reagoi orgaanisten happojen kanssa. Glyserolimolekyylissä on 3 hiiliatomin ketju, jossa jokaisessa on an-OH (alkoholi) – ryhmä. Alla oleva kuva näyttää, miten orgaaninen alkoholi reagoi orgaanisen hapon kanssa. Orgaaniset kemistit lyhentävät molekyylirakenteita-kuvion” siksak ” -viivat edustavat hiiliketjuja, joiden jokaisessa ”siksakissa” tai ”siksakissa”on C-atomi. Jokaisessa hiilessä on 4 sidosta, ja jos niitä on vähemmän kuin 4, oletetaan niiden menevän H-atomeiksi. Alkoholina on siis C2H5OH (etanoli) ja happona etikkahappo (tai etaanihappo, CH3COOH) kuviossa:
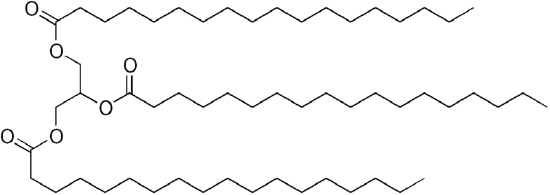
koska glyserolissa on 3-OH-ryhmiä, 3 pitkäketjuista orgaanista ”rasvahappoa” kiinnittyy muodostaen kookkaan ”triglyseridin”.
mutta yhtä helposti kuin alkoholeista ja hapoista voidaan valmistaa estereitä, ne voivat vaihtaa alkoholeja tai happoja. Vahvan Emäskatalyytin, kuten NaOH: n, läsnä ollessa triglyseridi voi reagoida 3 pienen alkoholimolekyylin, kuten metanolin (CH3OH), kanssa, jotka korvaavat glyserolin ”selkärangan”, jolloin muodostuu 3 erillistä esteriä, joiden molekyylipaino on pienempi
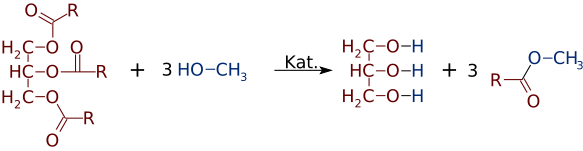
melko usein muodostuu kahden tai useamman tuotteen seos. Esimerkiksi kasviöljyn reagoidessa metanolin kanssa glyseriinistä voi siirtyä vain yksi tai kaksi hapoista, jolloin syntyy vain 1 tai 2 Famea.
C3H5(C18H35O2)3 + NaOH + 2 CH3OH → C3H5(C18H35O2)2(OH) + 2 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 1 CH3OH → C3H5(C18H35O2)(OH)2 + 1 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 3 CH3OH → C3H5(OH)3 + 3 C17h35cooch3
yleensä lisätään suuri ylimäärä metanolia ja natriumhydroksidia, jolloin reaktio tuottaa suurimman määrän Fame.
mutta transesteröinnin tapauksessa tuotteiden määriä ei enää lisätä, vaikka mikään reagoivista aineista ei kulukaan kokonaan. Sanomme, että tällainen reaktio ei mene loppuun asti. Kun valmisteseos syntyy tai reaktio ei mene loppuun, reaktion tehokkuutta arvioidaan yleensä halutun tuotteen prosenttimääräisenä saantona. Teoreettinen saanto lasketaan olettamalla, että kaikki rajoittava reagenssi muunnetaan tuotteeksi. Kokeellisesti määritettyä tuotteen massaa verrataan sitten teoreettiseen saantoon ja ilmaistaan prosentteina:

esimerkki 1 Kun 100,0 g c3h5(C18H35O2)3-kaasua ja 15,0 g CH3OH: ta sekoitetaan 55°C: ssa NaOH-katalyytin kanssa, ne reagoivat muodostaen 90,96 g c17h35cooch3-metyylistearaattibieseliä. Laske prosentuaalinen tuotto.
ratkaisu meidän on laskettava NH3: n teoreettinen saanto, ja tätä varten meidän on ensin selvitettävä, onko N2 vai H2 rajoittava reagenssi. Tasapainotetussa yhtälössä
c3h5(C18H35O2)3 + NaOH + 3 CH3OH → C3H5(OH)3 + 3 C17H35COOCH3 steariini + natriumhydroksidi + 3 CH3OH → glyseroli + 3 metyylistearaatti
reaktanttien stoikiometrinen suhde on
 nyt kahden reagenssin alkumäärät ovat ja
nyt kahden reagenssin alkumäärät ovat ja  alkumäärien suhde on siis
alkumäärien suhde on siis koska tämä suhde on pienempi kuin
koska tämä suhde on pienempi kuin  , on ch3oh: n ylitys. Steariini on rajoittava reagenssi. Näin ollen meidän on käytettävä 0,1122 mol steariinia ja 0,3366 mol CH3OH (eikä 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have
, on ch3oh: n ylitys. Steariini on rajoittava reagenssi. Näin ollen meidän on käytettävä 0,1122 mol steariinia ja 0,3366 mol CH3OH (eikä 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have so that
so that We can organize these calculations in a table:
We can organize these calculations in a table:
| C3H5(C18H35O2)3(s) | + 3 CH3OH (l) | → 1 C3H5(OH)3 (l) | + 3 C18H35O2)3CH3(s) | ||
|---|---|---|---|---|---|
| m, g | 100.0 g | 15.00 g | 90.96 g | ||
| M, g/mol | 891.5 | 32.04 | 298.5 | 92.1 | |
| n present, mol | 0.1122 mol | 0.4682 mol | |||
| n actual, mol | 0.1122 | 0.3366 | 0.1122 | 0.3366 | |
| m actual, mass | 100.0 | 10.78 | 10.33 | 100.47 |
The percent yield is then
Transesterification is a classic example of a reaction which does not go to completion.