on olemassa kokeellisia menetelmiä detection of unpaired electrons. Yksi aineissa olevien parittomien elektronien tunnusmerkeistä on vuorovaikutus magneettikentän kanssa. Tätä vuorovaikutusta voidaan käyttää tuottamaan tietoa yhdisteistä, jotka sisältävät parittomia elektroneja.
elektronin paramagneettinen resonanssi
elektronin paramagneettinen resonanssi (EPR) tai elektronin spin-resonanssi (ESR) on spektroskooppinen menetelmä. Se riippuu kahden spin-tilan energeettisestä erosta, joka on olemassa vain magneettikentän läsnä ollessa.
EPR on hyvin läheistä sukua toiselle yleiselle spin-resonanssispektroskopiatyypille, NMR: lle.
Spin on kvanttiominaisuus, jolla ei ole sellaista todellista analogiaa, joka olisi meille mielekästä makroskooppisella tasolla. Tiedämme kuitenkin, että spin liittyy siihen magneettisia ominaisuuksia. Elektronilla voi olla näille magneettisille ominaisuuksille jompikumpi kahdesta arvosta. Näille arvoille on annettu erilaisia merkintöjä: joskus ”ylös” ja ”alas”, joskus +1/2 ja -1/2. Elektronin spiniarvolla ei kuitenkaan ole energeettistä merkitystä.
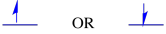
kaksi mahdollista spin-tilaa ovat energeettisesti samat — ellei magneettikenttää ole. Kun tämä tilanne syntyy, kaksi valtiota erotetaan tarmokkaasti toisistaan.
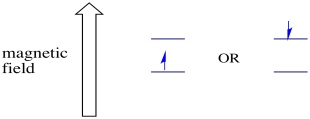
magneettikentän läsnä ollessa kaksi spin-tilaa erkanevat kahdeksi eri energiatasoksi. Energiatasojen välisen erotuksen määrä riippuu magneettikentän suuruudesta. Mitä voimakkaampi magneettikenttä, sitä suurempi ero.
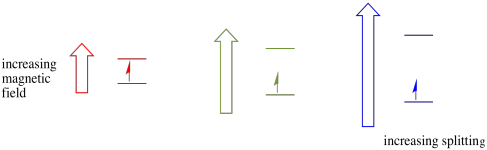
tämä tapaus pätee vain parittomille kierroksille. Muista, että parittomat pyörähdykset vuorovaikuttavat magneettikentän kanssa. Jos kaikki on spin-pari, mitään ei tapahdu. Se on hyödyllistä, koska voimme havaita elektronit.
toisessa spin-tilassa oleva elektroni voi vielä virittyä toiseen fotonin absorbanssilla. Vaihtoehtoisesti korkeammassa tilassa oleva elektroni voi pudota alemmas, jos se vapauttaa fotonin.
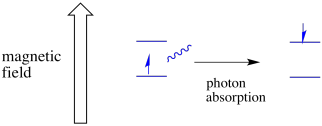
jotta mitään tästä tapahtuisi, fotonin energian on vastattava täsmälleen tilojen välistä energiaeroa. Tätä Kultakutrisääntöä kutsutaan resonanssiolosuhteeksi. Energiatasolta toiselle hyppäämiseen tarvittavan energiamäärän on oltava juuri oikea. Liian vähän energiaa, niin elektroni ei selviä. Liikaa energiaa, eikä elektroni selviä siitä. Se odottaa juuri oikeaa fotonia.
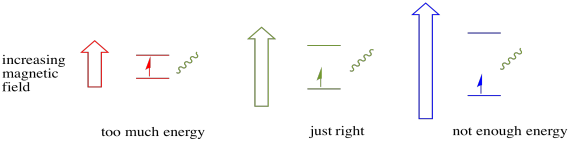
kuinka paljon energiaa fotonilla on? Muista Planckin ja Einsteinin suhde. Se kuvasi fotonin energiaa:
\(e=h \nu\)
E on fotonin energia, h on Planckin vakio (6,625 x 10-34 Js) ja ν on fotonin taajuus (se näyttää roomalaiselta ve: ltä, mutta se on kreikkalainen kirjain nu).
vaihtoehtoisesti aallonpituuden ja taajuuden välisen suhteen vuoksi:
\(E= \frac{hc}{\lambda}\)
uudet suureet ovat C, valonnopeus (3,0 x 108 m s-1) ja λ, fotonin aallonpituus.
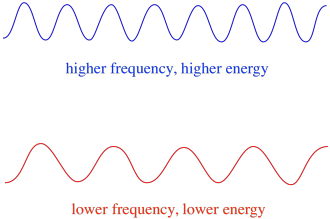
joten yleensä valon eri aallonpituudet tuottavat eri määriä energiaa. Sinisessä valossa, jonka aallonpituus on lähellä 475 nm, on enemmän energiaa kuin punaisessa valossa, jonka aallonpituus on lähellä 700 nm.
EPR: ssä sähkömagneettisen säteilyn yleinen vaihteluväli eli yleinen fotonilaji on mikroaaltosäteily. Näiden fotonien taajuus on noin 9 tai 10 GHz. (Toinen spektroskopian tyyppi, rotaatiospektroskopia, mittaa myös mikroaaltojen absorbanssia. Siinä käytetään tyypillisesti jonkin verran korkeampia mikroaaltotaajuuksia. Rotaatiospektroskopia antaa rakenne-tai sidostietoa kaasufaasin molekyyleistä.)
parittamattoman elektronin ympäristöstä riippuen se voi olla alttiimpi tai vähemmän altis ulkoisen magneettikentän vaikutukselle. Tämä tarkoittaa, että energian jakautuminen kahden spin-tilan välillä vaihtelee molekyylistä toiseen. Tämän seurauksena saman magneettikentän eri molekyylit absorboisivat mikroaaltosäteilyn eri aallonpituuksia.
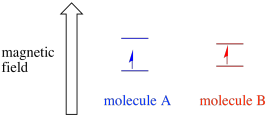
yleensä EPR-spektrometri on suunniteltu siten, että se toimittaa näytteeseen kiinteän aallonpituuden mikroaaltosäteilyä. Magneettikenttää säädetään ja laite mittaa, mikä kenttävoimakkuus tarvittiin fotonien absorptioon. EPR-spektri osoittaa absorbanssin magneettikentän voimakkuuden funktiona.
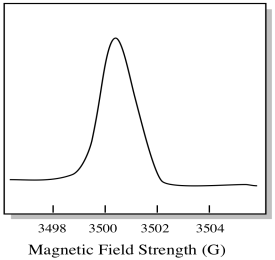
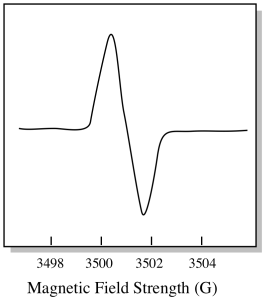
siinä, miten EPR-spektrit yleensä näytetään, on jotain hieman erilaista. Se näkyy johdannaisena yllä esitetystä tontista. Tämä johtuu siitä, että laite mittaa absorbanssin muutosta, kun se muuttaa magneettikenttää; eli se mittaa d(absorbanssi)/d(magneettikenttä). Se on edellisen tontin Rinne.
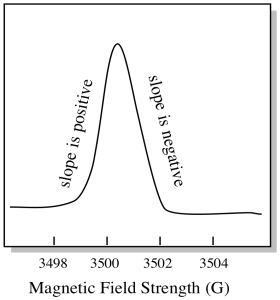
tämän seurauksena EPR-spektri todella näyttää tältä. Perustason yläpuolella oleva osa kuvastaa edellisen tontin positiivista kaltevuutta. Perustason alapuolella oleva osa kuvastaa edellisen havaintoalan negatiivista kaltevuutta.
magneettikentän voimakkuus ei ole tyypillisesti se arvo, joka piikkipaikalle ilmoitetaan. Sen sijaan ilmoitetaan jotain niin sanottua g-arvoa. G-arvo syntyy Zeemanin efektin yhtälöstä (magneettikentän vaikutuksesta spinienergiatasojen jakautumiseen). Tämä suhde on:
\(\Delta E = g \beta b\)
, jossa ΔE on spin-tilojen välinen energiaero, g on G-arvo, suhteellisuusvakio, joka riippuu siitä, kuinka herkkä elektroni on magneettikentän vaikutukselle, β on Bohr-magneton (9,274 x 10-24 J T-1) ja B on sovellettu magneettikenttä.
tämä tarkoittaa, että fotonin absorptiolle
\(h \nu = g \beta b\)
ja siten
\(g = \frac{ h \nu}{\beta b}\)
muista, että h ja β ovat vain vakioita. Tämä tarkoittaa, että g on mitta absorboituneen fotonin suhteesta käytettävään magneettikenttään. Se on standardointiaskel. Jos ihmisillä on mittalaitteita, jotka käyttävät hieman eri aallonpituuksia mikroaaltosäteilyä, niin heidän samoille näytteille mittaamansa magneettikentät eivät sopisi yhteen. Jos kaikki vain mittaavat aallonpituuden ja kentän voimakkuuden suhdetta, kaiken pitäisi tasaantua. G-arvo on toistettavissa oleva elektronin ympäristön mitta, jonka pitäisi olla sama laboratoriosta toiseen.
vastaavaa käytäntöä käytetään NMR-spektroskopiassa samoista syistä. Kun ilmoitamme kemiallisen muutoksen ppm: ssä Hz: n sijaan, korjaamme käyttämämme laitteen magneettikentän voimakkuuden. Muussa tapauksessa sama otos antaisi kaksi eri vaihdetta kahdelle eri instrumentille.
kytkentä EPR: ssä
kytkentä on ilmiö, jossa magneettikentät vuorovaikuttavat keskenään. EPR: ssä kytkentä syntyy, koska lähellä olevat ytimet vaikuttavat havaittavaan elektroniin.
esimerkiksi voi jo tietää, että vetyatomin ytimessä on pariton spin. Siihen perustuu 1H NMR-spektroskopia. Jos tumassa on pariton spin, siihen liittyy magneettikenttä. Koska vetyydin voi olla joko spin-arvo, +1/2 tai -1 / 2, niin siihen liittyy kaksi mahdollista magneettikenttää.
läheinen elektroni, joka on sijoitettu ulkoiseen magneettikenttään, voi nyt olla jommassakummassa kahdessa eri tilanteessa. Joko viereinen protoni lisää hieman magneettikenttää, tai se vähentää hieman ulkoista kenttää.
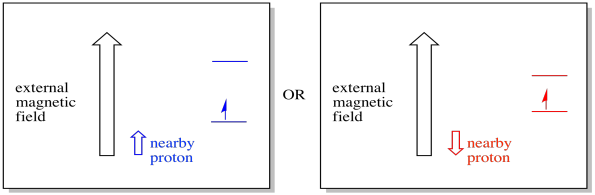
tämän seurauksena elektroni voi kokea kaksi eri kenttää. Muista, että spektroskopiassa ei ole kyse yksittäisestä molekyylistä. Kyseessä on valtava määrä molekyylejä. Osa molekyyleistä on samassa tilanteessa. Osa molekyyleistä on toisessa tilanteessa. Näemme molemmat tilanteet. Absorbanssi syntyy kahdella eri magneettikentän voimakkuudella.

tämän seurauksena EPR-spektrissä näkyy kaksi piikkiä, kuten tämä:
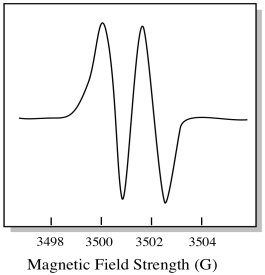
tällaista spektrissä esiintyvää huippua kutsutaan kaksoisabsorbanssiksi kaksinkertaisen absorbanssin vuoksi. Tätä EPR-piikin ominaisuutta kutsutaan sen moninaisuudeksi. Kuinka moneen linjaan huippu on jaettu? Kaksi. Se on tupla.
asiat ovat vielä mielenkiintoisempia, jos lähistöllä on kaksi protonia. Tällöin molemmilla viereisillä protoneilla on spin. Kummalla tahansa pyöräytyksellä voi olla arvo +1/2 tai -1/2. Ehkä molemmat ovat +1/2. Ehkä molemmat ovat -1 / 2. Ehkä niitä on yksi. Näillä kolmella mahdollisella yhdistelmällä on kolme erilaista vaikutusta elektronin kokemaan magneettikenttään.
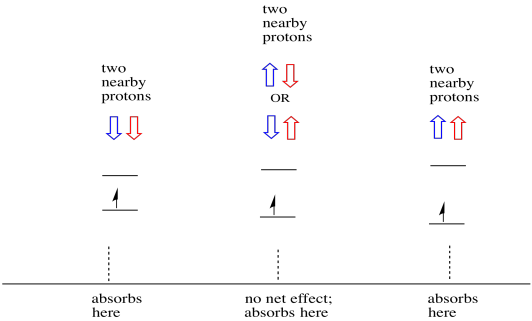
tämän seurauksena spektrissä on kolme huippua. Spektriä kutsutaan tripletiksi. Tämä tripletti on esitetty alla olevan kaavion alla, joka havainnollistaa viereisten vetyjen spin-yhdistelmiä.
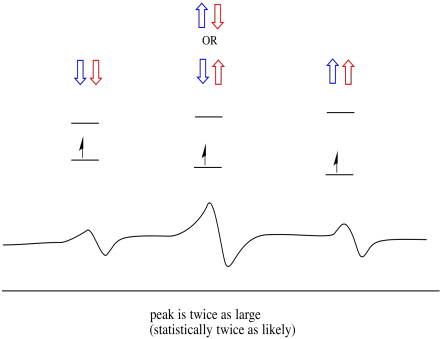
huomaa, että koska sekayhdistelmässä voi olla joko vetyä ylös tai alas, on kaksi tapaa päästä tähän keskitilaan. Tämä yhdistelmä on kaksi kertaa todennäköisempi kuin kaksi muuta, koska on vain yksi tapa saada nämä yhdistelmät: molemmat vedyn kierrokset ovat ylöspäin, yhdessä tapauksessa. Molemmat vedyt ovat alhaalla toisessa. Tämän seurauksena kolmikon keskimmäinen huippu on kaksi kertaa suurempi kuin reunojen piikit.
harjoitus \(\PageIndex{1}\)
osoittavat, että kolmen vierekkäisen vedyn kanssa tuloksena olisi kvartetti, jossa piikkien suhteet ovat 1:3:3:1.
vastaus
yhdistelmät ovat:
a) kaikki kierrokset alas (ja on vain yksi tapa tehdä se)
b) kaksi kierroksista ovat alhaalla, mutta yksi on ylhäällä (ja jokainen kolmesta protonista voi olla ylhäällä, joten on kolme tapaa tehdä se)
c) kaksi kierroksista ovat ylhäällä, mutta yksi on alhaalla (ja jokainen kolmesta protonista voi olla alhaalla, joten on kolme tapaa tehdä se)
d) kaikki kierrokset ylös (ja on vain yksi tapa että).
tuloksena on 1:3:3:1-kvartetti.
harjoitus \(\PageIndex{2}\)
ennusta EPR-spektrin moninaisuus jokaiselle seuraavista alkoksiradikaaleista (huomaa, että hapella ja hiilellä ei ole parittomia kierroksia; oletetaan sama pätee X: ään):
a) X3C-O. B) X2CH-O. C) XCH2-O. D) CH3-O.
vastaus A)
a) singlet
vastaus b)
b) doublet
Vastaus C)
C) tripletti
vastaus D)
D) kvartetti
harjoitus \(\pageindex{3}\)
oletetaan bentseenin pelkistyneen yhdellä elektronilla Bentseeniradikaalianionin saamiseksi. Mikä olisi EPR-spektrin moninaisuus?
vastaus
a septetti (in a 1:3:5:7:5:3:1 suhde).
kytkeminen Metalli-ioneihin
monilla muilla ytimillä kuin vedyllä on nettopinssi. Jos pariton elektroni sattuu löytymään metallilta, EPR-spektri voi antaa vahvistuksen tälle rakenteelliselle informaatiolle. Tämä vahvistus voi tulla sekä magneettikentän informaatiosta (samanlainen kuin kemiallinen muutos NMR: ssä) että moninaisuudesta.
valittujen metallien ydinpyöräytykset on esitetty alla.
| Metalli | Spin |
| V | 7/2 |
| Mn | 5/2 |
| Fe | |
| Co | 7/2 |
| cu | 3/2 |
jokaisella näistä metalleista ytimellä on erilaiset mahdolliset magneettikentät. Huomaa, että niiden vaikutukset ovat hieman monimutkaisempia kuin vetyatomin. Esimerkiksi kupari, jossa spin on 3/2, toimii hieman kolmen eri vetyytimen tavoin (kukin spin +/- 1/2), mitä tulee sen vaikutukseen lähellä olevan elektromin EPR-spektriin. Parittamattoman elektronin moninaisuuden kupari-ionissa pitäisi olla melko erottuva.
harjoitus \(\PageIndex{4}\)
ennusta EPR-spektrin huipun moninaisuus paraamattomalle elektronille jokaiselle seuraavista metalleista:
a) vanadiini b) mangaani c) rauta d) koboltti e) kupari
vastaus A)
A) oktetti (in a 1:3:5:7:7:5:3:1 suhde)
vastaus b)
b) sekstetti (in a 1: 3: 5: 5: 3:1 suhde)
Vastaus c)
C) singlet
vastaus d)
d) oktetti
vastaus e)
E) kvartetti (1:3:3:1-suhteessa)
joskus asiat ovat monimutkaisempia, koska saman alkuaineen eri isotoopeilla voi olla erilaiset mahdolliset spin-arvot. Itse asiassa tämä pitää paikkansa vedyn ja hiilen kanssa, mutta suurin osa vedystä esiintyy 1h: na, joten yleisesti voimme ajatella, että sillä on spin = 1/2; suurin osa hiilestä on 12C, spin = 0.
raudan luonnolliset isotoopit ja niiden ydinkierros on esitetty alla olevassa taulukossa.
| Isotope | Spin | % Abundance |
| 54Fe | 0 | 5.9 |
| 56Fe | 0 | 91.8 |
| 57Fe | 1/2 | 2.1 |
| 58Fe | 0 | 0.2 |
The EPR spectrum of an unpaired electron on iron may be slightly more complicated than we first thought. Näytteen sisällä osa elektroneista sijoittuisi rautaioneille, joiden spin on 1/2, vaikka suurin osa ei. Tämä komplikaatio voi olla tarpeeksi ottaa käyttöön hieman vaihtelua ulkonäkö spektrin, mutta kokonaisuutena se näyttäisi silti melko paljon kuin singlet.
monissa tapauksissa asiat kuitenkin monimutkaistuvat. Molybdeeni on hyvä esimerkki.
| isotooppi | Spin | % runsaus |
| 92Mo | 0 | 14,8 |
| 94mo | 0 | 9.3 | 95Mo | 15,9 |
| 96Mo | 16,7 | |
| 97mo | 5/2 | 98mo | 0 | 24, 1 |
| 100mo | 0 |
molybdeenin luonnossa esiintyviä isotooppeja on seitsemän. Viisi niistä on spin = 0, joten pariton elektroni noilla isotoopeilla synnyttäisi yksinkertaisen singletin EPR-spektrissä. Kaksi muuta isotooppia, jotka käsittävät 25% kokonaismäärästä, ovat spin = 5/2. Useimmat molybdeenin parittomat elektronit näkyisivät singlettinä. Merkittävä murto-osa näkyisi kuitenkin sekstettinä. Tämä tarkoittaa, että ihanteellisessa tapauksessa pariton elektroni molybdeenillä synnyttäisi singletin, jonka päälle olisi asetettu sekstetti (noin neljännes yhtä vahva kuin singlet).
tilanne saattaa näyttää hieman samalta kuin alla olevassa piirroksessa.
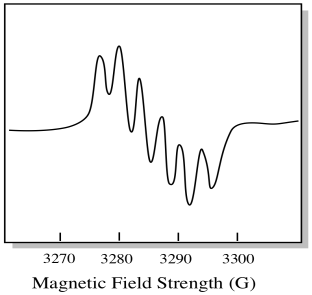
todellisuudessa EPR-spektrit ovat monissa tapauksissa valtavan monimutkaisia. Ne näyttävät usein pörröisiltä möykyiltä. On niin monia asioita, jotka liittyvät niin moniin muihin asioihin, että sitä on lähes mahdotonta tulkita silmillä. Useimmissa tapauksissa suoritetaan tietokonesimulaatioita ja kokeellista dataa verrataan tietokonesimulaatioihin rakenteellisen tiedon saamiseksi.
Exercise \(\PageIndex{5}\)
vanadiinia esiintyy joissakin nitrogenaaseissa, joten kiinnostusta mallikomplekseihin on ollut (esimerkiksi Sandro Gambarotta et al, J. Am. Kemiaa. Soc. 1994, 116, 6927-6928). Gambarotta käytti THF-liuottimessa seuraavaa synteesiä:
\(\ce{VCl3 + K -> 3v (THF)}\)
- piirtää reaktion tuotteen rakenteen.
- Piirrä tälle kompleksille d-orbitaalin halkaisukaavio.
- tälle yhdisteelle kirjattiin EPR-spektri. Sketch spektri, koska vanadiini on ydin spin i = 7/2.
- arvioi µeff tälle yhdisteelle.
yhdiste reagoi N2: n kanssa muodostaen N2-silloitetun dimeerin.
e) Piirrä tämän tuotteen rakenne.
f) tämä yhdiste ei tuota EPR-spektriä. Antaa resonanssi rakenne (e), joka selittää tämän havainnon.
vastaus
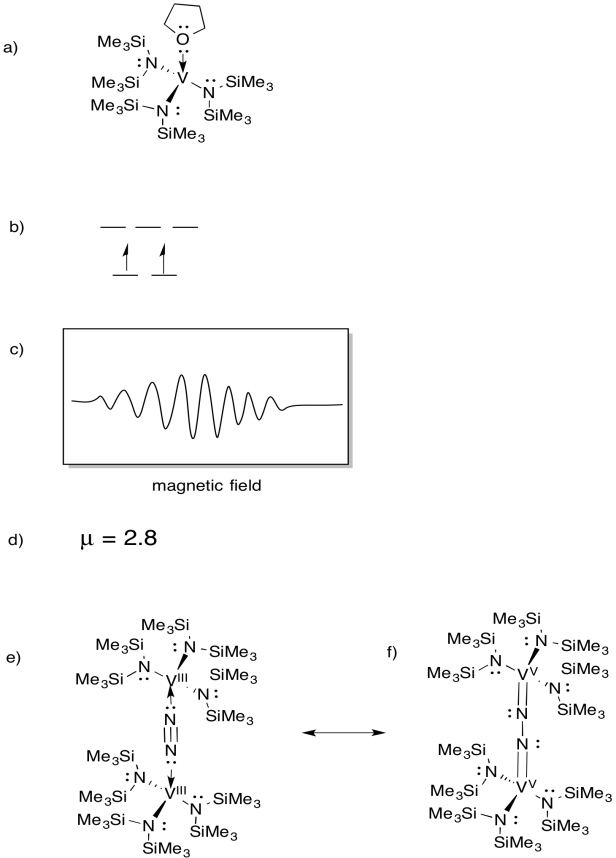
EPR spectra toimitti Virtual Imagination / Slapdash Chemistry Creationsin luvalla.
Attribution
Chris P Schaller, Ph. D., (College of Saint Benedict / Saint John ’ s University)