- Introduction
- materiaalit ja menetelmät
- kasvimateriaalit ja kasvukunto
- PSI-ja PSII-mittaukset
- Elektrochromic Shift Analysis
- Fotoinhibitoriset hoidot
- tilastollinen analyysi
- tulokset
- Keskustelu
- CEF-stimulaation merkitys hämärässä
- P700: n Hapetussuhteen muutos heikossa valossa ei liity PMF: ään
- ETRII ohjaa P700: n Hapetussuhdetta heikossa valossa
- johtopäätös
- Tekijäosuudet
- rahoitusta
- Eturistiriitalausunto
Introduction
vaikka valo on kantava voima fotosynteesi, korkea valo voi aiheuttaa merkittäviä foto-esto photosystem II (PSII) lehdille varjoa muodostavien kasvien (Kitao et al., 2000; Barth ym., 2001; Krause et al., 2004; Huang et al., 2015b, 2016b, c). Fotoinhibited PSII toipuu kuitenkin nopeasti hämärässä (hän ja Chow, 2003; Zhang and Scheller, 2004, Allakhverdijev et al., 2005), johtuen D1-proteiinin nopeasta vaihtuvuudesta (Aro et al., 1993; Zhang and Scheller, 2004; Allakhverdijev et al., 2005). PSII: n korjausnopeus pieneni, kun ATP: n synteesi estyi joko PSI: n tai PSII: n kautta (Allakhverdijev et al., 2005), mikä osoittaa, että fotodamagoitujen PSII-kompleksien nopea korjaus tarvitsee suuren määrän ATP: tä lyhyessä ajassa. Aiempi tutkimus osoitti, että jäähdyttämisen aiheuttaman fotoinhibition jälkeen psii: n syklinen elektronivirta (CEF) stimuloitui merkittävästi talteenoton aikana hämärässä (Huang et al., 2010). Ehdotettiin, että tämä CEF: n stimulaatio heikossa valossa paransi ATP: n synteesiä PSII: n nopeaan korjautumiseen (Huang et al., 2010). Tarvitaan kuitenkin lisää näyttöä, jotta voidaan selvittää CEF-stimulaation erityisrooli hämärässä PSII-valokuvanäyttelyn jälkeen.
CEF: n aikana joko NADPH: n tai ferredoksiinin elektronit kiertyvät psi: n ympäri plastokinonipooliin. Tämä elektroninsiirto kytkeytyy protonin translokaatioon ja tuottaa protonigradientin tylakoidikalvojen yli (ΔpH) (Shikanai ja Yamamoto, 2017). ATP-synteesin edistämisen lisäksi ΔpH: n toinen tehtävä on fotosynteettisen elektroninsiirron alasäätely happamoittamalla tylakoidilumenia (Shikanai, 2014, 2016). Tämä asetus sisältää kaksi eri mekanismia: yksi liittyy lämpöenergian hajoamiseen ja haihduttaa ylimääräisen absorboituneen valoenergian lämmöksi PSII-antenneista (Takahashi et al., 2009), ja toinen on alas-säätely Cyt b6 / f monimutkainen aktiivisuus ja ohjaa nopeutta elektroninsiirron psi (Suorsa et al., 2012, 2016; Tikkanen ja Aro, 2014). Angiospermeissä, mukaan lukien Arabidopsis thaliana, toimii kaksi psi-syklisen elektronikuljetuksen reittiä (Shikanai, 2007). Ensimmäinen CEF-reitti on PGR5- / PGRL1-riippuvainen reitti, joka on herkkä antimysiini A:lle (Munekage et al., 2002; Sugimoto et al., 2013), ja toinen on riippuvainen kloroplastista NADH-dehydrogenaasia muistuttavasta (NDH) kompleksista (Burrows et al., 1998; Shikanai et al., 1998). PGR5- / PGRL1-riippuvaisen reitin vaikutus on merkittävämpi C3-voimaloissa. Korkeassa valossa pgr5-/PGRL1-riippuvaisen CEF: n aktivoituminen indusoi tylakoidilumeenin happamoitumista ja johtaa siten korkeaan P700-hapetussuhteeseen (Suorsa ym., 2012, 2016; Kono et al., 2014; Yamori et al., 2016). Vertailun vuoksi P700: n hapetussuhteeseen heikossa valossa vaikutti vain vähän pgr5-/PGRL1-riippuvaisen CEF: n puute (Munekage et al., 2002, 2004; Kono et al., 2014). Kohtalaisessa PSII-fotoinhibitiossa CEF: n stimulointiin heikossa valossa liittyi P700: n hapettumisriskin kasvu (Huang et al., 2010). On kuitenkin epäselvää, johtuuko P700: n lisääntynyt hapetussuhde CEF-stimulaatiosta.
CEF: n lisäksi elektroninsiirto PSII: stä (ETRII) vaikuttaa merkittävästi psi: n redox-tilaan (Tikkanen et al., 2014; Huang et al., 2016a, c; Suorsa et al., 2016). A. thalianan pgr5-kasveissa psii: n vakava fotoinhibitio todennäköisesti toimii fotosynteettisen elektroninsiirron lopullisena kontrollina, jolloin P700: n optimaalisesti hapettunut ylimääräisessä valossa (Tikkanen et al., 2014). Äskettäin, Suorsa et al. (2016) osoitti, että pgr5-kasveilla oli korkea P700-hapetussuhde korkeassa valossa, kun ETRII: tä alennettiin yhdistämällä knockout-mutaatioita PsbO1: ssä, PsbP2: ssa, PsbQ1: ssä, PsbQ2: ssa ja PsbR loc: ssa. Jäähdytetyissä tupakan lehdissä kohtalainen PSII-fotoinhibitio vähensi elektronivirtausta PSI: ksi ja lisäsi sitten P700: n hapetussuhdetta jäähdytyksen jatkuessa (Huang et al., 2016a). Lisäksi psii: n hyytymisen aiheuttama fotoinhibitio johti etrii: n lamaantumiseen, johon liittyi P700: n hapetussuhteen nousu hämärässä (Huang et al., 2010). Oletamme, että P700: n hapetussuhdetta heikossa valossa ohjaa ensisijaisesti psii: n elektronivirtaus.
aiemmassa raportissamme huomasimme, että varjoa muodostava kasvi Panax notoginseng osoitti PSII: n valikoivaa fotoinhibitiota kovassa valorasituksessa. Lyhytkestoisen altistuksen korkean valon rasitukselle jälkeen etrii pieneni merkittävästi, mutta CEF stimuloitui merkittävästi. Samalla P700: n hapetussuhde suureni huomattavasti. Erityistavoitteemme oli (1) tutkia, helpottaako CEF-stimulaatio heikossa valossa lähinnä ATP: n synteesiä; ja (2) määritetään, liittyykö P700: n hapetussuhteen kasvu kohtalaiseen PSII-fotoinhibitioon enemmän ETRII: n kuin CEF-stimulaation tai PMF: n muutoksen yhteydessä. Näiden kysymysten ratkaisemiseksi Panax notoginsengin ehjiä lehtiä käsiteltiin 2258 µmol fotonilla m-2 s-1 30 minuutin ajan. Ennen suurvalokäsittelyä ja sen jälkeen määritettiin energian jakautuminen PSII: ssä, psi: n redox-tila ja protonimoottorin voima (PMF) 54 µmol: n fotonien m-2 s-1 heikossa valossa.
materiaalit ja menetelmät
kasvimateriaalit ja kasvukunto
tässä tutkimuksessa kokeisiin käytettiin 2-vuotiaita varjoa muodostavan kasvin Panax notoginseng (Burkill) F. H. Chen ex C. Chow ja W. G. Huang kasveja. Nämä kasvit kasvatettiin 10% auringonvalon valossa (suurin keskipäivän valon voimakkuus oli noin 200 µmol fotonia m-2 s-1). Näille kasveille ei koettu vesi-ja ravintorasitusta. Yhteyttävissä mittauksissa käytettiin 9 viikon ikäisiä täysin laajentuneita lehtiä.
PSI-ja PSII-mittaukset
Photosystem I-ja PSII-parametrit mitattiin 25°C: n lämpötilassa ja kirjattiin samanaikaisesti kahdella Pam-100-mittausjärjestelmällä (Heinz Walz GmbH, Effeltrich, Saksa). Klorofyllin fluoresenssiparametrit laskettiin seuraavasti: Fv/Fm = (Fm – Fo)/Fm, Y(II) = (Fm’ – Fs)/Fm ” (Genty et al., 1989), NPQ = (Fm – Fm’)/Fm’. Fo ja Fm ovat pienin ja suurin fluoresenssi pimeän totuttamisen jälkeen. Fs on valoon sopeutuva vakaan tilan fluoresenssi. Fo ja Fm määritettiin pimeään totuttelun jälkeen 30 minuutin ajan ennen ja jälkeen suurvalokäsittelyn. Psi-fotosynteettiset parametrit mitattiin P700-signaaliin perustuvalla kaksois-Pam-100: lla (830 ja 875 nm: n pulssimoduloidun mittausvalon voimakkuuksien ero valodetektoriin) (Klughammer ja Schreiber, 2008). P700 + signaalit (P) voivat vaihdella minimaalisen (P700 täysin alennettu) ja maksimitason (P700 täysin hapetettu) välillä. Enimmäispitoisuus (Pm) määritettiin saturaatiopulssilla (600 ms ja 10000 µmol fotonia m-2 s-1) kaukopunaisella valolla annetun esivalaistuksen jälkeen, ja Pm: ää käytettiin PSI-aktiivisuuden arvioimiseen. Pm ’ määritettiin samalla tavalla kuin Pm, mutta aktiinisella valolla kaukopunaisen valon sijaan. Psi: n kvanttituotoksi laskettiin y (I) = (Pm’- P)/Pm. P700 hapetussuhde tietyssä aktiinisessa valossa laskettiin y (ND) = P/Pm. Psi: n ei-fotokemiallisen energian häviämisen kvanttituotto, joka johtuu hyväksymispuolen rajoituksesta, laskettiin y (NA) = (Pm – Pm’)/Pm. Vakaan tilan arvot y (II), NPQ, Y(I) ja Y(ND) mitattiin valon totuttelun jälkeen hämärässä 20 minuutin ajan.
fotosynteettinen elektronivirta PSI: n ja PSII: n läpi laskettiin seuraavasti: ETRII = Y (II) ×PPFD ×0,84 ×0,5 (Krall ja Edwards, 1992), ETRI = Y (I) ×PPFD×0,84 ×0,5 (Yamori et al., 2011), jossa 0,5 oletetaan olevan psi: n tai PSII: n saavuttaman absorboituneen valon osuus ja 0,84 oletetaan absorptioksi (lehtien absorboiman valon osuus). CEF-aktivaation laajuus arvioitiin etri / ETRII-suhteena (Yamori et al., 2011, 2015). On huomattava, että psi: n ja PSII: n välinen 1: 1-eksitaatio ei välttämättä ole todellinen, koska varjokasveilla on taipumus lisätä PSII/PSI-suhdetta (Lunde et al., 2003; Tikkanen ym., 2006; Grieco et al., 2012). Lisäksi tässä tutkimuksessa PSI-ja PSII-parametrejä mitattiin Dual-Pam 100: n (Walz, Saksa) tuottamalla punaisella aktiinisella valolla (635 nm). Koska punainen aktiininen valo suosii psii: n eksitaatiota psi: n sijaan, eksitaatioenergian jakaantumiseen lhcii: stä PSII: hen ja PSI: hen saattaa vaikuttaa punainen aktiininen valo (Tikkanen ym., 2017).
Elektrochromic Shift Analysis
ECS-signaalia seurattiin absorbanssimuutoksena 515 nm: ssä käyttämällä Dual-PAM-100-laitetta (Walz, Effeltrich, Saksa), joka oli varustettu P515 / 535 emitter-detector modulella (Walz). ECS-signaali saatiin 20 minuutin valaistuksen jälkeen 54 µmol fotoneilla m-2 s-1, sen jälkeen ECS-hajoaminen mitattiin sammuttamalla aktiininen valo 30 sekunnin ajaksi. ECS dark intervallin relaksaatiokinetiikan (DIRKECS) analyysi tehtiin sacksteder et al-menetelmällä. (2001)ja Takizawa et al. (2008). PMF: n kokonaisamplitudi arvioitiin ECS-signaalin nopean hajoamisen kokonaisamplitudista 300 ms: n pimeän intervallin aikana. ECS-signaalin hidas relaksaatio mahdollisti protonigradientin vaikutuksen tylakoidikalvoissa (ΔpH). Ensimmäisen kertaluvun ECS-relaksaation (tECS) aikavakio on kääntäen verrannollinen tylakoidikalvon protonin johtavuuteen (gH+) ATP-syntaasin (Sacksteder ja Kramer, 2000; Cruz et al., 2005). Tämän seurauksena GH+ arvioitiin hajoamisaikavakion käänteiseksi .
Fotoinhibitoriset hoidot
pimeässä totuttelun jälkeen 30 min, FV / Fm ja Pm mitattiin ehjistä lehdistä. Tämän jälkeen nämä ehjät lehdet valotettiin 59 µmol fotoneilla m-2 s-1 20 minuutin ajan ja kirjattiin klorofyllifluoresenssin, P700-signaalin ja ECS-signaalin parametrit. Sitten aktiininen valo muutettiin 2258 µmol fotoniksi m-2 s-1. Kun tätä suurta valoa oli käytetty 30 minuutin ajan, aktiininen valo vaihdettiin välittömästi 59 µmol fotoniksi m-2 s-1 ja fotosynteettiset parametrit kirjattiin valon totuttautumisen jälkeen 20 minuutin ajan. Lopuksi Fv/Fm ja Pm mitattiin pimeän totuttelun jälkeen 30 minuutin ajan.
tilastollinen analyysi
tulokset esitettiin viiden riippumattoman kokeen keskiarvoina. Riippumatonta t-testiä käytettiin α = 0, 05 merkitsevyystasolla sen määrittämiseksi, oliko eri käsittelyjen välillä merkittäviä eroja. Kaikki tilastolliset analyysit tehtiin SPSS 16.0: lla.
tulokset
fotosynteettisen induktion aikana 59 µmol: n fotoneilla m-2 s-1 etrii kasvoi vähitellen ja saavutti vakaan tilan noin 18 minuutin kuluttua (kuva 1a). Vertailun vuoksi etri oli vakio induktiovaiheessa (Kuva 1a). Tämän heikon valon alettua ETRI oli paljon etrii korkeampi. 20 minuuttia kestäneen fotosynteettisen induktion jälkeen ETRI oli kuitenkin pienempi kuin ETRII. Nämä tulokset viittasivat CEF: n aktivoitumiseen induktion alkuvaiheessa aiempien tutkimusten (Joliot and Joliot, 2002, 2005; Makino et al., 2002). Tämän fotosynteettisen induktion jälkeen heikossa valossa lehtiä valaistiin suurella 2258 µmol fotonin m-2 s-1 valolla 30 minuutin ajan. Mielenkiintoista on, että etrii väheni vähitellen suurvalohoidon aikana (Kuva 1B). Samaan aikaan ETRIN arvo oli suurempi kuin ETRIIN (Kuva 1B), mikä viittaa CEF: n aktivoitumiseen korkeassa valossa. Tämän suurvalokäsittelyn jälkeen suurin valokuvalla hapettuva P700 (Pm) säilyi vakaana (Kuva 2a). Vertailun vuoksi fluoresenssin enimmäisintensiteetti (Fm) laski 40% ja PSII: n (Fv/Fm) maksimikvanttisaanto laski 0,80: stä 0,65: een (kuvat 2b,C). Nämä tulokset viittasivat PSII: n selektiiviseen foto-estoon Panax notoginsengin lehdissä kovassa valorasituksessa.
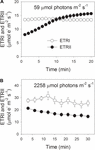
kuva 1. Fotosynteettinen elektronivirtaus heikossa valossa (A) ja korkeassa valossa (B). (A) tummiin sopeutuneet lehdet altistettiin 20 minuutin ajan 59 µmol fotonin m-2 s-1 heikolle valolle. B) kun 59 µmol fotonia m-2 s-1 oli 20 minuutin ajan sytyttänyt elektroninielun fotosynteesissä, lehdet altistettiin suurelle valolle, joka oli 2258 µmol fotonia m-2 s-1, 30 minuutin ajan. Arvot ovat keskiarvoja ± se (n = 5).
ennen suurvalokäsittelyä kypsiä lehtiä valaistiin 20 minuutin ajan fotosynteesin aktivoimiseksi, minkä jälkeen kirjattiin arvot ETRI, ETRII, Y(ND) ja NPQ. 30 minuutin suurvalokäsittelyn jälkeen ETRI -, ETRII -, Y(ND) – ja NPQ-arvot kirjattiin uuden 20 minuutin sopeutumisvaiheen jälkeen heikkoon valoon. Ennen korkean valon käsittelyä etri-ja ETRII-arvot 59 µmol fotoneille m-2 s-1 olivat vastaavasti 13,4 ja 15,7 µmol elektroneille m-2 s-1 (kuvat 3A, B). Suurvalokäsittelyn jälkeen etri oli 12,8 ja etrii heikossa valossa 11,2 µmol elektronia m-2 s-1 (kuvat 3a, B). ETRII: n arvo 59 µmol fotonilla m-2 s-1 laski noin 30% fotohibitorisen hoidon jälkeen, mikä viittaa etrii: n depressioon kohtalaisessa PSII photoinhibition-hoidossa. Ennen suurvalokäsittelyä ETRI/ETRII-suhteen arvo 59 µmol fotoneilla m-2 s-1 oli 0,85 (Kuva 3C). Fotoinhibitorisen hoidon jälkeen ETRI / ETRII-suhde suureni merkitsevästi arvoon 1, 14 (Kuva 3c). Nämä tulokset viittasivat CEF: n stimulointiin heikossa valossa PSII photoinhibition (Yamori et al., 2011, 2015).
suurvalokäsittelyn jälkeen y(I): n vakaan tilan arvo 59 µmol: n fotoneilla m-2 s-1 ei muuttunut (kuva 4A). Mielenkiintoista on, että Y (NA) laski merkittävästi 0,36: sta 0,23: een(Kuva 4B) ja Y (ND) kasvoi merkittävästi 0,1: stä 0,25: een (Kuva 4C). Nämä tulokset viittasivat PSI: n redox-tilan muutokseen hämärässä fotoinhibitorisen hoidon jälkeen. Samaan aikaan NPQ: n arvo muuttui hieman (Kuva 4D). Tämän seurauksena maltillisella PSII-fotoinhibitiolla oli erilaisia vaikutuksia P700: n hapetussuhteeseen ja NPQ: hon hämärässä.
sen selventämiseksi, johtuuko Y: n(ND) nousu pmf: n lisääntymisestä, määritettiin elektrokromiset siirtymäsignaalit 54 µmol: n fotoneilla m-2 s-1 20 minuutin valon totuttelun jälkeen ennen ja jälkeen suurvalokäsittelyn. Mielenkiintoista on, että PMF: n kokonaismäärä väheni merkittävästi 18% suurvalohoidon jälkeen (kuva 5A), mutta ΔpH-taso muuttui merkityksettömästi (Kuva 5B). Koska tylakoidin protonin johtavuus voi vaikuttaa PMF: n muodostumiseen, tylakoidin kalvon protonin johtavuus (gH+) tutkittiin myös ennen ja jälkeen suurvalokäsittelyn. Tulos osoitti, että GH+ ei muuttunut suurvalohoidolla (Kuva 5C), mikä viittaa siihen, että suurvalohoito ei juurikaan vaikuttanut kloroplastin ATP-syntaasin aktiivisuuteen hämärässä. Koska ETRIIN 30%: n laskuun liittyi 18%: n lasku pmf: ssä, CEF: n stimulointi hämärässä kompensoi osittain pmf: n ja ΔpH: n muodostumista.

kuva 5. Protonin kokonaisvoiman (PMF) (a), tylakoidikalvojen (B) protonigradientin (ΔpH) ja tylakoidikalvon (C) protonin johtavuuden (gH+) arvot hämärässä. Kaikki parametrit mitattiin sopeutumisen jälkeen 54 µmol fotoneilla m-2 s-1 20 minuutin ajan. Arvot ovat keskiarvoja ± se (n = 5). Asteriski osoittaa merkittävää (p < 0, 05) muutosta suurvalokäsittelyn jälkeen.
Keskustelu
CEF-stimulaation merkitys hämärässä
on osoitettu, että CEF: llä on tärkeä rooli fotosynteesin ja kasvien kasvun ylläpitämisessä (Yamori and Shikanai, 2016). Korkeassa valossa, CEF on nyt uskotaan olevan välttämätöntä tasapainottamiseksi ATP / NADPH energian budjetti sekä suojella PSI ja PSII vahingoilta (Munekage et al., 2002, 2004; Takahashi et al., 2009; Suorsa ym., 2012, 2016; Walker et al., 2014; Huang et al., 2015a, 2017b). Alhaisella valoteholla CEF: llä on tärkeä rooli fotosynteettisen CO2-assimilaation optimoinnissa luultavasti ylimääräisen ATP: n tarjonnan kautta (Yamori et al., 2011, 2015; Nishikawa et al., 2012; Huang et al., 2015a). CEF: n päärooli moduloidaan joustavasti valon voimakkuuden mukaan. Erityisesti Verkkojen Eurooppa-välineellä pyritään pääasiassa tasapainottamaan ATP / NADPH-energiabudjettia alikyllästävän valon intensiteeteillä, mutta suojataan fotosynteettisiä laitteita fotoinhibitiolta, kun ne altistetaan kyllästyvälle valonvoimakkuudelle tylakoidilumenin happamoitumisen kautta (Huang et al., 2015a). Mielenkiintoista, Huang et al. (2010) havaitsi, että CEF stimuloitiin merkittävästi hämärässä psii: n jäähdyttämisen indusoiman fotoinhibition jälkeen ja hypoteesi, että tämä CEF-stimulaatio paransi pääasiassa ATP: n synteesiä psii: n nopeaan korjaamiseen. Hypoteesin tueksi tarvittiin kuitenkin lisää todisteita. Tässä tutkimuksessa havaitsimme, että etri/ETRII-arvo heikossa valossa kasvoi merkittävästi (Kuva 3C), mikä viittaa CEF: n stimulaatioon PSI: n ympärillä (Huang et al., 2011, 2012,2017a, b; Yamori et al., 2011, 2015). Samanaikaisesti pmf: n Amplitudi laski merkittävästi ja ΔpH laski hieman. Nämä tulokset osoittivat, että CEF-stimulaatio ei laukaissut fotosynteettisen elektroninsiirron ΔpH-riippuvaista alasäätelyä. Toisin sanoen tämä CEF: n stimulointi hämärässä helpotti lähinnä ATP: n synteesiä.
vaikka korkean valon käsittely ei vaikuttanut kloroplastin ATP-syntaasin protoninjohtavuuteen, PMF: n pienempi koko johti ATP: n synteesin todellisen nopeuden vähenemiseen. Psii: n korjaantumisnopeutta ja fotosynteettistä CO2-assimilaatiota heikossa valossa rajoittaa lähinnä ATP: n synteesin nopeus (Allakhverdiev et al., 2005; Yamori et al., 2011, 2015; Nishikawa et al., 2012). Koska ETRII väheni merkittävästi PSII-fotoinhibition yhteydessä, ATP: n synteesinopeus etrii: n kautta väheni huomattavasti. Jotta primaarimetabolian vaatima ATP/NADPH-suhde ja PSII: n nopea korjaantuminen saadaan tasapainoon, tarvitaan joustava mekanismi, jolla saadaan ylimääräistä ATP: tä. Tässä tilanteessa etrii laski 30 prosenttia, mutta pmf: n kokonaismäärä laski vain 18 prosenttia. Nämä tulokset osoittavat, että CEF: n stimulointi kompensoi ETRII-riippuvaisen PMF: n muodostumisen vähenemistä, mikä paransi ATP: n synteesiä. Fotodamagoituneen PSII: n nopea korjaantuminen riippuu ATP: n synteesistä (Allakhverdijev et al., 2005). CEF: n kiihtyminen PSI: n ympärillä lisäsi ATP: n solunsisäistä pitoisuutta, mikä nopeutti psii: n korjaantumisnopeutta Synechocystisissä (Allakhverdiev et al., 2005). Yhdessä ehdotamme, että CEF: n stimuloinnilla hämärässä on tärkeä rooli PSII: n aktiivisuuden nopeassa korjaamisessa ylimääräisellä ATP-synteesillä.
P700: n Hapetussuhteen muutos heikossa valossa ei liity PMF: ään
mielenkiintoinen ilmiö on se, että P700: n hapetussuhde heikossa valossa kasvoi merkittävästi kohtalaisessa PSII-fotoinhibitiossa (Huang et al., 2010), mikä näkyy myös tässä tutkimuksessa. Olosuhteissa, joissa absorboitunut valo ylittää fotosynteesin vaatimukset, CEF-riippuvainen ΔpH: n tuottaminen-säätelee Cyt b6/f-kompleksin aktiivisuutta ja ohjaa elektronivirtausta PSII: stä PSI: hen (Suorsa et al., 2012, 2016; Shikanai, 2014, 2016) optimoimalla P700: n redox-tilan PSI: ssä ja minimoimalla ROS-tuotannon PSI: ssä fotosynteesin aikana. A. thalianan pgr5-kasveissa P700 pelkistyy valon elektroneilla pmf-generaation häviämisen vuoksi. Pgr5-mutanttiin kertyvässä flavodironiproteiinissa pmf: n taso kuitenkin palautui myös villityypin tasolle, ja näin P700 hapettui villityypin tapaan (Yamamoto et al., 2016). Klorofylli B: n puutteellisissa vehnämutanttilinjoissa riittämätön tylakoidiprotonigradientti johtaa psi: n hyväksymispuolen liialliseen vähenemiseen ja siten PSI: n fotoinhibitioon korkeassa valossa tai korkeassa lämpötilassa (Brestic et al., 2015, 2016). Viime aikoina jotkut tutkimukset kertoivat, että kloroplastisen ATP-syntaasin lisääntynyt aktiivisuus heikensi PMF: n muodostumista ja aiheutti fotosynteettisen elektroninsiirtoketjun liiallisen pelkistymisen, mikä johti psi: n fotodamageen korkeassa valossa ja vaihtelevassa valossa (Kanazawa et al., 2017; Takagi et al., 2017). Nämä raportit tukevat PMF: n kriittistä roolia P700: n ylläpitämisessä optimaalisesti hapettuneena ylimääräisessä valoenergiassa.
nykyiset tuloksemme osoittivat, että 30 minuutin suurvalokäsittelyn jälkeen näin hämärässä muodostunut pmf: n kokonaismäärä väheni merkittävästi ja ΔpH: n muodostuminen muuttui hieman (kuvat 5A,B). Samaan aikaan P700: n hapetussuhde kasvoi merkittävästi 0,1: stä (ennen käsittelyä) 0,25: een (käsittelyn jälkeen) (kuva 4C). Nämä tulokset viittaavat vahvasti siihen, että P700: n hapettumissuhteen kasvua ei voida selittää pmf: n muutoksella, joka eroaa suuresti Y: n(ND) ja PMF: n korrelaatiosta korkeassa valossa (Yamamoto et al., 2016; Takagi et al., 2017). Siksi PMF: n säätelevä vaikutus P700: n hapetussuhteeseen on vähäinen hämärässä, mutta erityisen tärkeä se on suuressa valossa tai vaihtelevassa valossa. Korkeassa valossa, korkea arvo Y (ND) liittyy yleensä korkea arvo NPQ (Munekage et al., 2002, 2004; Kono et al., 2014; Zivcak et al., 2015) pmf: n kasvun vuoksi. ΔpH: n muodostumisen heikkeneminen johtaa Y: n(ND) ja NPQ: n pienenemiseen korkeassa valossa (Suorsa et al., 2012; Kono et al., 2014; Yamamoto et al., 2016; Kanazawa et al., 2017). NPQ: n induktio hämärässä määräytyy pääasiassa lumenin happamuustason mukaan. Valohoidon jälkeen lumen happamoitumisen määrä ei muuttunut (kuva 5B), ja NPQ pysyi vakaana (Kuva 4D). Vertailun vuoksi Y (ND) kasvoi merkittävästi. Tulokset osoittavat, että hämärässä Y: tä(ND) ja NPQ: ta ohjattiin erilaisilla sääntelymekanismeilla.
ETRII ohjaa P700: n Hapetussuhdetta heikossa valossa
PSI alenee yli vain silloin, kun psii: stä tuleva elektronivirta ylittää psi: n elektronitunnistimien kyvyn selviytyä elektroneista. Kun elektronin virtaus PSI:hen on rajoitettu, PSI kestää erittäin hyvin A. thalianan pgr5-kasveissa (Suorsa et al., 2012, 2016; Tikkanen ym., 2014). Varjoa muodostavassa kasvissa Psychotria rubra psi-aktiivisuus ei ollut hyväksyttävää korkean valon rasitukselle dcmu: n läsnä ollessa (Huang et al., 2016c). Jäähdytetyissä tupakan lehdissä kohtalainen PSII photoinhibition mahdollisti P700: n ylläpitämisen optimaalisesti hapettuneena ja suojasi sitten PSI: n toimintaa fotodamagelta (Huang et al., 2016a). Nämä tulokset osoittivat, että ETRII: lla on tärkeä rooli PSI: n redox-tilan säätelyssä suurissa valo-tai jäähdytysvalojännityksissä. Nykyiset tuloksemme osoittivat, että keskivaikea PSII-valokuvanäyttely johti etriin merkittävään lamaantumiseen hämärässä. Samaan aikaan psi-aktiivisuus ja kloroplastin ATP-syntaasin aktiivisuus muuttuivat hieman, eivätkä PMF ja ΔpH yhteensä lisääntyneet. Tämän seurauksena Etriin väheneminen ei johtunut ΔpH-riippuvaisesta fotosynteettisestä kontrollista Cyt b6/f-kompleksin kautta, vaan se johtui todennäköisesti PSII-aktiivisuuden vähenemisestä (Tikkanen ym., 2014). Elektronien vähenevä saanti PSII: stä PSI: hen johti P700: n lisääntyneeseen hapettumiseen. Näin ollen P700: n hapetussuhdetta heikossa valossa hallittiin pitkälti ETRIIN avulla.
johtopäätös
havaitsimme, että psii: n selektiivinen fotoinhibitio aiheutti CEF: n stimulaation ja P700: n hapetussuhteen nousun hämärässä. CEF-stimulaatio ei laukaissut fotosynteettisen elektroninsiirron ΔpH-riippuvaista alasäätelyä. Tämän seurauksena tämä CEF: n stimulointi heikossa valossa helpotti pääasiassa ATP: n synteesiä, mikä on välttämätöntä fotodamagoidun PSII: n nopealle korjaamiselle. P700: n hapetussuhteen kasvua ei voitu selittää ΔpH-riippuvaisen fotosynteettisen kontrollin muutoksella Cyt b6/f-kompleksissa, vaan se johtui pääasiassa elektronien vähenemisestä PSII: stä PSI: hen.
Tekijäosuudet
WH, S-BZ ja TL suunnittelivat ja suunnittelivat tutkimuksen. Wh ja Y-JY suorittivat kokeet. Wh, Y-JY, S-BZ ja TL analysoivat tiedot. Wh kirjoitti käsikirjoituksen ensimmäisen luonnoksen, jota kaikki kirjoittajat editoivat intensiivisesti.
rahoitusta
tutkimusta ovat tukeneet Kiinan kansallinen Luonnontieteellinen säätiö (31670343), Kiinan tiedeakatemian nuorten innovaatioiden edistämisyhdistys (2016347) sekä Yunnanin maakunnan suuret Tiede-ja Tekniikkaohjelmat (2016zf001).
Eturistiriitalausunto
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, joita voitaisiin pitää mahdollisena eturistiriitana.
Kono, M., Noguchi, K., and Terashima, I. (2014). Syklisen elektronivirran roolit PSI: n (CEF-PSI) ympärillä ja O2-riippuvaiset vaihtoehtoiset reitit fotosynteettisen elektronivirran säätelyssä lyhytaikaisessa vaihtuvassa valossa Arabidopsis thalianassa. Kasvisolufysioli. 55, 990–1004. doi: 10.1093/pcp/pcu033
PubMed Abstract | CrossRef Full Text/Google Scholar
Shikanai, T. (2016). Regulatory network of proton motive force: contribution of cyclic electron transport around photosystem I. Photosynth. Res. 129, 253-260. doi: 10.1007 / s11120-016-0227-0
PubMed Abstract | CrossRef Full Text/Google Scholar
Yamori, W., Makino, A., and Shikanai, T. (2016). Syklisen elektroninsiirron fysiologinen tehtävä fotosynteesin ylläpitämisessä riisin vaihtelevassa valossa. Sci. Rep. 6: 20147. doi: 10.1038/srep20147
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamori, W., and Shikanai, T. (2016). Syklisen elektroninsiirron fysiologiset toiminnot fotosynteesin ja kasvien kasvun ylläpitämisessä fotosynteesin ja fotosynteesin ympärillä. Annu. Rev. Plant Biol. 67, 81–106. doi: 10.1146/annurev-arplant-043015-112002
PubMed Abstract | CrossRef Full Text | Google Scholar
Yamori, W., Shikanai, T., and Makino, A. (2015). Fotosystem I syklinen elektronivirtaus kloroplastilla NADH-dehydrogenaasin kaltaisella kompleksilla on fysiologinen rooli fotosynteesissä hämärässä. Sci. Rep. 5:13908. doi: 10.1038/srep13908
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, S. P., and Scheller, H. V. (2004). Photoinhibition of photosystem I hyytävässä lämpötilassa ja myöhempi elpyminen Arabidopsis thaliana. Kasvisolufysioli. 45, 1595–1602. doi: 10.1093 / pcp/pch180
PubMed Abstract / CrossRef Full Text / Google Scholar