annosmuoto: injektio
Drugs.com. viimeksi päivitetty 22. joulukuuta 2020.
- haittavaikutukset
- annostus
- yhteisvaikutukset
ammatillinen
raskaus
vain Rx.
steriili laskimonsisäinen liuos
- Inamrinoni kuvaus
- Inamrinoni – Kliininen farmakologia
- farmakokinetiikka
- farmakodynamiikka
- Inamrinonin käyttöaiheet ja käyttö
- vasta-aiheet
- Varoitukset
- varotoimet
- Yleiset
- laboratoriokokeet
- Lääkkeiden yhteisvaikutukset
- kemialliset yhteisvaikutukset
- karsinogeneesi, mutageneesi, Fertiliteetin heikkeneminen
- raskaus
- imettävät äidit
- pediatrinen käyttö
- haittavaikutukset
- haittavaikutusten hoito
- yliannostus
- Inamrinonin Annostus ja antotapa
- kemialliset yhteisvaikutukset
- miten inamrinonia toimitetaan
- VIAL LABEL
- More about inamrinone
- Related treatment guides
Inamrinoni kuvaus
Inamrinoni-injektio USP edustaa uutta sydämen inotrooppisten aineiden luokkaa, joka eroaa digitalisglykosideista tai katekoliamiineista. Inamrinonilaktaatti on kemiallisesti 5-Amino-6(1H)-oni 2-hydroksipropanaatti ja sen rakenne on seuraava:
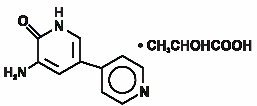
Inamrinoni on vaaleankeltainen kiteinen yhdiste, jonka molekyylipaino on 187,20 ja molekyylikaava c10h9n3o. jokaisen maitohapon moolin molekyylipaino on 90,08 ja empiirinen formula_6o3. Inamrinonin liukoisuudet pH-arvoissa 4, 1, 6, 0 ja 8, 0 ovat vastaavasti 25 mg/mL, 0, 9 mg / mL ja 0, 7 mg / mL.
inamrinoni-injektioneste on kirkas keltainen steriili liuos, joka on saatavana 20 mL: n injektiopulloissa laskimoon annettavaksi. Yksi millilitra sisältää inamrinonilaktaattia, joka vastaa 5 mg Inamrinonia ja 0, 25 mg natriummetabisulfiittia lisättynä säilytysaineena injektionesteisiin käytettävässä vedessä. Kaikki pakkausselosteessa ilmoitetut annokset ilmoitetaan inamrinoniemäksenä. PH säädetään maitohapolla tai natriumhydroksidilla välille 3, 2-4, 0. Maitohapon kokonaispitoisuus voi vaihdella 5 mg: n ja 7,5 mg: n välillä.
Inamrinoni – Kliininen farmakologia
Inamrinoni on positiivinen inotrooppinen aine, jolla on vasodilataattorivaikutus ja joka eroaa rakenteeltaan ja vaikutustavaltaan joko digitalisglykosideista tai katekoliamiineista.
sen inotrooppisten ja vasodilatoristen vaikutusten mekanismia ei ole täysin selvitetty.
inotrooppisen vaikutuksensa osalta kokeelliset todisteet osoittavat, ettei se ole beeta-adrenerginen agonisti. Se estää sydänlihaksen syklistä adenosiinimonofosfaattia (c-AMP) fosfodiesteraasiaktiivisuutta ja lisää c-AMP: n solutasoa. Toisin kuin digitalis, se ei estä natrium-kaliumadenosiinitrifosfataasin toimintaa.
vasodilatoivan vaikutuksensa osalta Inamrinoni vähentää jälkikuormitusta ja esijännitystä suoralla relaksoivalla vaikutuksellaan verisuonten sileään lihakseen.
farmakokinetiikka
kun inamrinonin jakautumistilavuus oli 1, 2 litraa/kg (1-2 minuuttia) laskimoon annetulla 0, 68 mg/kg-1, 2 mg / kg injektiolla terveille vapaaehtoisille koehenkilöille, jakaantumisvaiheen puoliintumisajan ollessa noin 4, 6 minuuttia plasmassa, keskimääräinen näennäinen ensimmäisen kertaluvun terminaalisen eliminaation puoliintumisaika oli noin 3, 6 tuntia. Kongestiivista sydämen vajaatoimintaa sairastavilla potilailla, jotka saivat inamrinoni-infuusioita, keskimääräinen näennäinen ensimmäisen kertaluvun terminaalisen eliminaation puoliintumisaika oli noin 5, 8 tuntia.
inamrinonin on yhdessä tutkimuksessa osoitettu sitoutuvan ihmisen plasmaproteiiniin ultrasuodatuksella in vitro ja toisessa tutkimuksessa 35-49% joko ultrasuodatuksella tai tasapainodialyysillä.
ihmisellä pääasiallinen erittymisreitti on virtsa sekä Inamrinonina että useina metaboliitteina (N-glykolyyli, N-asetaatti, O-glukuronidi ja N-glukuronidi). Terveillä vapaaehtoisilla noin 63% oraalisesta 14C-merkityn Inamrinonin annoksesta erittyi virtsaan 96 tunnin aikana. Ensimmäisten 8 tunnin aikana virtsan radioaktiivisuudesta 51% oli Inamrinonia, 5% N-asetaattina, 8% N-glykolaattina ja alle 5% jokaista glukuronidia kohti. Noin 18% annetusta annoksesta erittyi ulosteeseen 72 tunnissa.
24 tuntia kestäneessä laskimonsisäisessä tutkimuksessa 10-40% annoksesta erittyi virtsaan muuttumattomana Inamrinonina N-asetyylimetaboliitin edustaessa alle 2% annoksesta.
kongestiivista sydämen vajaatoimintaa sairastavilla potilailla vakaan tilan plasmapitoisuudet (2, 4 mikrog/mL) pystyttiin ylläpitämään 5 mikrog/kg/min-10 mikrog/kg / min infuusiolla kyllästysbolusannoksen jälkeen. Joillakin kongestiivista sydämen vajaatoimintaa sairastavilla potilailla, joihin liittyy heikentynyt munuaisten ja maksan perfuusio, inamrinonin pitoisuudet plasmassa saattavat nousta infuusion aikana; siksi hemodynaamisen vasteen ja/tai lääkeainetason seuranta voi olla tarpeen. Potilaan vasteen pääasiallisia mittareita ovat sydänindeksi, keuhkojen kapillaarikiilapaine, keskuslaskimopaine ja niiden suhde plasman pitoisuuksiin. Lisäksi verenpaineen, virtsanerityksen ja painon mittaukset voivat osoittautua hyödyllisiksi, samoin kuin sellaiset kliiniset oireet kuin ortopnea, hengenahdistus ja väsymys.
farmakodynamiikka
potilailla, joilla on alentunut sydänlihaksen toiminta, inamrinoni lisää nopeasti sydämen tuotantoa inotrooppisen ja vasodilatoivan vaikutuksensa vuoksi.
inamrinonin laskimobolusannoksen ollessa 0.Kongestiivista sydämen vajaatoimintaa sairastavilla potilailla sydämen teho suurenee annosriippuvaisesti (noin 28% annoksella 0, 75 mg / kg – noin 61% annoksella 3 mg/kg). Huippuvaikutus saavutetaan 10 minuutin kuluessa kaikilla annoksilla. Vaikutuksen kesto riippuu annoksesta ja kestää noin 1/2 tuntia annoksella 0, 75 mg / kg ja noin 2 tuntia annoksella 3 mg/kg.
samalla annosalueella keuhkojen kapillaarikiilapaine ja perifeerinen kokonaisvastus osoittavat annosriippuvaista alenemista (keskimääräinen suurin aleneminen on 29% keuhkokapillaarikiilapaineessa ja 29% systeemisessä verisuoniresistenssissä). Enintään 3 mg/kg annoksilla on havaittu diastolisen paineen alenemista (enintään 13%). Keskimääräinen valtimopaine laskee (9, 7%) annoksella 3 mg/kg. Syke on yleensä ennallaan.
hemodynaamisten parametrien muutokset säilyvät jatkuvan laskimonsisäisen infuusion aikana ja useita tunteja sen jälkeen.
inamrinoni on tehokas täysin digitalisoituneilla potilailla aiheuttamatta merkkejä sydänglykosiditoksisuudesta. Sen inotrooppiset vaikutukset ovat additiivisia digitaliksen vaikutuksiin verrattuna. Eteislepatuksen/eteisvärinän tapauksissa on mahdollista, että inamrinoni voi lisätä kammiovastetta, koska se parantaa hieman A/V-johtumista. Näissä tapauksissa suositellaan digitalis-hoitoa.
vasemman kammion toiminnan paranemista ja kongestiivisen sydämen vajaatoiminnan lievittymistä on havaittu potilailla, joilla on iskeeminen sydänsairaus. Paranemista on tapahtunut aiheuttamatta sydänlihaksen iskemian oireita tai elektrokardiografisia merkkejä.
tasaisella syketiheydellä ja verenpaineella sydämen tuotannon lisääntyminen tapahtuu ilman mitattavissa olevaa sydänlihaksen hapenkulutuksen kasvua tai muutoksia Valtimo-happierossa.
inotrooppinen aktiivisuus säilyy toistuvien inamrinoniannosten jälkeen laskimoon. Inamrinonin anto tuottaa hemodynaamista ja oireenmukaista hyötyä potilaille, joita tavanomainen diureettihoito ja sydänglykosidihoito eivät saa tyydyttävästi hallintaan.
Inamrinonin käyttöaiheet ja käyttö
Inamrinoni-injektio on tarkoitettu kongestiivisen sydämen vajaatoiminnan lyhytaikaiseen hoitoon. Rajallisen kokemuksen ja vakavien haittavaikutusten mahdollisuuden vuoksi (KS. haittavaikutukset) inamrinonia tulee antaa vain potilaille, joita voidaan seurata tarkasti ja jotka eivät ole saaneet riittävää vastetta digitaliksella, diureeteilla ja/tai vasodilataattoreilla. Kokemukset inamrinonin laskimonsisäisestä käytöstä kontrolloiduissa tutkimuksissa eivät ulotu yli 48 tunnin toistuviin bolus-ja / tai jatkuviin infuusioihin.
riippumatta siitä, annetaanko Inamrinonia oraalisesti, yhtäjaksoisesti suonensisäisesti vai jaksoittaisesti suonensisäisesti, sen paremmin kuin minkään muunkaan syklisestä AMP: stä riippuvan inotroopin ei kontrolloiduissa tutkimuksissa ole osoitettu olevan turvallinen tai tehokas kongestiivisen sydämen vajaatoiminnan pitkäaikaishoidossa. Kontrolloiduissa tutkimuksissa, joissa annettiin kroonista oraalista hoitoa eri tällaisilla aineilla (mukaan lukien Inamrinoni), oireet eivät johdonmukaisesti lievittyneet, ja syklisestä AMP: sta riippuvaisiin INOTROOPPEIHIN liittyi johdonmukaisesti lisääntynyt sairaalahoidon ja kuoleman riski. Erityisen riskialttiita olivat potilaat, joilla oli NYHA-luokan IV oireita.
vasta-aiheet
Inamrinoni on vasta-aiheinen potilaille, jotka ovat yliherkkiä sille.
se on vasta-aiheinen myös potilaille, joiden tiedetään olevan yliherkkiä bisulfiiteille.
Varoitukset
Sisältää natriummetabisulfiittia, sulfiittia, joka voi aiheuttaa allergistyyppisiä reaktioita mukaan lukien anafylaktisia oireita ja hengenvaarallisia tai lievempiä astmakohtauksia tietyille herkille henkilöille. Sulfiittiherkkyyden yleistä esiintyvyyttä yleisväestössä ei tunneta ja todennäköisesti vähäistä. Sulfiittiherkkyyttä esiintyy useammin astmaatikoilla kuin ei-astmaatikoilla.
varotoimet
Yleiset
inamrinonia ei tule käyttää potilailla, joilla on vaikea aortan tai pulmonin läppävika tukoksen kirurgisen lievityksen sijasta. Kuten muutkin inotrooppiset aineet, se voi pahentaa ulosvirtauskanavan tukkeutumista hypertrofisessa subaortisessa ahtaumassa.
laskimonsisäisen inamrinonihoidon aikana verenpainetta ja sydämen lyöntitiheyttä on seurattava ja infuusionopeutta on hidastettava tai se on lopetettava potilailla, joilla verenpaine on laskenut liikaa.
voimakasta diureettihoitoa saaneilla potilailla sydämen täyttöpaine ei ehkä riitä riittävään vasteeseen Inamrinonin kanssa, jolloin nesteen ja elektrolyyttien nauttimisen varovainen vapauttaminen voi olla aiheellista.
supraventrikulaarisia ja kammioperäisiä rytmihäiriöitä on havaittu hyvin riskiryhmässä hoidetuilla potilailla. Vaikka inamrinonin ei sinänsä ole osoitettu olevan rytmihäiriöperäinen, mikä tahansa lääke tai lääkeyhdistelmä voi lisätä sydämen vajaatoiminnassa esiintyvien rytmihäiriöiden mahdollisuutta.
trombosytopeniaa ja maksatoksisuutta on havaittu (KS.haittavaikutukset).
käyttö akuutissa sydäninfarktissa
kliinisiä tutkimuksia ei ole tehty potilailla, jotka ovat akuuttivaiheessa sydämen ultraäänitutkimuksen jälkeen. Siksi inamrinonia ei suositella näissä tapauksissa.
laboratoriokokeet
neste-ja Elektrolyyttiarvot
neste-ja elektrolyyttimuutoksia sekä munuaisten toimintaa tulee seurata huolellisesti Inamrinonihoidon aikana. Diureesin aiheuttama sydämen ulostulon paraneminen voi vaatia diureettiannoksen pienentämistä. Liiallisen diureesin aiheuttama kaliumhäviö voi altistaa digitalisoituneelle potilaalle rytmihäiriöille. Siksi hypokalemia on korjattava kaliumlisällä ennen Inamrinonin käyttöä tai sen aikana.
Lääkkeiden yhteisvaikutukset
suhteellisen rajoitetussa kokemuksessa ei ole havaittu epätavallisia kliinisiä oireita potilailla, joilla inamrinonia on käytetty samanaikaisesti seuraavien lääkkeiden kanssa: digitalisglykosidit; lidokaiini, kinidiini; metoprololi, propranololi; hydralatsiini, pratsosiini; isosorbididinitraatti, nitroglyseriini; klortalidoni, etakryynihappo, furosemidi, hydroklooritiatsidi, spironolaktoni; kaptopriili; hepariini, varfariini; kaliumlisät; insuliini; diatsepaami.
yksi tapausraportti liiallisesta hypotensiosta on raportoitu, kun inamrinonia käytettiin samanaikaisesti disopyramidin kanssa.
kunnes lisää kokemusta on saatavilla, varovaisuutta tulee noudattaa annettaessa samanaikaisesti disopyramidia.
kemialliset yhteisvaikutukset
kemiallinen yhteisvaikutus tapahtuu hitaasti 24 tunnin aikana, kun inamrinonin laskimonsisäinen liuos sekoitetaan suoraan dekstroosia (glukoosia) sisältävien liuosten kanssa. Siksi Inamrinonia ei tule laimentaa liuoksilla, jotka sisältävät dekstroosia (glukoosia) ennen injektiota.
välittömästi tapahtuu kemiallinen yhteisvaikutus, joka ilmenee sakan muodostumisena, kun furosemidia injektoidaan inamrinoni-infuusiolinjaan laskimoon. Siksi furosemidia ei tule antaa inamrinonia sisältävissä laskimolinjoissa.
karsinogeneesi, mutageneesi, Fertiliteetin heikkeneminen
inamrinonin ei havaittu olevan karsinogeeninen, kun sitä annettiin rotille ja hiirille suun kautta enintään kahden vuoden ajan annostasoilla aina suurimmalla siedetyllä annoksella 80 mg/kg / vrk asti.
hiiren mikrotumatesti (7, 5-10 kertaa ihmisen maksimiannos) ja kiinanhamsterin munasarjan kromosomipoikkeavuustesti olivat positiivisia, mikä osoitti sekä klastogeenisen potentiaalin että polykromaattisten punasolujen määrän estymisen. Amesin Salmonellakoe, hiiren lymfoomakoe ja viljelty ihmisen lymfosyyttimetafaasianalyysi olivat kuitenkin kaikki negatiivisia. Klastogeeniset vaikutukset ovat vastakkaisia negatiivisille tuloksille, joita saatiin rotilla tehdyissä uros-ja naarasrotilla tehdyissä hedelmällisyystutkimuksissa sekä kolmen sukupolven tutkimuksessa rotilla, joissa molemmissa käytettiin suun kautta annettuja annoksia.
näissä tutkimuksissa havaittiin lievää rotan tiineysajan pitenemistä annoksilla 50 mg/kg/vrk ja 100 mg/kg / vrk. Synnytyshäiriöitä esiintyi emoilla, jotka saivat 100 mg / kg / vrk, mikä lisäsi kuolleena syntyneiden määrää, pienensi poikuekokoa ja heikensi poikasten eloonjäämistä.
raskaus
teratogeeniset vaikutukset – Raskauskategoria c
Uuden-Seelannin valkoisilla kaneilla inamrinonin on osoitettu aiheuttavan sikiön luustoon ja ulkoisiin epämuodostumiin suun kautta annetuilla annoksilla 16 mg/kg ja 50 mg / kg, jotka olivat kaniineille myrkyllisiä. Ranskalaisille Hy/Cr-kaniineille tehdyt tutkimukset, joissa käytettiin suun kautta annettuja annoksia enintään 32 mg/kg/vrk, eivät vahvistaneet tätä havaintoa. Epämuodostumia ei havaittu rotilla, jotka saivat inamrinonia laskimoon suurimmalla käytetyllä annoksella 15 mg/kg/vrk (suurin piirtein suositeltu vuorokausiannos kongestiivista sydämen vajaatoimintaa sairastaville potilaille). Ei ole olemassa tarkkoja ja hyvin kontrolloituja tutkimuksia käytöstä raskaana oleville naisille. Inamrinonia tulee käyttää raskauden aikana vain, jos mahdollinen hyöty on suurempi kuin mahdollinen riski sikiölle.
imettävät äidit
varovaisuutta tulee noudattaa annettaessa inamrinonia imettäville naisille, koska ei tiedetä, erittyykö Inamrinoni äidinmaitoon.
pediatrinen käyttö
turvallisuutta ja tehoa lapsipotilailla ei ole osoitettu.
haittavaikutukset
trombosytopenia: Inamrinonin laskimonsisäinen injektio vähensi trombosyyttiarvoa alle 100 000 / mm3: n tai normaalin rajan 2, 4 prosentilla potilaista.
se on yleisempää potilailla, jotka saavat pitkäaikaista hoitoa. Tähän mennessä tarkoin seuratuissa kliinisissä tutkimuksissa ei ole havaittu verenvuotoja potilailla, joiden trombosyyttiarvo ei ole laskenut.
verihiutaleiden väheneminen riippuu annoksesta ja johtuu verihiutaleiden elinajan lyhenemisestä. Useille potilaille, joille kehittyi trombosytopenia Inamrinonihoidon aikana, tehtiin normaalit luuydintutkimukset. Verihiutaleiden vähenemiseen ei ole liittynyt immuunivastetta eikä trombosyyttejä aktivoivaa tekijää.inamrinonin kliinisen käytön aikana raportoituja maha-suolikanavan haittavaikutuksia olivat pahoinvointi (1, 7%), oksentelu (0, 9%), vatsakipu (0, 4%) ja ruokahaluttomuus (0, 4%).
kardiovaskulaariset vaikutukset: Inamrinonin yhteydessä ilmoitettuja kardiovaskulaarisia haittavaikutuksia ovat rytmihäiriöt (3%) ja hypotensio (1, 3%).
maksatoksisuus: Koirilla laskimoon annetuilla annoksilla 9 mg / kg / vrk – 32 mg/kg/vrk Inamrinonilla osoitettiin annosriippuvaista maksatoksisuutta, joka ilmeni joko entsyymiarvojen nousuna tai maksasolunekroosina tai kumpanakin. Maksatoksisuutta on havaittu ihmisellä pitkäaikaisen suun kautta annetun inamrinonin jälkeen ja sitä on havaittu vähäisessä määrin (0, 2%) laskimonsisäisen inamrinonin annon jälkeen. Myös entsyymi-ja bilirubiiniarvojen nousua ja keltaisuutta on raportoitu harvoin.
yliherkkyys: useita ilmeisiä yliherkkyysreaktioita on raportoitu potilailla, jotka ovat saaneet inamrinonia suun kautta noin kahden viikon ajan. Merkit ja oireet olivat vaihtelevia, mutta niitä olivat perikardiitti, keuhkopussitulehdus ja askites (1 tapaus), myosiitti, johon liittyi interstitiaalista varjostusta rintakehän röntgenkuvassa ja kohonnut sedimentaationopeus (1 tapaus) ja vaskuliitti, johon liittyi nodulaarinen keuhkotiheys, hypoksemia ja keltaisuus (1 tapaus). Ensimmäinen potilas kuoli, ei välttämättä mahdolliseen reaktioon, kun taas kaksi viimeistä paranivat hoidon lopettamisen myötä. Yhtäkään näistä tapauksista ei ole haastettu uudelleen, joten inamrinonin aiheuttamisesta ei ole varmuutta, mutta mahdolliset yliherkkyysreaktiot on otettava huomioon potilailla, jotka saavat inamrinonia pitkään.
yleistä: inamrinonin laskimonsisäisissä kliinisissä tutkimuksissa havaittuja muita haittavaikutuksia ovat kuume (0, 9%), rintakipu (0, 2%) ja polttelu injektiokohdassa (0, 2%).
haittavaikutusten hoito
trombosyyttien määrän väheneminen: Oireeton trombosyyttien määrän väheneminen (<150 000 / mm3) voidaan korjata viikon kuluessa lääkeannoksen laskusta. Lisäksi ilman muutoksia lääkkeen annostuksessa, määrä voi vakiintua alhaisemmalle tasolle kuin ennen lääkettä ilman kliinisiä seuraamuksia. Lääkkeen käyttöä edeltäviä trombosyyttiarvoja ja hoidon aikana usein esiintyviä trombosyyttiarvoja suositellaan helpottamaan annostuksen muuttamista koskevia päätöksiä.
Jos trombosyyttien määrä on alle 150 000 / mm3, seuraavia toimia voidaan harkita:
• pidä kokonaisvuorokausiannos muuttumattomana, koska joissakin tapauksissa määrä on joko vakiintunut tai palautunut hoitoa edeltävälle tasolle. * Pienennä kokonaisvuorokausiannosta. * Lopeta inamrinoni, jos lääkärin kliinisen arvion mukaan riski ylittää mahdollisen hyödyn.
ruoansulatuskanavan haittavaikutukset: vaikka ruoansulatuskanavan haittavaikutuksia havaittiin harvoin laskimonsisäisen hoidon yhteydessä, jos vakavia tai heikentäviä ilmenee, lääkäri saattaa haluta pienentää annosta tai lopettaa lääkkeen käytön tavanomaisten hyöty-riskisyistä johtuvien näkökohtien perusteella.
maksatoksisuus: Laskimonsisäisestä annostelusta tähän mennessä saaduissa kliinisissä kokemuksissa maksatoksisuutta on havaittu harvoin. Jos maksaentsyymeissä ilmenee akuutteja huomattavia muutoksia ja niihin liittyy kliinisiä oireita, jotka viittaavat idiosynkraattiseen yliherkkyysreaktioon, Inamrinonihoito on lopetettava välittömästi.
Jos muutoksia entsyymissä tapahtuu vähemmän kuin huomattavia ilman kliinisiä oireita, nämä epäspesifiset muutokset tulee arvioida yksilöllisesti. Lääkäri voi haluta jatkaa Inamrinonia, pienentää annostusta tai lopettaa lääkkeen käytön tavanomaisten hyöty-riskinäkökohtien perusteella.
yliannostus
on raportoitu kuolemaan johtaneita tapauksia, joissa inamrinonia on otettu vahingossa yliannos (840 mg kolmen tunnin aikana boluksena ja infuusiona), joskin syy-yhteys on epävarma. Valmisteen valmistuksen ja annostelun aikana on noudatettava varovaisuutta.
Inamrinoniannokset voivat aiheuttaa hypotensiota sen vasodilatoivan vaikutuksen vuoksi. Jos näin tapahtuu, Inamrinonin antoa on vähennettävä tai se on lopetettava. Spesifistä vastalääkettä ei tunneta, mutta yleisiä verenkiertoelimistön tukitoimenpiteitä on toteutettava.
rotilla laktaattisuolana inamrinonin LD50 oli kahdessa eri tutkimuksessa laskimoon 102 mg/kg tai 130 mg/kg ja suun kautta (introgastisesti) 132 mg/kg; suspensiona vesipitoisessa ikenitraktantissa suun kautta LD50 oli 239 mg / kg.
Inamrinonin Annostus ja antotapa
Inamrinoni-injektion Kyllästysannokset tulee antaa pakkauksen mukaan (laimentamattomana). Inamrinoni-infuusiot voidaan antaa normaalissa tai puolikuntoisessa suolaliuoksessa pitoisuudeksi 1 mg / mL-3 mg/mL. Laimennetut liuokset on käytettävä 24 tunnin kuluessa.
inamrinoni-injektio voidaan tarvittaessa antaa dekstroosi-infuusiona (glukoosi -) y-liittimen kautta tai suoraan letkustoon.
kemialliset yhteisvaikutukset
kemiallinen yhteisvaikutus tapahtuu hitaasti 24 tunnin aikana, kun inamrinonin laskimonsisäinen liuos sekoitetaan suoraan dekstroosia (glukoosia) sisältävien liuosten kanssa. Siksi Inamrinonia ei tule laimentaa liuoksilla, jotka sisältävät dekstroosia (glukoosia) ennen injektiota.
välittömästi tapahtuu kemiallinen yhteisvaikutus, joka ilmenee sakan muodostumisena, kun furosemidia injektoidaan inamrinoni-infuusiolinjaan laskimoon. Siksi furosemidia ei tule antaa inamrinonia sisältävissä laskimolinjoissa.
seuraavaa toimenpidettä suositellaan Inamrinoni-injektion antamiseksi:
1. Aloita hoito 0, 75 mg/kg kyllästysannoksella, joka annetaan hitaasti 2-3 minuutin aikana.
|
LOADING DOSE DETERMINATION 0.75 mg/kg (undiluted) |
||||||||||
|
Patient Weight in kg |
||||||||||
|
mL of undiluted Inamrinone Injection |
||||||||||
2. Continue therapy with a maintenance infusion between 5 mcg/kg/min and 10 mcg/kg/min.
3. Based on clinical response, an additional loading dose of 0.75 mg/kg may be given 30 minutes after the initiation of therapy.
4. Infuusionopeus vaihtelee yleensä välillä 5 mikrog / kg/min-10 mikrog/kg/min siten, että suositeltu kokonaisvuorokausiannos (kyllästysannokset mukaan lukien) ei ylitä 10 mg / kg. Rajoitettu määrä potilaita, joita on tutkittu suuremmilla annoksilla, tuki annostusta 18 mg/kg/vrk, jotta hoidon kesto lyhenisi.
seuraavaa infuusionopeuskaaviota voidaan käyttää laskelmien oikeellisuuden varmistamiseen.
kaavion käyttämiseksi Käytetyn inamrinoni-infuusioliuoksen pitoisuuden on oltava 2, 5 mg/mL (2500 mcg / mL). Tämä pitoisuus valmistetaan sekoittamalla Inamrinoniliuosta yhtä suureen määrään liuotinta (normaalia tai puoliksi normaalia suolaliuosta).
| * laimennus: infuusioon suositellun 2, 5 mg / mL: n pitoisuuden valmistamiseksi sekoitetaan Inamrinonia yhtä suureen laimennusmäärään. Sekoitetaan esimerkiksi kolme inamrinonia sisältävää 20 mL: n injektiopulloa (3 x 20 mL = 60 mL) 60 mL: aan liuotinta, jolloin lopullisen 2, 5 mg/mL inamrinoniliuoksen kokonaistilavuus on 120 mL. | ||||||||||
|
Inamrinone IV INFUSION RATE (mL/hr) CHART Using 2.5 mg/mL Infusion Concentration* |
||||||||||
|
Patient Weight in kg |
||||||||||
|
Dosage: 5.0 mcg/kg/min |
||||||||||
|
7.5 mcg/kg/min |
||||||||||
|
10.0 mcg/kg/min |
||||||||||
Example: A 70 kg patient would require a loading dose of 10.5 mL of undiluted Inamrinone. If the physician selects a dose of 7.5 mcg/kg/min infuusiona virtausnopeus olisi 13 mL / h, kun inamrinonin pitoisuus on 2, 5 mg/mL.
5. Antonopeus ja hoidon kesto on sovitettava potilaan vasteen mukaan. Lääkäri saattaa haluta pienentää tai titrata infuusiota alaspäin kliinisen vasteen tai haittavaikutusten perusteella.
edellä mainittujen hoito-ohjelmien voidaan odottaa asettavan useimpien potilaiden inamrinonipitoisuuden plasmassa noin 3 mikrog / mL: aan. Sydänindeksin nousu osoittaa lineaarisen suhteen plasmapitoisuuteen alueella 0.5 mikrog/mL-7 mikrog/mL. Suurempia pitoisuuksia plasmassa ei ole havaittu.
potilaan paraneminen voi näkyä sydämen tuotannon lisääntymisenä, keuhkokapillaarikiilapaineen pienenemisenä ja kliinisinä vasteina, kuten hengenahdistuksen vähenemisenä ja muiden sydämen vajaatoiminnan oireiden, kuten ortopnean ja väsymyksen, lievenemisenä.
keskuslaskimopaineen (CVP) seurannasta voi olla hyötyä arvioitaessa hypotensiota ja nestetasapainon hallintaa. Ennen nesteen/elektrolyyttien korjaamista tai säätämistä on välttämätöntä, jotta saavutetaan tyydyttävä vaste Inamrinonilla.
parenteraaliset lääkevalmisteet on tarkastettava silmämääräisesti, eikä niitä saa käyttää, jos havaitaan hiukkasia tai värimuutoksia.
miten inamrinonia toimitetaan
INAMRINONI-injektio USP toimitetaan kerta-annoksen injektiopulloissa, joissa on 20 mL steriiliä, kirkkaankeltaista liuosta erikseen pakattuna. NDC 55390-042-10.
yksi 1 mL sisältää inamrinonilaktaattia vastaten 5 mg Inamrinonia.
suojaa valolta. Pakkaus on valonkestävä ja suojaa varastoinnin aikana. Säilytä ulkopakkauksessa käyttöaikaan asti.
säilytä valvotussa huoneenlämmössä 15° C-30°C (59° – 86°F).
Manufactured by: Manufactured for:
Ben Venue Laboratories, Inc. Bedford Laboratories™
Bedford, OH 44146 Bedford, OH 44146
August 2002 AMR-P01
VIAL LABEL

Vial Label 100 mg/20 mL
| Inamrinone Inamrinone injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Bedford Laboratories (884528407)
Registrant – Ben Venue Laboratories (004327953)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Ben Venue Laboratories Inc. | 004327953 | MANUFACTURE(55390-042) | |
More about inamrinone
- Side Effects
- During Pregnancy
- Dosage Information
- Drug Interactions
- Drug class: inotropic agents
Related treatment guides
- Heart Failure
Medical Disclaimer