- Isäntäspesifinen vuorovaikutus Rhizobiumin ja Kasvikumppaneiden välillä
- Määritä ja määrittelemätön kyhmyjen kehittyminen
- symbioottisten solujen kasvuun liittyy Isäntägenomin monistuminen Endoreduplikaatiosyklien avulla
- typpeä kiinnittävien Bakteroidien eri kohtaloita
- Isäntäpeptidit säätelevät bakteerien erilaistumista
- ncr247: an Example for Multi-Target Host Effector
- johtopäätös
- Eturistiriitalausunto
- tunnustuksia
Isäntäspesifinen vuorovaikutus Rhizobiumin ja Kasvikumppaneiden välillä
bakteereita, jotka muodostavat typpeä sitovan symbioosin α-Ja β-proteobakteeriryhmiin kuuluvien palkokasvien kanssa, kutsutaan yhteisesti rhizobiaksi (Chen et al., 2003; MacLean et al., 2007). Monet α-proteobakteerit ovat pitkäaikaisessa vuorovaikutuksessa korkeampien eukaryoottien kanssa. Nämä vuorovaikutukset vaihtelevat pintasolonoinnista fakultatiivisten symbioottisten suhteiden kautta velvoittamaan solunsisäisiä taudinaiheuttajia tai endosymbionttisia elämäntapoja. Kyhmyjen muodostumiseen, isäntäsoluinfektioon ja typensidontaan tarvittavat symbioottiset geenit on hankittu lateraalisella geeninsiirrolla, joka on rhizobian geneettisen monimuotoisuuden ensisijainen lähde. Siksi rhizobia voisi olla läheisempää sukua taudinaiheuttajille (kuten Agrobacterium tai Brucella) kuin toisilleen. Rhizobialla on yleensä suuria genomeja (jopa 10.5 Mbp)joka nopeasti kasvava rhizobia ovat hajallaan useita replikoneja (MacLean et al., 2007). Esimerkiksi Sinorhizobium meliloti, Medicago-lajien endosymbiontti, on kolmijakoinen genomi; 3,65 Mbp-kromosomi ja kaksi megaplasmidia, pSymA ja pSymB (1,35 ja 1,68 Mbp), jotka molemmat ovat välttämättömiä ja kantavat valtaosan symbioottisista geeneistä. Monet S. meliloti-kannat sisältävät kuitenkin lisää apuaineita keskikokoisia plasmideja ja siten S. meliloti-genomi voi sisältää jopa 9 000 geeniä (Barnett et al., 2001; Capela et al., 2001). Toisin kuin rhizobia, velvoittaa endosymbionts hyönteisten yleensä hallussaan voimakkaasti vähentynyt (160-450 Kbp) genomi, joka takaa niiden lisääntyminen ja koodit muutamia erityisiä biosynteettisiä reittejä, mukaan lukien ne, jotka täyttävät isännän tarve (Moran et al., 2008; Price et al., 2011). Nämä uskomattoman pelkistyneet genomit kuitenkin monistuvat kompensoiden pienentyneen genomin polyploidisella DNA-pitoisuudella.
rhizobian kasvikumppanit kuuluvat leguminosae / Fabaceae-heimoon. Typpeä sitova symbioosi on kehittynyt useassa sukuhaarassa, mutta kaikki palkokasvit eivät muodosta symbioosia. Tähän mennessä tunnetaan 12 000 kyhmypaljakkalajia, ja jokaisella on oma Rhizobium-kumppaninsa. Symbioosin käynnistää isäntäkasvin typen nälkiintyminen, jonka on valittava Rhizobium-kumppaninsa rhizosfäärin miljardeista bakteereista. Tämä saavutetaan erittämällä juuresta flavonoidisignaalimolekyylejä, jotka toimivat sytostaatteina, mutta ennen kaikkea Rhizobium-nodulaatiogeenien indusoijina (Oldroyd, 2013). Näitä geenejä tarvitaan bakteerien signaalimolekyylien tuottamiseen; Nod-tekijät (NFs), jotka käynnistävät kyhmykehitysohjelman isäntäkasvissa (Walker and Downie, 2000). NFS ovat lipokitooligosakkaridimolekyylejä, jotka kuljettavat terminaalisissa sokerijäämissä isäntäkohtaisia substituutioita ja tyypillisiä lipidiketjuja, jotka tunnistavat lysm-tyypin isäntäreseptorit ja joita tarvitaan sekä kyhmyjen kehittymiseen että bakteeri-infektioon. Mielenkiintoista on, että maakasvien muinainen symbioosi arbuskulaaristen mykorritsasien (AM) sienten kanssa toimii samanlaisilla lipochitooligosaccharide-signaalimolekyyleillä, Myc-tekijöillä, jotka havaitaan samanlaisilla mutta erilaisilla LysM-tyyppisillä reseptoreilla kuin NFS (Abdel-Lateif et al., 2012; Oldroyd, 2013). Myc-tekijät ja NFs aktivoivat yhteisen signalointireitin, mutta kasveissa säilyneiden yhteisten symbioottisten geenien mukaantulon jälkeen reitit poikkeavat; toinen johtaa nodulaatioon, toinen AM-symbioosiin.
kasvitartunta ja kyhmyjen muodostuminen ovat monimutkaisia prosesseja; Nyökkäystekijöillä on selvä rooli kyhmyn organogeneesissä ja juurikarvatulehduksessa. Lisäksi Nodin tekijöiden lisäksi erilaiset bakteerien pintapolysakkaridit ovat ratkaisevia tehokkaan infektion kannalta (Fraysse et al., 2003). Useimmissa palkokasveissa rhizobia siirtyy isäntään juurikarvojen kautta, jossa plasmakalvon tunkeutumisen kautta muodostuu infektiolanka (It), joka sisältää lisääntyviä bakteereja ja kasvaa kohti juurikuorta. Harvinaisempi ja ikivanha tartuntamuoto tapahtuu tiettyjen palkokasvien juuripinnan halkeamien kautta.
Määritä ja määrittelemätön kyhmyjen kehittyminen
kyhmyjen kehittyminen edellyttää aivokuoren solujen mitoottista uudelleenaktivoitumista, joka johtaa kyhmyjen primordium-muodostumiseen, joka sitten jakautuu typpeä sitoviksi juurikyhmyiksi, jotka aiheuttavat mikroaerobisen tilan bakteroidien happiherkän nitrogenaasientsyymin toiminnan keskusalueella. Isäntäsolun proliferaation ohimenevästä ja pysyvästä luonteesta riippuen kyhmyt voivat olla joko määrittäviä tai epämääräisiä (Terpolli et al., 2012; Kondorosi et al., 2013). Determinaattisissa kyhmyissä ei ole meristeemiä ja ne sisältävät symbioottisia soluja homogeenisesti. Determinoituja kyhmyjä kehittyy esimerkiksi Phaseolus vulgaris-ja Lotus japonicus-juuriin.
päinvastoin aktiivinen solunjakautuminen säilyy epämääräisissä kyhmyissä. Apikaalisella alueella (vyöhykkeellä I) esiintyy kyhmymeristeemi, joka uusien solujen jatkuvan muodostumisen myötä aiheuttaa jatkuvaa kasvua ja pitkänomaisen kyhmyn muodon. Meristeemistä lähtevät solut eivät enää jakaudu ja siirtyvät erilaistumisvaiheeseen. Infektiolanka vapauttaa bakteerit submistemaattisiin soluihin, jotka erilaistuvat vähitellen infektiovyöhykkeen (zone II) 12-15 solukerrosta pitkin, mikä johtaa typpeä kiinnittävien symbioottisten solujen kehittymiseen kyhmyvyöhykkeellä III (Kuva 1; Franssen et al., 1992). Medicago sativa, M. truncatula, Vicia sativa ja Pisum sativum ovat esimerkkejä kasveista, jotka muodostavat epämääräisiä kyhmyjä.
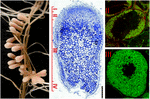
kuva 1. Typpeä kiinnittävien juurikyhmyjen rakenne muodostuu S. meliloti-M. truncatula-symbioosissa. Eri kyhmyvyöhykkeet on merkitty pitkittäiseen kyhmyvyöhykkeeseen: I) meristem, II) infektiovyöhyke, III) typen kiinnitysvyöhyke, IV) vanhenemisvyöhyke. Symbioottiset solut vyöhykkeellä II sisältävät differentioivia endosymbiontteja, kun taas vyöhykkeellä III isäntäsytoplasma on täynnä pitkiä typpeä sitovia bakteroideja. Syto9: llä värjätyissä endosymbionteissa on vihreä fluoresenssi.
symbioottisten solujen kasvuun liittyy Isäntägenomin monistuminen Endoreduplikaatiosyklien avulla
äärimmäistä kasvisolun laajentumista voidaan havaita sekä määritetyissä että määrittelemättömissä kyhmyissä. Typpeä sitovan symbioottisen solun sytoplasmassa on noin 50 000 bakteroidia. Jotta näin suuri määrä endosymbiontteja mahtuu, isäntäsolut kasvavat. M. truncatula nodules määrä typpeä kiinnittävien solujen on 80-kertainen suurempi kuin diploidi meristemaattinen soluja. Infektoituneiden solujen kasvu tapahtuu vaiheittain vyöhykkeellä II ja on seurausta genomin toistuvasta endoreduplikaatiosta (ER) ilman mitoosia. Vyöhykkeellä II solusyklikoneistot ovat edelleen aktiivisia, mutta mitoottisten sykliinien puuttuminen estää mitoosia ja muuntaa mitoottiset syklit endoreduplikaatiosykleiksi (Cebolla et al., 1999). Tämä saavutetaan solusyklin kytkimellä CCS52A proteiini, joka mitoottisten sykliinien tuhoamisella indusoi toistuvia genomikierroksia, jotka johtavat vähitellen kasvavien polyploidisten solujen muodostumiseen (Roudier et al., 2003; Kondorosi ja Kondorosi, 2004). Medicago lajien ploidia tasot voivat saavuttaa 64C edustaa 64-kertainen suurempi DNA-pitoisuus verrattuna haploidisia soluja (C vastaa haploidinen DNA-pitoisuus; Vinardell et al., 2003). CCS52A: n Down-säätely M. truncatulassa ei vaikuttanut primordiumin muodostumiseen, mutta oli haitallista kyhmyjen erilaistumiselle, mikä osoittaa, että ER-syklit ja suurten erittäin polyploidisten solujen muodostuminen ovat välttämättömiä kyhmyjen toiminnalle (Vinardell et al., 2003). Mielenkiintoista on, että AM-sieniä sisältävät aivokuoren solut ovat myös polyploidisia, samoin kuin sukkulamatoja ruokkivat jättiläisjuurisolut (Favery et al., 2002; Genre ym., 2008). Samoin hyönteisten symbioottiset solut, solunsisäisiä endosymbiontteja sisältävät bakteriosyytit ovat myös suuria ja polyploidisia (Nakabachi et al., 2010). In angiosperm kasveja, polyploidia on usein ja erityinen perinnöllinen malli polyploidia eri elimissä, kudoksissa ja solutyypeissä viittaavat siihen, että se voisi olla merkittävä lähde erikoistunut fysiologia isäntäsolujen (Nagl, 1976; Edgar et al., 2014). Solukasvun lisäksi useat geenikopiot, kromosomin tiivistymisen puute voivat edistää suurempaa transkriptionaalista ja metabolista toimintaa. Polyploidian liittyminen eri solutoimintoihin viittaa kuitenkin polyploidian vaikutukseen myös nukleosomien arkkitehtuuriin ja tiettyjen genomialueiden aktivaatiota tai tukahduttamista säätelevään epigenomiin. Näin ollen symbioottisten solujen polyploidinen genomipitoisuus näyttää olevan edellytys kyhmyjen erilaistumiselle ja useimpien symbioottisten isäntägeenien ilmentymiselle (Maunoury ym., 2010).
typpeä kiinnittävien Bakteroidien eri kohtaloita
IT: stä vapautuneet bakteerit esiintyvät isäntäsytoplasmassa organellenkaltaisina rakenteina eli symbiooseina. Bakteereilla ei ole suoraa kontaktia sytoplasmaan, sillä niitä ympäröi peribacteroidikalvo, joka tunnetaan myös symbiosomikalvona (SM). Bakteroidi, SM ja niiden välinen tila muodostavat symbioosin (Catalano et al., 2004). SM: n muodostuminen heijastaa sen plasmakalvon alkuperää, sen koostumuksen myöhemmät muutokset avaavat uusia, erikoistuneita rooleja isäntä-endosymbiont-rajapinnassa (Limpens et al., 2009; Ivanov et al., 2012; Brear ym., 2013; Sinharoy et al., 2013). Bakteroidit lisääntyvät kasvavissa isäntäkyhmysoluissa tiettyyn solutiheyteen, sopeutuvat endosymbioottisiin elintapoihin ja mikroaerobisiin olosuhteisiin ja kypsyvät typpeä sitoviin bakteroideihin. Bakteroidien muoto ja fysiologia voivat kuitenkin olla silmiinpistävän erilaisia eri palkokasveissa. Tietyissä palkokasvien isännissä typpeä sitovilla bakteroideilla on sama morfologia kuin viljellyillä soluilla; tämän tyyppiset bakteroidit voivat palautua vapaasti elävään muotoon. Muissa yhdistyksissä bakteroidit muuttuvat peruuttamattomasti polyploidisiksi, laajentuneiksi, viljelemättömiksi endosymbionteiksi. Nämä terminaalisesti erilaistuneet bakteroidit voivat olla pitkänomaisia ja jopa haarautuneita ja 5-10 – kertaisia pitempiä kuin vapaasti elävät solut tai ne voivat olla isännästä riippuen pallomaisia 8-20-kertaisesti monistettua perimää (Mergaert et al., 2006; Nakabachi ym., 2010). Bakteroidien terminaalinen erilaistuminen on isäntäohjattua, kehittynyt useissa leguminosae-heimon haaroissa osoittaen isäntäedun ja todennäköisesti korkeamman symbioottisen suorituskyvyn (Oono et al., 2010). Bakteroidien terminaalinen erilaistuminen on parhaiten selvitetty S. meliloti – M. truncatula-symbioosissa. M. truncatula nodules, näkyvimmät tapahtumat terminaalinen bakteroid erilaistuminen tapahtuu zone II. monistaminen bakteroidit pysähtyy keskellä zone II jossa solujen venymä ja yhtenäinen vahvistus useita replikonien endoreduplication syklit alkaa. Pitkin 2-3 solukerrosta vyöhykkeiden II ja III rajalla (kutsutaan interzone) bakteroidien äkillinen kasvu näkyy saavuttamassa käytännössä lopullisen kokonsa, mutta typensidonta tapahtuu vain vyöhykkeellä III.
Isäntäpeptidit säätelevät bakteerien erilaistumista
palkokasvien kyhmyranskriptomien Vertailu palautuvaan ja peruuttamattomaan bakteroidien erilaistumiseen paljasti, että oli olemassa useita satoja pieniä geenejä, joita oli vain niiden isäntäkasvien genomissa, joissa bakteroidien erilaistuminen oli terminaalista. M. truncatulassa kyhmysolut tuottavat vähintään 600 kyhmyspesifistä symbioottista peptidiä (symPEPs). SymPEP-geenit aktivoituvat vain S. meliloti infektoituneissa polyploidisissa symbioottisissa soluissa (Kevei et al., 2002; Mergaert et al., 2003), kuitenkin tietyt asetetaan aikaisemmin, toiset aikana myöhemmissä vaiheissa kyhmy kehityksen. Suuri osa, yli 500 geeniä koodaa kyhmyspesifisiä kysteiinipitoisia (NCR) peptidejä (Mergaert et al., 2003; Alunni ym., 2007; Nallu ym., 2014). NCR-peptidit kohdistetaan bakteroideihin ja kun niiden toimittaminen endosymbiontteihin estettiin, bakteroidien erilaistuminen poistettiin osoittaen, että peptidit ovat vastuussa S. meliloti-bakteroidien terminaalisesta erilaistumisesta (Van de Velde et al., 2010). NCR-geenien suuri sekvenssivakio ja tyypilliset ilmentymäkuviot viittaavat niiden toimintojen, toimintatapojen ja bakteerien kohteiden monimuotoisuuteen bakteroidin kypsymisen eri vaiheissa (kuva 2). Mutta miksi isäntäsolu tuottaa arsenaalin NCRs: ää? Mitä hyötyä näin monipuolisesta peptidivalikoimasta voi olla? Onko isännän vuorovaikutus välttämätöntä erilaisten bakteerien kanssa? M. truncatulan symbioottisia kumppaneita ovat S. meliloti ja S. medicae, mutta maaperässä on lukemattomia kantamuunnoksia molemmista lajeista. M. truncatulaa edustavat myös monet erilaiset ekotyypit ja liittymät, jotka eroavat NCR-geenien lukumäärästä, sekvensseistä ja ekspressioprofiilista sekä niiden symbioottisista vuorovaikutuksista eri S. meliloti-ja S. medicae-kantojen kanssa (Nallu et al., 2014; Roux et al., 2014). Kyhmy sisältää yhden bakteerityypin, mutta saman juuriston eri kyhmyillä voi olla erilliset bakteeripopulaatiot. On mahdollista, että eri endosymbiontteja tunnistava kasvi manipuloi niitä kannalle ominaisella peptidien repertuaarilla. Nämä erot voivat lisätä ylimääräisen Säätötason isäntä-symbiontti-spesifisyydelle ja sitä kautta nyökyttelytehokkuudelle.

kuva 2. Sympep-geenien differentiaalinen ilmentyminen M. truncatula-kyhmyissä. Musta signaali: in situ hybridisaatio, sininen signaali: Gus aktiivisuus symPEP promoottori-GUS fuusiot siirtogeenisiä kyhmyjä.
vaikka sympepit edustavat ainutlaatuisia peptidiluokkia, niiden rakenteet muistuttavat antimikrobisia peptidejä (ampeeria). Amp: t, joilla on laaja kirjo mikrobisoluja tappavaa toimintaa, ovat yleisimmin kationisia aiheuttavia solukuolemia huokosmuodostuksen, kalvohäiriöiden ja siitä johtuvan mikrobisolujen lyysin kautta. Se, että solunjakautumiskyky on lopullisesti menetetty endosymbiont-erilaistumisen aikana, osoittaa, että ainakin tietyillä sympepeillä on antimikrobisia vaikutuksia. Bakteerien käsittely synteettisillä Kationisilla NCR-standardeilla johti todellakin useiden gramnegatiivisten ja grampositiivisten bakteerien nopeaan ja tehokkaaseen annosriippuvaiseen eliminoitumiseen, mukaan lukien tärkeät ihmis-ja kasvipatogeenit (Van de Velde et al., 2010; Tiricz ym., 2013). Tämä ex-planta tappaa vaikutus korreloi permeabilization mikrobikalvojen, kuitenkin symPEPs niiden luonnollisessa ympäristössä – kyhmysolujen-eivät permeabilize bakteerikalvoja ja eivät tapa endosymbionts. Todennäköisesti kyhmyjen peptidipitoisuudet ovat huomattavasti alhaisemmat kuin in vitro-määrityksissä. Lisäksi kationisia peptidejä syntyy yhdessä anionisten ja neutraalien peptidien kanssa samassa solussa, ja mahdollinen muutamien kymmenien tai satojen peptidien yhdistelmä erilaisilla varauksilla ja hydrofobisuudella saattaa neutraloida kationisten peptidien suoran bakterisidisen vaikutuksen.
ampeerin tai AMP: n kaltaisten peptidien mukanaolo Rhizobium-legume-symbioosissa ei ole ainutlaatuista. Weevil Sitophilus-järjestelmässä symbioottiset solut tuottavat antimikrobista peptidiä koleopterisiini – a (ColA), joka aiheuttaa jättiläismäisten filamenttisten endosymbionttien kehittymistä estämällä solunjakautumista ja suojaa viereisiä hyönteiskudoksia bakteerien hyökkäykseltä (Login et al., 2011). Tässä järjestelmässä yksi peptidi riittää obligaatin pystysuunnassa siirtyvän endosymbiontin erottamiseen toisin kuin kyhmyt, jotka toimivat sadoilla sympepeillä ja voivat isännöidä endosymbiontteina lukemattomia kanta-variantteja. Kirvan ja Buchneran symbioosissa isäntäsolut tuottavat myös bakteriosyyttispesifisiä peptidejä, mukaan lukien kysteiinipitoiset peptidit (bcrs), jotka muistuttavat Medicago NCR-peptidejä, mutta näiden symbioottisten peptidien toimintaa ei ole vielä raportoitu (Shigenobu and Stern, 2013).
ncr247: an Example for Multi-Target Host Effector
Transkriptome analysis of M. truncatula-kyhmyt niiden eri kehitysvaiheissa, kyhmyalueiden laser-mikrodissektio, in situ-hybridisaatio, valittujen peptidien immunolokalisaatio ja symPEP promoottori-reporter-geenin fuusiot siirtogeenisissä kyhmyissä mahdollistavat yksittäisten peptidien toiminnan kartoittamisen symbioottisissa soluissa varhaisesta infektiosta myöhäiseen typen kiinnitystilaan. NCR247 ilmaistaan vyöhykkeen II vanhemmissa solukerroksissa ja vyöhykkeessä, jossa bakteerien solunjakautuminen pysähtyy ja endosymbionttien huomattava venyminen tapahtuu (Farkas et al., 2014). Tämä pieni kationinen peptidi tappoi tehokkaasti erilaisia mikrobeja in vitro ja in silico-analyysi osoitti sen äärimmäisen sitoutumiskyvyn proteiineihin. FITC-merkitty NCR247 tuli bakteerien sytosoliin, jossa sen yhteisvaikutukset lukuisten bakteeriproteiinien kanssa olivat mahdollisia. Sitovat kumppanit tunnistettiin käsittelemällä S. meliloti-bakteereja tai bakteroideja StrepII/FLAG-merkityillä peptideillä, minkä jälkeen tehtiin affiniteettikromatografia ja tunnistettiin vuorovaikutuskumppanit LC-MS/MS: n kanssa sekä Läntinen analyysi (Farkas et al., 2014).
yksi interaktoreista oli FtsZ-solunjakautumisproteiini, jolla oli ratkaiseva ensisijainen rooli solunjakautumisessa. Useiden antibioottisten peptidien tiedetään aiheuttavan bakterisidista tai bakteriostaattista vaikutusta ftsz: n vuorovaikutuksen kautta estäen sen polymeroitumista estäen siten asianmukaisen Z-renkaan ja septumin muodostumisen (Handler et al., 2008). Ncr247 puhdistettiin yhdessä ftsz: n kanssa bakteerien sytoplasmasta ja sen osoitettiin häiritsevän septumin muodostumista. Ncr035, jolla on myös bakterisidinen vaikutus in vitro ja joka on tuotettu samoissa symbioottisissa soluissa kuin NCR247, kerääntyy jakoväliseinään, mikä osoittaa näiden peptidien samanaikaisen tai peräkkäisen toiminnan ja useiden isäntästrategioiden kehittymisen endosymbionttien proliferaation estämiseksi. Toinen tutkimus osoitti, että tärkeiden solunjakautumisgeenien ilmentyminen, mukaan lukien Z-renkaan toimintaan tarvittavat geenit, heikkeni voimakkaasti ncr247: n käsittelemissä soluissa (Pentterman et al., 2014). Bakteerien esikäsittely subletaalisilla ncr247-pitoisuuksilla poisti FITC-NCR035: n lokalisoinnin septumiin ja aiheutti soluvenymän (Farkas et al., 2014).
Ribosomaaliset proteiinit olivat runsaimpia ncr247-vuorovaikutuskumppaneita. Ncr247: n havaittiin estävän voimakkaasti bakteerien proteiinisynteesiä annosriippuvaisesti sekä in vivo että in vitro (Farkas ym., 2014). Nämä tulokset viittasivat siihen, että yksi ncr247-peptidin vaikutusmuoto sitoutuu ribosomeihin sekä bakteerisoluissa että bakteroideissa. Mielenkiintoista on, että bakteroideissa havaittiin muuttunutta kuviota ja vuorovaikutusproteiinien vähentynyttä monimutkaisuutta. Ribosomiproteiinien yleinen ilmentymistaso oli siis bakteroideilla keskimäärin 20 kertaa alhaisempi kuin vapaissa elävissä soluissa, joissa yksittäisten ribosomiproteiinien transkriptien suhteellinen määrä oli erilainen. Ribosomien monipuolistamisella bakteroideilla voi olla merkittävä rooli edistämällä tiettyjen proteiinien kehittynyttä kääntämistä ja tukemalla siten erittäin runsaan typensidontatoiminnon erikoistunutta, energiaa vaativaa fysiologiaa.
GroEL chaperon oli myös ncr247: n suora vuorovaikutuskumppani (Farkas et al., 2014). Viidestä GroEL-proteiinista groel1 tai GroEL2 riittää eloonjäämiseen, kun taas kyhmyssä korkeana ilmaistu GroEL1 on symbioosin kannalta välttämätön (Bittner et al., 2007). Sitä tarvitaan nodulaatiogeenien täydelliseen aktivointiin ja nitrogenaasikompleksin kokoamiseen. GroEL omaa äärimmäisen toiminnallisen monipuolisuuden vuorovaikutuksessa satojen proteiinien kanssa. Ncr247-GroEL1-vuorovaikutus voi vaikuttaa suoraan Groeliin, mutta välillisesti myös Groelin substraatteihin ja niihin liittyviin biologisiin prosesseihin. Groel1: n puuttuminen vaikeaan bakteeri-infektioon ja bakteroidien ylläpito ja erilaistaminen, mikä osoittaa GroEL1: n yleisen tarpeen typen kiinnittämisen kyhmyjen kehittymisen kaikissa vaiheissa.
Groelin ja isäntäpeptidien osallistuminen mikrobien ja isäntien väliseen vuorovaikutukseen ei ole ainutlaatuista Rhizobium-legume-symbioosissa. Weevil symbioottisissa soluissa koleopterisiini-a (ColA) vuorovaikuttaa myös Groelin (Login et al., 2011). Groelilla on myös tärkeä rooli endosymbionttien ylläpidossa (Moran, 1996; Kupper ym., 2014). Koska useimmat symbioottiset järjestelmät ovat vielä tutkimattomia ja suuritehoiset genomiset ja proteomiset työkalut ovat vasta äskettäin saatavilla, voimme vain ennustaa, että isäntäpeptidien välittämä endosymbiont differentaatio, samoin isäntäsolujen genomin monistuminen ja terminaalisesti erilaistuneet endosymbiontit ovat yleisiä symbioosin strategioita.
johtopäätös
symbioottiset ja patogeeniset bakteerit käyttävät samanlaisia lähestymistapoja vuorovaikutuksessa isäntänsä kanssa ja selviytyäkseen isäntäsoluissa, vaikka näiden vuorovaikutusten tulokset olisivat silmiinpistävän erilaiset. Kasvit ja eläimet voivat tuottaa synnynnäisiä immuunivasteita mikro-organismeille, kun mamps (mikro-organismiin liittyvät molekyylikuviot) havaitaan. Tämä havainto johtaa signaloinnin kaskadien aktivointiin ja antimikrobisten efektorien tuotantoon. AMP: n kaltaiset isäntäpeptidit, kuten M. truncatula NCR-peptideillä tai weevil ColA-antimikrobisella peptidillä on keskeinen ja monitahoinen rooli endosymbionttien lisääntymisen ja erilaistumisen valvonnassa, mikä rajoittaa bakteerien esiintymistä symbioottisiin soluihin. Niinpä isäntäorganismit käyttävät näitä efektoripeptidejä kesyttääkseen ja jopa palkatakseen valikoituja mikrobihyökkääjiä palvelukseensa.
Eturistiriitalausunto
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, joita voitaisiin pitää mahdollisena eturistiriitana.
tunnustuksia
työtä laboratorioissamme tukevat Euroopan tutkimusneuvoston”SYM-BIOOTICS”-apuraha Éva Kondorosille (apuraha numero 269067) ja támop-4.2.2.A-11/1/KONV-2012-0035 Euroopan unionin tukema ja Euroopan sosiaalirahaston osarahoittama.
Abdel-Lateif, K., Bogusz, D., and Hocher, V. (2012). Flavonoidien rooli kasvien juurten perustamisessa endosymbiooseihin arbuskulaaristen mykorritsa-sienten, rhizobian ja Frankia-bakteerien kanssa. Laita Signaali. Käyttäydy. 7, 636–641. doi: 10.4161 / psb.20039
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Alunni, B., Kevei, Z., Redondo-Nieto, M., Kondorosi, A., Mergaert, P., and Kondorosi, E. (2007). Genomic organization and evolutionary insights on GRP and NCR genes, two large nodule-specific gene families in Medicago truncatula. Mol. Plant Microbe Interact. 20, 1138–1148. doi: 10.1094/MPMI-20-9-1138
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Barnett, M. J., Fisher, R. F., Jones, T., Komp, C., Abola, A. P., Barloy-Hubler,F., et al. (2001). Koko Sinorhizobium meliloti psyma megaplasmidin nukleotidisekvenssi ja ennustetut toiminnot. Proc. Natl. Acad. Sci. USA 98, 9883-9888. doi: 10.1073 / pnas.161294798
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Bittner, A. N., Foltz, A., and Oke, V. (2007). Sinorhizobium melilotin elinkelpoisuuteen ja onnistuneeseen symbioosiin tarvitaan vain yksi viidestä groEL-geenistä. J. Bakterioli. 189, 1884–1889. doi: 10.1128 / JB.01542-06
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Brear, E. M., Day, D. A., and Smith, P. M. (2013). Iron: an essential micronutrient for the legume-Rhizobium symbiosis. Front. Plant Sci. 4:359. doi: 10.3389/fpls.2013.00359
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Catalano, C. M., Lane, W. S., and Sherrier, D. J. (2004). Biochemical characterization of symbiosome membrane proteins from Medicago truncatula root nodules. Electrophoresis 25, 519–531. doi: 10.1002/elps.200305711
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Capela, D., Barloy-Hubler, F., Gouzy, J., Bothe, G., Ampe, F., Batut, J.,et al. (2001). Palkokasvisymbiont Sinorhizobium meliloti-kannan 1021 kromosomijakson analyysi. Proc. Natl. Acad. Sci. USA 98, 9877-9882. doi: 10.1073 / pnas.161294398
Pubmed Abstract | Pubmed kokoteksti/CrossRef kokoteksti
Cebolla, A., Vinardell, J. M., Kiss, E., Oláh, B., Roudier, F., Kondorosi, A.,et al. (1999). Mitoottinen inhibiittori ccs52 tarvitaan endoreduplikaatioon ja ploidiasta riippuvaiseen solujen laajentumiseen kasveissa. EMBO J. 18, 4476-4484. doi: 10.1093/emboj/18.16.4476
CrossRef koko teksti
Chen, W. M., Moulin, L., Bontemps, C., Vandamme, P., Béna, G., and Boivin-Masson, C. (2003). Β-proteobakteerien aiheuttama palkokasvien symbioottinen typensidonta on yleistä luonnossa. J. Bakterioli. 185, 7266–7272. doi: 10.1128 / JB.185.24.7266-7272.2003
CrossRef Full Text
Edgar, B. A., Zielke, N., and Gutierrez, C. (2014). Endocycles: toistuva evolutionaarinen innovaatio post-mitoottinen solujen kasvua. Nat. Pastori Mol. Solu. Biol. 15, 197–210. doi: 10.1038/nrm3756
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Farkas, A., Maróti, G., Dürgõ, H., Györgypál, Z., Lima, R. M., Medzihradszky, K. F.,et al. (2014). Medicago truncatula symbioottinen peptidi NCR247 edistää bakteerien erilaistumista useiden mekanismien kautta. Proc. Natl. Acad. Sci. USA 111, 5183-5188. doi: 10.1073 / pnas.1404169111
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Favery, B., Complainville, A., Vinardell, J. M., Lecomte, P., Vaubert, D., Mergaert, P.,et al. (2002). The endosymbiosis-induced genes ENOD40 and CCS52a are involved in endoparasitic-nematode interactions in Medicago truncatula. Mol. Plant-Microbe Interact. 15, 1008–1013. doi: 10.1094/MPMI.2002.15.10.1008
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franssen, H. J., Vijn, I., Yang, W. C., and Bisseling, T. (1992). Developmental aspects of the Rhizobium-legume symbiosis. Plant Mol. Biol. 19, 89–107. doi: 10.1007
CrossRef Full Text
Fraysse, N., Couderc, F., and Poinsot, V. (2003). Surface polysaccharide involvement in establishing the Rhizobium–legume symbiosis. Eur. J. Biochem. 270, 1365–1380. doi: 10.1046/j.1432-1033.2003.03492.x
CrossRef Full Text
Genre, A., Chabaud, M., Faccio, A., Barker, D. G., and Bonfante, P. (2008). Prepenetraatiolaitteiden kokoonpano edeltää ja ennustaa arbuskulaaristen mykorritsasienten kolonisaatiomalleja Medicago truncatulan ja Daucus carotan juurikorteksissa. Kasvisolu 20, 1407-1420. doi: 10.1105 / tpc.108.059014
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Handler, A. A., Lim, J. E., and Losick, R. (2008). Sytokineesin peptidi-inhibiittori Bacillus subtilis-bakteerin sporulaation aikana. Mol. Mikrobiolia. 68, 588–599. doi: 10.1111 / j.1365-2958.2008.06173.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ivanov, S., Fedorova, E. E., Limpens, E., De Mita, S., Genre, A., Bonfante, P.,et al. (2012). Rhizobium–legume symbiosis shares an exocytotic pathway required for arbuscule formation. Proc. Natl. Acad. Sci. U.S.A. 109, 8316–8321. doi: 10.1073/pnas.1200407109
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kevei, Z., Vinardell, J. M., Kiss, G. B., Kondorosi, A., and Kondorosi, E. (2002). Kyhmykohtaisen geeniperheen koodaamat glysiinipitoiset proteiinit ovat osallisina symbioottisen kyhmykehityksen eri vaiheissa Medicago spp: llä. Mol. Kasvimikrobit Vuorovaikuttavat. 15, 922–931. doi: 10.1094 / MPMI.2002.15.9.922
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Kondorosi, E., and Kondorosi, A. (2004). Anafaasia edistävän kompleksin endoreduplaatio ja aktivaatio symbioottisen solukehityksen aikana. FEBS Lett. 567, 152–157. doi: 10.1016 / j.febslet.2004.04.075
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Kondorosi, E., Mergaert, P., and Kereszt, A. (2013). Endosymbioottisen elämän paradigma: Rhizobium-bakteerien solujen erilaistuminen isäntäkasvitekijöiden provosoimana. Annu. Pastori Microbiol. 67, 611–628. doi: 10.1146/annurev-micro-092412-155630
CrossRef Full Text
Kupper, M., Gupta, S. K., Feldhaar, H., and Gross, R. (2014). Chaperonin Groelin monipuoliset roolit mikro-organismeissa-hyönteisten vuorovaikutuksissa. FEMS Microbiol. Lett. 353, 1–10. doi: 10.1111/1574-6968.12390
Pubmed Abstract | Pubmed kokoteksti/CrossRef kokoteksti
limpens, E., Ivanov, S., van Esse, W., Voets, G., Fedorova, E., and bisseling, T. (2009). Medicago N2-kiinnittyvät symbioosit saavat endosyyttisen identiteettimerkin Rab7, mutta viivyttävät vacuolar-identiteetin saamista. Kasvisolu 21, 2811-2828. doi: 10.1105 / tpc.108.064410
Pubmed Abstract / Pubmed kokoteksti/CrossRef kokoteksti
Login, F. H., Balmand, S., Vallier, A., Vincent-Monégat, C., Vigneron, A., Weiss-Gayet, M., et al. (2011). Antimikrobiset peptidit pitävät hyönteisten endosymbiontit kurissa. Tiede 334, 362-365. doi: 10.1126 / tiede.1209728
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
MacLean, A. M., Finan, T. M., and Sadowsky, M. J. (2007). Palkokasvien symbioottisten typpeä sitovien bakteerien genomit. Kasvifysioli. 144, 615–622. doi: 10.1104 / s. 107. 101634
Pubmed Abstract | Pubmed kokoteksti | CrossRef kokoteksti
Maunoury, N., Redondo-Nieto, M., Bourcy, M., Van de Velde, W., Alunni, B., Laporte,P., et al. (2010). Symbioottisten solujen ja endosymbionttien erilaistuminen yhdistyy Medicago truncatula-nodulaatiossa kahteen transkriptomi-kytkimeen. PLoS yksi 5: e9519. doi: 10.1371 / lehti.pone.0009519
Pubmed Abstract | Pubmed kokoteksti/CrossRef kokoteksti
Mergaert, P., Nikovics, K., Kelemen, Z., Maunoury, N., Vaubert, D., Kondorosi, A.,et al. (2003). Medicago truncatulan uusi perhe, joka koostuu yli 300 kyhmykohtaisesta geenistä, jotka koodaavat pieniä, eritettyjä polypeptidejä, joissa on säilyviä kysteiinimotiiveja. Kasvifysioli. 132, 161–173. doi: 10.1104/pp.102.018192
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mergaert, P., Uchiumi, T., Alunni, B., Evanno, G., Cheron, A., Catrice, O.,et al. (2006). Eukaryotic control on bacterial cell cycle and differentiation in the Rhizobium-legume symbiosis. Proc. Natl. Acad. Sci. U.S.A. 103, 5230–5235. doi: 10.1073/pnas.0600912103
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Moran, N. A. (1996). Kiihdytti evoluutiota ja Mullerin räikkää endosymbioottisissa bakteereissa. Proc. Natl. Acad. Sci. USA 93, 2873-2878. doi: 10.1073 / pnas.93.7.2873
CrossRef Full Text
Moran, N. A., McCutcheon, J. P., and Nakabachi, A. (2008). Genomiikka ja periytyvien bakteerisymbionttien evoluutio. Annu. Pastori Genet. 42, 165–690. doi: 10.1146 / annurev.genet.41.110306.130119
CrossRef koko teksti
Nakabachi, A., Koshikawa, S., Miura, T., and Miyagishima, S. (2010). Perimän koko pachypsylla venusta (Hemiptera: Psyllidae) ja sen bakteriosyyttien ploidia, symbioottista isäntäsolua, jossa on solunsisäisiä mutualistisia bakteereja, joilla on pienin soluperimä. Sonni. Entomolia. Res. 100, 27-33. doi: 10.1017/S0007485309006737
Pubmed Abstract | Pubmed kokoteksti | CrossRef kokoteksti
Nagl, W. (1976). DNA endoreduplikaatio ja polyteny ymmärretään evolutionaarinen strategioita. Nature 261, 614-615. doi: 10.1038/261614a0
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
nallu, S., Silverstein, K. A., Zhou, P., Young, N. D., and Vandenbosch, K. A. (2014). Suuren kyhmyrikkaiden kysteiinipitoisten peptidien perheen eroavuudet Medicago truncatulan liittymissä. Tehdas J. 78, 697-705. doi: 10.1111 / tpj.12506
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Oldroyd, G. E. (2013). Puhu, ystävä, ja enter: merkinantojärjestelmät, jotka edistävät hyödyllisiä symbioottisia assosiaatioita kasveissa. Nat. Pastori Microbiol. 11, 252–263. doi: 10.1038/nrmicro2990
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Oono, R., Schmitt, I., Sprent, J. I., and Denison, R. F. (2010). Multiple evolutionary origins of legume traits leading to extreme rhizobial differentiation. New Phytol. 187, 508–520. doi: 10.1111/j.1469-8137.2010.03261.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Penterman, J., Abo, R. P., De Nisco, N. J., Arnold, M. F., Longhi, R., Zanda, M.,et al. (2014). Isäntäkasvipeptidit saavat aikaan transkriptiovasteen sinorhizobium meliloti-solusyklin hallitsemiseksi symbioosin aikana. Proc. Natl. Acad. Sci. USA 111, 3561-3566. doi: 10.1073 / pnas.1400450111
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Price, D. R., Duncan, R. P., Shigenobu, S., and Wilson, A. C. (2011). Genomin laajeneminen ja aminohappojen siirtäjien differentiaalinen ilmentyminen kirvan ja buchneran symbioottisessa rajapinnassa. Mol. Biol. Evol. 28, 3113–3126. doi: 10.1093/molbev/msr140
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Roudier, F., Fedorova, E., Lebris, M., Lecomte, P., Györgyey, J., Abad, P.,et al. (2003). The Medicago species A2-type cyclin is auxin regulated and involved in meristem formation but dispensable for endoreduplication-associated developmental programs. Plant Physiol. 131, 1091–1103. doi: 10.1104/pp.102.011122
CrossRef Full Text
Roux, B., Rodde, N., Jardinaud, M. F., Timmers, T., Sauviac, L., Cottret, L.,et al. (2014). Integroitu analyysi kasvien ja bakteerien geeniekspressiosta symbioottisissa juurikyhmyissä käyttäen laser-capture-mikrodissektiota yhdistettynä RNA-sekvensointiin. Tehdas J. 77, 817-837. doi: 10.1111 / tpj.12442
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Shigenobu, S., and Stern, D. L. (2013). Kirvat kehittivät uusia erittämiään proteiineja symbioosiin bakteeriperäisen endosymbiontin kanssa. Proc. Biol. Sci. 280, 20121952. doi: 10.1098 / rspb.2012.1952
Pubmed Abstract | Pubmed kokoteksti/CrossRef kokoteksti
Sinharoy, S., Torres-Jerez, I., Bandyopadhyay, K., Kereszt, A., Pislariu, C. I., Nakashima, J.,et al. (2013). Symbiosomin erilaistumisen C2H2-transkriptiotekijän säätelijä tukahduttaa eritysreitin geenin VAMP721a transkription ja edistää symbiosomin kehittymistä Medicago truncatulassa. Kasvisolu 25, 3584-3601. doi: 10.1105 / tpc.113.114017
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Terpolli, J. J., Hood, G. A., and Poole, P. S. (2012). What determines the efficiency of N(2)-fixing Rhizobium-legume symbioses? Adv. Microb. Physiol. 60, 325–389. doi: 10.1016/B978-0-12-398264-3.00005-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tiricz, H., Szûcs, A., Farkas, A., Pap, B., Lima, R. M., Maróti, G.,et al. (2013). Antimicrobial nodule-specific cysteine-rich peptides induce membrane depolarization associated changes in Sinorhizobium meliloti. Appl. Env. Microbiol. 79, 6737–6746. doi: 10.1128/AEM.01791-13
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Van de Velde, W., Zehirov, G., Szatmari, A., Debreczeny, M., Ishihara, H., Kevei, Z.,et al. (2010). Plant peptides govern terminal differentiation of bacteria in symbiosis. Science 327, 1122–1126. doi: 10.1126/science.1184057
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vinardell, J. M., Fedorova, E., Cebolla, A., Kevei, Z., Horvath, G., Kelemen, Z.,et al. (2003). Anafaasia edistävän kompleksin aktivaattorin CCS52A välittämä endoreduplikaatio tarvitaan Symbioottiseen solujen erilaistumiseen Medicago truncatula-kyhmyissä. Kasvisolu 15, 2093-2105. doi: 10.1105 / tpc.014373
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Walker, S. A., and Downie, J. A. (2000). Rhizobium leguminosarum bv: n merkintä. viciae juurikarvoihin vaatii minimaalisen Nod-tekijän spesifisyyden, mutta myöhempi infektiolangan kasvu vaatii Nodon tai solmun. Mol. Kasvimikrobit Vuorovaikuttavat.13, 54–62. doi: 10.1094 / MPMI.2000.13.7.754
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text