
Sau (Larry) Lee, Ph. D., Office of Testing and Research-viraston apulaisjohtaja ja kehittyvän teknologian tiimin puheenjohtaja, Office of Pharmaceutical Quality, cder
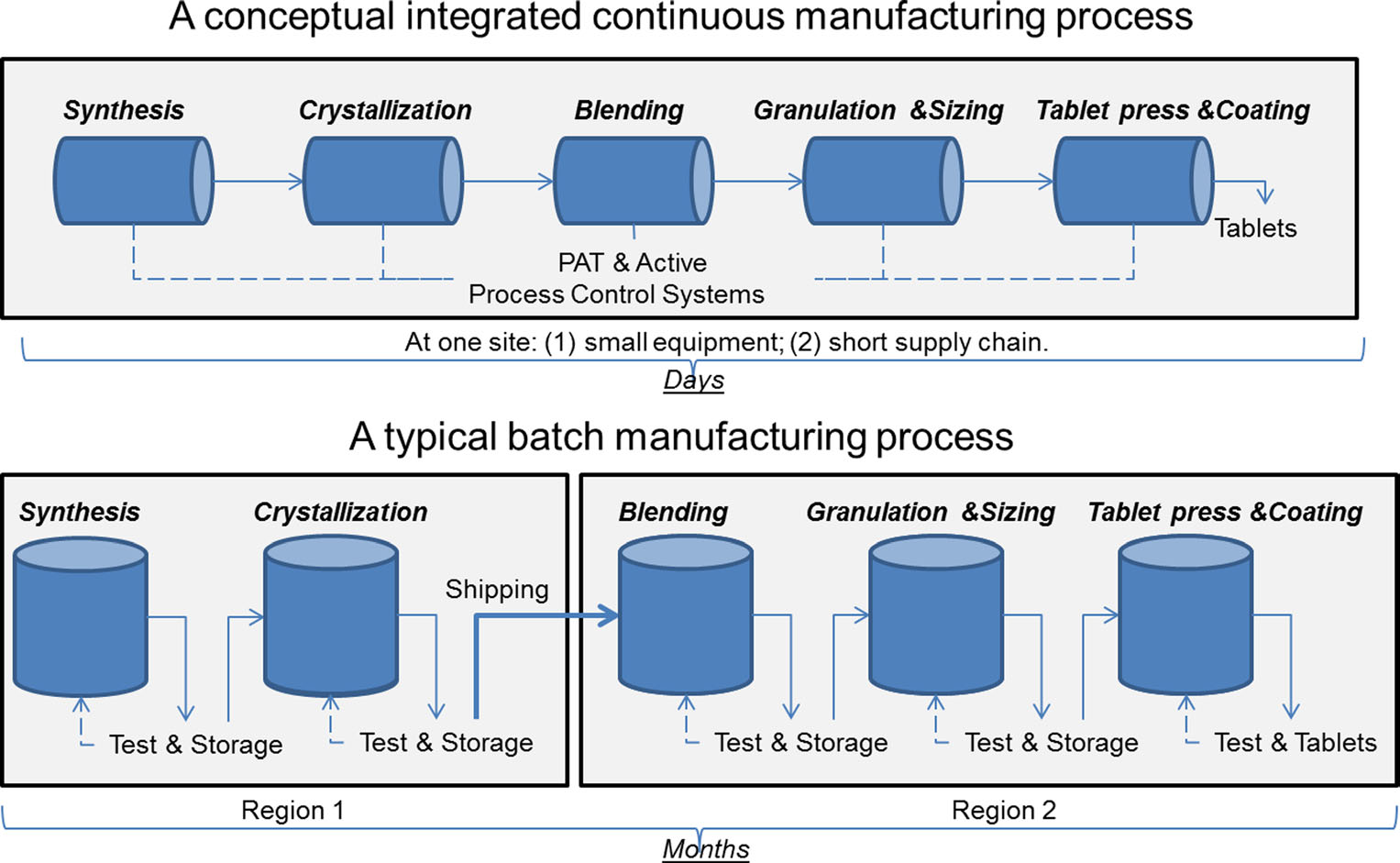 a comparison of continuous manufacturing and batch manufacturing. Kuva sau Leen luvalla. J. Pharm Innov (2015) 10:191-199.
a comparison of continuous manufacturing and batch manufacturing. Kuva sau Leen luvalla. J. Pharm Innov (2015) 10:191-199.yli 50 vuoden ajan lääkkeitä on valmistettu ”erävalmistuksena” tunnetulla menetelmällä, joka on monivaiheinen, pitkä prosessi, jossa käytetään kömpelöitä, suurikokoisia laitteita. Valmistustekniikan viimeaikaiset edistysaskeleet ovat kuitenkin saaneet lääketeollisuuden harkitsemaan siirtymistä erävalmistuksesta nopeampaan ja tehokkaampaan prosessiin, jota kutsutaan jatkuvaksi valmistukseksi. FDA ryhtyy ennakoiviin toimiin helpottaakseen lääketeollisuuden uusien teknologioiden käyttöönottoa, mukaan lukien jatkuva valmistus, tuotteiden laadun parantamiseksi ja monien lääkepulan ja takaisinvetojen taustalla olevien syiden käsittelemiseksi.
erä vs. jatkuva valmistus
Erävalmistus käsittää useita erillisiä vaiheita. Jokaisen prosessin vaiheen jälkeen tuotanto tyypillisesti pysähtyy, jotta näytteet voidaan testata offline-tilassa laadun suhteen. Joskus näiden vaiheiden välisten ”pitoaikojen” aikana materiaali voidaan varastoida säiliöihin tai toimittaa muihin laitoksiin ympäri maailmaa valmistusprosessin loppuun saattamiseksi. Tämä voi lisätä viikkoja tai kuukausia käsittelyaikaan. Joillekin tehoaineille, jotka ovat herkkiä ympäristölle, se voi myös aiheuttaa hajoamisriskin. Lisäksi, jos tietyn lääkkeen kysyntä kasvaa, tuotannon lisääminen voi vaatia suurempia laitteita. Laitteiden skaalaaminen vaatii enemmän fyysistä tilaa, suuremman jalanjäljen sekä enemmän aikaa ja rahaa.
sen sijaan lääkkeitä, jotka on valmistettu jatkuvalla valmistuksella, siirretään tauotta samassa laitoksessa, mikä poistaa pitoajat vaiheiden välillä. Materiaali syötetään täysin integroitujen komponenttien kokoonpanolinjan kautta. Tämä menetelmä säästää aikaa, vähentää inhimillisen virheen todennäköisyyttä ja voi vastata ketterämmin markkinoiden muutoksiin. Suuremman kysynnän vuoksi jatkuva valmistus voi jatkua pidempään, mikä voi vähentää lääkepulan todennäköisyyttä.
molempiin valmistustyyppeihin sovelletaan samoja laadunvalvontastandardeja, mutta valvonta on automatisoitu jatkuvissa tuotantolaitoksissa ja on yleensä yleisempää kuin erävalmistuksessa. Kuten kaikki tekniikka, jatkuva valmistus laitteet voivat kokea kulumista, mutta automaattinen seuranta voi havaita asioita kauan ennen vika tapahtuu. Tällainen seuranta voi myös auttaa ennustamaan laitteen elinajanodotetta, mikä johtaa parempaan ennakoivaan huoltoon.
jatkuva valmistus voi mahdollistaa joustavamman jäljityksen ja jäljityksen, mikä olisi etu tuotteen vikatilanteessa. Esimerkiksi erävalmistuksessa lääkkeen tietty määrä (tai erä) määritellään sen valmistaneen laitteen koon mukaan. Jatkuvassa valmistuksessa määrä (tai erä) voidaan rajata aikaleimalla, tuotetun lääkkeen määrällä tai raaka-aineen määrällä. Näiden seurantamenetelmien avulla valmistaja voi eristää pienemmän määrän viallista materiaalia prosessihäiriön sattuessa, mikä vähentää jätettä ja vähentää pulan mahdollisuutta.
haastava mutta kannattava murros
useat teollisuudenalat—kuten kemian—ja petrokemianteollisuus-ovat jo käyneet läpi valmistuskehityksen ja käyttävät tehokkaita jatkuvia teknologioita tuotteiden turvalliseen valmistamiseen. Lääketeollisuudessa jatkuvaan valmistukseen siirtyminen on kuitenkin monestakin syystä vielä alkutekijöissään. Ensinnäkin tällaisen siirtymän käynnistyskustannukset voivat olla korkeat. Vanhojen erälaitteiden poistaminen, uuden teknologian ostaminen ja henkilöstön kouluttaminen sen käyttämiseksi ja teollisuuden infrastruktuurin uudistaminen on kallista, mikä vaatii vakavaa sitoutumista lääkevalmistajalta. Talousanalyysit ovat silti osoittaneet potentiaalisia merkittäviä pitkän aikavälin säästöjä. Lisäksi joidenkin teknologioiden on vielä kypsyttävä ennen kuin ne ovat kaupallisesti kannattavia. Tietyntyyppisten lääkkeiden, kuten biologisten tuotteiden, valmistamiseen jatkuvalla valmistuksella ei ehkä ole vielä tekniikkaa. Tutkimusta näiden ja muiden haasteiden ratkaisemiseksi tehdään parhaillaan. Lisäksi lääkkeiden valmistajat havaitsevat edelleen sääntelyyn liittyvää epävarmuutta, joka voi viivästyttää tuotteiden hyväksymistä, kun käytetään uutta valmistustekniikkaa.
teollisuuden pohtiessa, miten vaihto tehdään, FDA tarjoaa resursseja ja tietoa helpottamaan siirtymistä. Esimerkiksi virasto tekee yhteistyötä biolääketieteen edistyneen tutkimus-ja Kehitysviranomaisen kanssa, joka on Yhdysvaltain terveys-ja Ihmispalveluministeriön alainen ohjelma, joka auttaa rahoittamaan ja tukemaan tämän alan tutkimusta. Koulutamme myös arviointihenkilöstöämme ja teemme sisäistä tutkimusta jatkuvaan valmistukseen liittyvistä riskialueista, jotta voimme paremmin arvioida niihin liittyviä teknologioita.
johdan kehittyvän teknologian ohjelman monialaista tiimiä CDER: n lääkealan Laatutoimistossa. Ohjelma perustettiin auttamaan teollisuutta toteuttamaan innovatiivisia teknologioita tuotteiden laadun parantamiseksi ja alan nykyaikaistamiseksi pyrkien puuttumaan lääkepulan tai takaisinvetojen taustalla oleviin syihin. Kehittyvä teknologiaohjelma ei koske vain jatkuvaa valmistustekniikkaa, vaan myös muita edistysaskeleita, kuten 3D-tulostusta, uusia annostusmuotoja ja uusia säiliöjärjestelmiä. Tämän ohjelman puitteissa sitoudumme teollisuuden kanssa uuden teknologian kehittämisprosessin alkuvaiheessa ja keskustelemme ennakoiduista sääntelyyn tai tieteellisiin kysymyksiin, jotka voivat olla osa tulevaa sovellusta.
monet yritykset ovat hakeneet kehittyvän teknologian ohjelmaan liittyen kiinnostukseensa jatkuvaan valmistukseen. FDA: n asiakirja nimeltään, kehittyvien teknologiasovellusten edistäminen lääkkeiden valmistuspohjan nykyaikaistamiseksi teollisuuden ohjeet tarjoaa tietoa ja neuvoja siitä, miten työskennellä viraston kanssa kehitysprosessin alkuvaiheessa.
Lue lisää FDA: n pyrkimyksistä modernisoida lääkevalmistusta FDA: n Voice-blogista.