ensimmäinen biologinen lääke, humanisoitu insuliini (5,8 kDa), tuli saataville vuonna 1982 biotekniikan tulon jälkeen, ja se merkitsi uutta aikakautta lääketeollisuudessa. Biotekniikan nykyaikaiset edistysaskeleet mahdollistavat biologisten aineiden laajamittaisen syntetisoinnin enemmän tai vähemmän kustannustehokkaalla tavalla. Biologiset aineet, jotka ovat aikoinaan aloittaneet suurilla peptideillä ja rekombinanttiproteiineilla, sisältävät nykyään laajan joukon muita kokonaisuuksia, kuten vasta-aineita, monoklonaalisia vasta-aineita ja viime aikoina nanorakenteita ja niihin liittyviä esineitä, liukoisia reseptoreita, yhdistelmä-DNA: ta, vasta-aine-lääkekonjugaatteja (ADCS), fuusioproteiineja, immunoterapeutteja ja synteettisiä rokotteita.
biologisten lääkkeiden ”nouseva tähti” on kerännyt yhä enemmän huomiota lääkealan ammattilaisilta ja alan analyytikoilta, koska tämä vaihtoehtoinen lääkekehityksen paradigma on merkittävä liiketoimintahaaste perinteisemmälle pienimolekyyliselle lääkekehityksen paradigmalle, joka määrittelee lääketeollisuuden yli sadan vuoden ajan.
herää siis kysymys: ovatko pienet molekyylit menettämässä ”vetovoimansa” huumeiden löytämisen tutkimuskohteina biologisten edistysaskelten nykymaailmassa? Jotkut asiantuntijat ovat edelleen optimistisia pienten molekyylien mahdollisuuksista johtaa kilpailua tulevissa lääkeputkistoissa, toiset näkevät, että ”raha vaihtaa taskuja”, ja pienten molekyylien tutkimusta laiminlyödään yhä enemmän osakkeenomistajien ja sijoittajien keskuudessa biologiikan hyväksi.
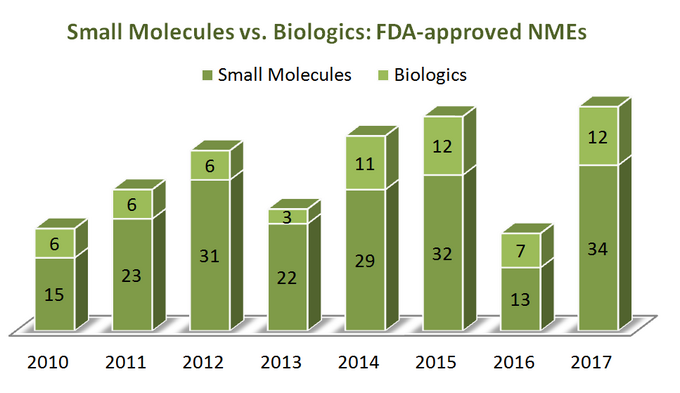
selvittääksemme, mihin ala on menossa, aloitetaan ensin hieman tilastoista. Aikana 7 vuotta (2010-2017) U. S. Food and Drug Administration (FDA) hyväksyi yhteensä 262 uutta molekyyliyksikköä (NMES), pois lukien useita diagnostisia kuvantamisaineita ja 1 insuliinianalogi (ref). Näyttää siltä, että 76% niistä on pieniä molekyylejä (199) ja vain neljännes on biologisia. Mielenkiintoista on, että biologisten lääkkeiden NMES-hyväksymisissä ei ole selvää kasvua suhteessa pieniin molekyyleihin, koska molemmat terapialuokat ovat trendejä melko samalla tavalla, kuten alla olevasta kaaviosta käy ilmi. Koska biologiset tuotteet hinnoitellaan kuitenkin hyvin eri tavalla kuin pienet molekyylit (ne ovat paljon kalliimpia), Kuva on erilainen, kun tarkastellaan kokonaismyynnin ja liikevaihdon kasvua: vuosien 2011 ja 2017 välisenä aikana biologisten myyntitulot ovat kasvaneet 70% saavuttaen 232 miljardia dollaria. Biologisten lääkkeiden osuus lääkkeiden kokonaismarkkinoista kasvoi vuoden 2006 16 prosentista 25 prosenttiin vuonna 2016, eikä kasvun hidastumisesta ollut merkkejä (ref).
vaikka biologialla on eri tavoin erottuvia etuja pieniin molekyyleihin nähden (esimerkiksi niiden syvällinen selektiivisyys), asiat eivät ole ”mustavalkoisia” verrattaessa näitä kahta terapeutiikan luokkaa niiden ominaisuuksien perusteella, koska molemmilla on merkittäviä etuja ja haittoja, jotka on otettava huomioon strategisessa päätöksenteossa. Siksi tuntuu hieman valitettavalta nähdä, kuinka monet raportit sivuuttivat tekstiviestit verrattuna biologisiin tutkimuksiin pyrkiessään” tuoreuteen ” näkemyksissään.
alla olevassa taulukossa on yhteenveto molempien kategorioiden vahvoista ja heikoista puolista (viite, Viite), jotka kuvaavat molempien ”leirien” haasteita ja mahdollisuuksia (Huom. värit: harmaa — ei selvää etua kummassakaan leirissä; vihreä — edullinen tilanne; keltainen — epäedullinen tilanne):
pienet molekyylit |
|
|---|---|
|
yleiset ominaisuudet |
|
|
pienet molekyylipainot (0,1 – 1 kDa); yleensä kemiallisesti ja termisesti stabiili, laaja polaarisuus. |
hyvin suuret molekyylipainot >1 kDa; yleensä polaarinen, herkkä lämmölle, helposti hajoava (lukuun ottamatta joitakin pitkäikäisiä tyyppejä kuten monoklonaalisia vasta-aineita) |
|
selektiivisyys, turvallisuus |
|
|
melko irtosuhteita, yleensä sitoutuvat eri off-kohde sivustoja, tekee sivuvaikutuksia tai myrkyllisyys. lopulta biologisten kehittäjien on ollut helpompi saada patentteja, koska alalla ei ole juuri tai ei lainkaan huipputeknologiaa, kun nykyiset myyntihittejä löydettiin. |
erittäin spesifinen kohteille, yleensä pienempi toksisuus (yksi merkittävä poikkeus on immunogeenisuus, joka voi vaikuttaa vakavasti biologisten aineiden tehokkuuteen, turvallisuuteen ja jakautumiseen). |
|
Soluläpäisevyys |
|
|
SMs sitoo kohteita, kuten G-proteiinikytkettyjä reseptoreita (gpcrs), ligandi-aidattuja ionikanavia ja reseptorityrosiinikinaaseja on solunulkoiset tai solunsisäiset verkkotunnukset. Ne voivat päästä solunsisäisiin alueisiin, sytosoleihin, ytimiin ja jopa CNS-kohteisiin, jotka erottaa tiukka veri-aivoeste (BBB). |
suuri osa farmakologisista kohteista on sulautuneita, eivätkä biologit siten pääse niihin käsiksi. Erityisesti, kun se tulee keskushermostoon (CNS), läsnäolo veri-aivoeste on merkittävä este tiellä tahansa molekyylien suurempi kuin 600 Da rajoittaa jopa 98% SMs ja käytännössä kaikki biologiset. |
|
Delivery |
|
|
kuuluu suurelta osin ”viiden säännön” oraaliseen imeytymiseen, jolloin se soveltuu oraaliseen annosteluun. Edelleen läpäisevyys suoliston epiteelin kautta välittyy pääasiassa passiivisen diffuusion ja paraselluliikenteen yhdistelmänä. |
luontainen epävakaus ja suuret molekyylimassat tekevät lähes kaikki biologiset aineet oraalisesti inaktiivisiksi. Enimmäkseen invasiivisia toimituksia tai vaihtoehtoisia ei-invasiivisia tekniikoita. |
|
Jakelu |
|
|
tekstiviestit jakautuvat verenkierron kautta, mikä mahdollistaa pick-pitoisuuksien saavuttamisen nopeasti. |
suuremmilla molekyyleillä (esim. >10 kDa) hitaampi (100-500 kertaa) imunestejärjestelmä dominoi jakautumista. Suurempi biologics jakaa kautta sekä veren ja imunestejärjestelmän liikkuvat konvektiivinen kuljetus, reseptorivälitteinen endosytoosi, fagosytoosi, ja pinosytoosi. Tämän seurauksena suuremmilla biologeilla on pidempi puoliintumisaika, rajoitettu jakautumistilavuus ja ne tarvitsevat enemmän aikaa huippupitoisuuksien saavuttamiseen verrattuna SMs: ään. |
|
Disposition (metabolia) |
|
|
useimmat tekstiviestit hävitetään ei-kohdennettujen elinten kautta — sytokromin tai muiden kuin sytokromimetabolioiden, munuaisfiltraation tai ulosteen erittymisen kautta. |
biologeilla on tiiviimmät interaktiot kohteiden kanssa, joten niiden sitoutuminen (reseptorivälitteinen lääkeainekäsittely) vaikuttaa suoraan niiden määritykseen, mukaan lukien proteaasien ja peptidaasin aiheuttama biologisten aineiden puhdistuma. |
|
Lääkkeiden yhteisvaikutukset |
|
|
tekstiviestit ovat alttiita lääkkeiden yhteisvaikutuksille, joita voi esiintyä niiden kuljetukseen, metaboliaan, kuljetukseen tai eliminaatioreitteihin vaikuttavien samanaikaisten lääkkeiden vuoksi. |
biologit eivät ole yhtä alttiita perinteisille lääkkeiden yhteisvaikutuksille, koska ne metaboloituvat ja eliminoituvat endogeenisina substraatteina. Lääkeaineita metaboloivissa entsyymeissä on kuitenkin dokumentoituja sytokiinivälitteisiä muutoksia, joten lääkeainebiologiset yhteisvaikutukset on arvioitava siinä tapauksessa, että lääke saattaa vaikuttaa metabolisten entsyymien ilmentymiseen. |
|
Business aspects |
|
|
SM-lääkkeiden alhaiset hinnat. |
tyypillisesti biologisten hoitojen hinnat ovat erittäin korkeat. Tätä pidetään yhtenä syynä siihen, että biologiset lääkkeet näyttävät tuottavan parempaa taloudellista kokonaistuottoa kuin SMs. |
|
Korkea poistumisaste (KMR-ryhmän vuonna 2009 tekemä tutkimus osoitti, että vain 7,1% prekliiniseen testaukseen tulleista tekstiviesteistä päätyi lopulta markkinoille). |
suhteellisen alhainen nuokkumisaste (saman kmr-ryhmän tutkimuksen mukaan 24, 4% prekliinisistä vaihebiologeista säilyi hengissä markkinavaiheeseen asti). |
|
Severe competition from chemical generics after patents expiration. |
Biologics developers face less severe competition from biosimilars, after patents expiration. |
|
Simpler drug discovery/development process. |
More expensive and complex drug discovery and development process, compared to biologics. |
kunkin muodon paikallinen Dominointi sopivammilla terapeuttisilla alueilla, käyttötapaukset jne.
lisäksi alla on luettelo useista teollisuuden ajureista, jotka pelaavat pienten molekyylien puolella ja saattavat vaikuttaa voimatasapainoon lääkemarkkinoilla kemiallisten lähtökohtien hyväksi:
The rise of artificial intelligence (AI) in drug discovery
syväoppimisalgoritmien läpimurron (2012) jälkeen ja viime aikoina generatiivisten kontradiktoristen verkostojen (GANs) luomisen jälkeen, jotka pystyvät menestymään useissa tutkimustehtävissä, kiinnostus eri TEKOÄLYTEKNOLOGIOITA kohtaan on noussut pilviin melko paljon.jokaisella alalla. Monista tekoälyä hyödyntävistä työkaluista on tullut nopeasti kaupallista valtavirtaa, kuten chatboteista, henkilökohtaisista avustajista, autopiloteista jne.– joka on todellinen todiste tekoälyn toteutettavuudesta.
Drug discovery ei ole poikkeus tähän ”TEKOÄLYVETOISEEN trendiin”, ja niiden startupien määrä, jotka yrittävät soveltaa tekoälyä huumeiden löytämisen tehostamiseen eri tavoin, on kasvanut huomattavasti vain muutaman vuoden aikana ja saavuttanut tähän mennessä yli sata aktiivista yritystä (tässä lista niistä).
mielenkiintoista on, että suurin osa TEKOÄLYVETOISISTA startupeista keskittyy biologian sijaan pienten molekyylien huumelöytöihin, mikä ei liene yllättävää. Historiallisesti pienimolekyyliterapeutiikassa käytettiin ensisijaisesti myös ei-AI-laskennallisia menetelmiä (keminformatiikkaa) niiden huomattavasti yksinkertaisempien molekyylirakenteiden ja vuorovaikutusmallien vuoksi.
alla olevassa kaaviossa on arvioitu tilastotiedot 61: stä aktiivisesti markkinoidusta huumelöydöstä, jotka kehittävät tai soveltavat erikoistuneita TEKOÄLYTYÖKALUJA tutkimustyössään. Kuten näette, puolet kaikista yrityksistä (51%, 31 startup-yritystä) keskittyy pieniin molekyyleihin, kun taas vain 23% (14 startup-yritystä) osallistuu biologisten lääkkeiden (vasta-aineet, rokotteet jne.) löytämiseen/kehittämiseen. Epäsuhtaa pieniin molekyyleihin kuvaa hyvin myös riskipääomarahoituksen määrä, jonka keräsivät yhdessä 61 tarkistettua TEKOÄLYLÄHTÖISTÄ startupia (vain julkistetut kierrokset) — joissa 770 miljoonaa sijoitettiin pieniin molekyyleihin osallistuviin yrityksiin ja vain hieman yli 200 miljoonaa osoitettiin biologiikkaan keskittyville startupeille — kuten alla on esitetty.
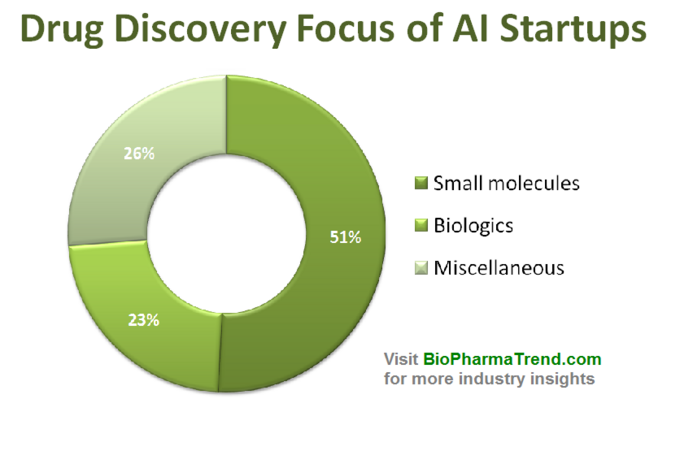
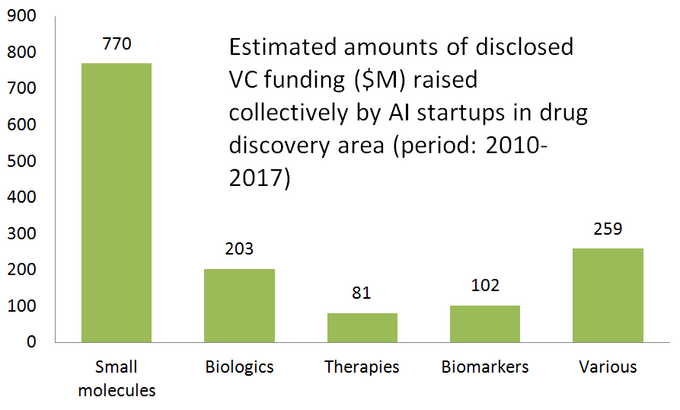
Tämä tilanne viittaa siihen, että TEKOÄLYALGORITMIEN viimeaikaiset edistysaskeleet ja suuntaus soveltaa koneoppimista varhaisen vaiheen lääketutkimukseen ovat omiaan lisäämään pienimolekyylisten lääkkeiden löytämistä verrattuna biologisten lääkkeiden löytämiseen — ainakin toistaiseksi. Tämä saattaa johtaa uusiin investointeihin pienissä molekyylipainotteisissa hankkeissa, joita tekoälyyn perustuva teknologia tukee.
sellaisten tärkeiden tavoitteiden kuin esimerkiksi proteiini-proteiini-interaktioiden (PPI) saavuttaminen on perinteisesti ollut biologisten aineiden (mAbs) vallassa potentiaalisina toimijoina, kun taas pieniä molekyylejä oli pitkään pidetty tässä tapauksessa sopimattomina niiden pienen koon vuoksi.
farmakogenomiikan edistyessä tilanne voi muuttua melko nopeasti maravirokin (514 Da) ja tirofibaanin (441 Da) hyväksymisien jälkeen. Laskennallisesti kävi ilmi, että SMs: llä voi itse asiassa olla suhteellisen suuri affiniteetti proteiinien tiettyihin rajapintoihin ja, mikä tärkeintä, ne voivat moduloida ”luonnostaan häiriintyneitä proteiinialueita”, jotka liittyvät monimutkaisiin järjestelmäsairauksiin. Tässä on yksi mielenkiintoinen kattaa tämän aiheen yhteenveto joitakin tärkeitä oivalluksia PPI koneiden saatu viime vuosikymmeninä.
toinen nopeasti kasvava pienimolekyylisten lääkeaineiden löytöalue on ribonukleiinihapon (RNA) kohdentaminen. Aihe listattiin ”Top 7 Trends in Pharmaceutical Research in 2018” – julkaisussa, ja aiheesta tehtiin myös yksityiskohtainen katsaus Cell Chemical Biology and a nice industry cover up-julkaisussa C&EN.
toista tuoretta ajatusta pienten molekyylien voiman vapauttamisesta käsiteltiin tuoreessa C&EN-lehdessä vuonna 2018 julkaistussa artikkelissa ”Targeted protein degraders are redefining how small molecules look and act”. Strategiana tässä on kehittää bifunktionaalisia pieniä molekyylejä, jotka pystyvät reitittämään kohdennetun proteiinin kokonaan proteasomiin, solun roskien poistokoneeseen, sen sijaan että vain estäisivät proteiinin toimintaa kuten ”perinteisessä” lähestymistavassa.
seulontateknologioiden rajoitusten voittaminen
pienten molekyylien tutkimuspotentiaalia ei ole vielä saavutettu johtuen erilaisista teknologisista rajoituksista seulontamenetelmissä, joita käytetään huumeiden etsintäohjelmien lähtökohtien tunnistamiseen.
yksi tällainen esimerkki on fenotyyppinen seulontatapa, joka on nykyään renessanssin vallassa useiden teknologisten edistysaskelten ansiosta, mukaan lukien lisääntyvä kyky kehittää fysiologisesti merkityksellisiä solumalleja, lukemia ja kehittyneitä tunnistustekniikoita, jotka auttavat paljastamaan vaikutusmekanismeja (Moa) tehokkaammin ja minimoivat epävarmuuden. Toisaalta laajamittaisten profilointitekniikoiden ja laskennallisten menetelmien toteuttaminen tarjoaa uudenlaisen tason systeemianalyysille ja pienimolekyylisten fenotyyppien ymmärtämiselle.
toinen lupaava seulontaparadigma on DNA-koodattujen kirjastojen (DELs) kautta. Ainutlaatuisen järjestelynsä ansiosta DEL-teknologia tarjoaa sopivan tavan testata satoja miljoonia ja jopa miljardeja uusia molekyylejä kohdepohjaisissa huumeiden löytöohjelmissa. Vaikka tämä tekniikka ei ole vailla haasteita (esim.rajoitukset DNA-yhteensopiva kemia, epävarmuus seulonta osumia, jne), alue kasvaa nopeasti ja pidetään jopa ”vallankumouksellinen” pienimolekyylisten huumeiden löytö.
syntetisoitavuuden esteen voittaminen
yksi varhaisen vaiheen pienmolekyylilääkkeen löytämisen kompastuskivistä on synteettisesti saavutettavan kemiallisen tilan rajoittaminen-vaikka paljon lupaavia kemiallisia ideoita voidaan tuottaa laskennallisesti tai muuten, on aina olemassa riski, että koko yhdisteiden syntetisointi tällaisten ideoiden validoimiseksi olisi kallista tai jopa mahdotonta.
tällä alalla on viime aikoina edistytty, jälleen, käyttäen TEKOÄLYPOHJAISTA ohjelmistoa, joka tarjoaa ihmistason synteesisuunnittelun suorituskykyä. Esimerkiksi BenevolentAI julkaisi äskettäin Nature-lehdessä artikkelin, jossa hän kuvaili, kuinka he käyttivät syviä neuroverkkoja yhdessä nykyaikaisten puunhakualgoritmien kanssa suunnitellakseen uusien molekyylien synteesiä, jolla oli huomattava onnistumisnopeus ja nopeus.
Derek Lowe julkaisi täällä ja täällä useita mielenkiintoisia covereita runsaine kommentaareineen, jotka tarjosivat hieman enemmän tietoa tästä orgaanisen ja lääketieteellisen kemian kiehtovasta alueesta.
empiirisemmän strategian kehitti kemiantuottaja Enamiini, jota kutsutaan REAALIKEMIALLISEKSI avaruudeksi ja johon kuuluu nykyisin yli 3.8 miljardia synteettisesti saatavilla ja haettavissa molekyylejä osuma etsintä ja muut lääketieteellisen kemian tehtäviä. Käsite kiteytyy siihen, että yrityksen sisäisiä validoituja kemiallisia reittejä (yli 100 reaktiota) sovelletaan omaan varastoon (yli 100 tuhatta yhdistettä) saatavaan suureen kemiallisten rakennuspalikoiden joukkoon.tavoitteena on yhdistää ne kombinatorisesti, jotta saadaan aikaan kasadi suurempia ”lyijymäisiä” tai ”huumemaisia” molekyylejä. Kun tietty toistettavuus ja saanto on saavutettu riittävän suuressa koesarjassa (vähintään 80%), suoritetaan Uusi laskennallinen laskenta laajemman kemiallisen tilan muodostamiseksi kokeellisesti validoitujen tapausten perusteella.
New r&d markets and role for small molecules
kaiken kaikkiaan pienten molekyylien putkistojen koko ja kasvupotentiaali voidaan sivuuttaa tai ymmärtää väärin, kuten Interphexin paneelikeskustelussa mainittiin. Tällä hetkellä noin 8000 pientä molekyyliä on aktiivinen R&D, Mikä on 25%: n kasvu parin viime vuoden aikana. Edellä luetellut kasvun ajurit voivat johtaa edelleen kiihtyneeseen kasvuun tällä alalla.
on myös tärkeää huomata, että pienimolekyylisillä lääkkeillä voi olla tärkeä rooli joissakin seuraavan sukupolven lääkkeissä, jolloin ne ovat riippuvaisia pienimolekyylisistä putkistoista. Esimerkiksi kantasoluhoidossa pienet molekyylit voivat laukaista terapeuttisia reaktioita.
kuten Milliporesigman Jeffrey Shumway korosti cphi: n aikana Pohjois-Amerikassa, pienimolekyylituotteet ovat muuttumassa monimutkaisemmiksi muuttaen niiden roolia (bio -) lääketeollisuudessa.
pienten molekyylien tulevaisuuden alue on vasta-aine-lääkekonjugaatit ja niihin liittyvät oliot, jotka nousivat lupaavaksi terapeutiikan luokaksi kahden lääkkeen löytöparadigman ja useiden teknologisten suuntausten luonnollisen lähentymisen ansiosta.
Vastuuvapauslauseke: tiedot on tarkoitettu vain yleiseen tietoisuuteen, eivätkä ne ole minkäänlaista oikeudellista/taloudellista/osakekauppaa / lääketieteellistä neuvontaa. Luet sen omasta tahdostasi ja näiden tietojen käyttö on omalla vastuullasi. Se on sinun vastuullasi arvioida hyödyllisyyttä ja turvallisuutta tietoja tässä viestissä, ja Internet yleensä, ja miten se soveltuu omaan tilanteeseen ja sitten kuulla asiaankuuluvia asiantuntijoita ammatillinen neuvoja tarvittaessa.
aihealueet: toimialan trendit