Storia

Il chimico francese Louis Claude Cadet de Gassicourt isolò per caso il primo composto organometallico, la tetrametildiarsina, alias cacodil, nel 1757. Stava sperimentando con inchiostri invisibili combinando arsenico contenente minerale di cobalto con acetato di potassio. L’arsenico stesso non è un vero metallo, piuttosto è considerato un metalloide, tuttavia è ancora considerato un composto organometallico.
Il primo composto organometallico contenente un metallo di transizione fu formato 67 anni dopo dal chimico organico danese William Christopher Zeise ponendo il tetracloruro di platino in etanolo bollente. Lo resulting risultante formato era tricloro-(etene) – platinato (II) anione. Quando combinato con un contro ion di potassio, si forma il sale di Zeise. Il composto ha attirato molte critiche ai suoi tempi dai colleghi di Zeise sulla sua struttura attuale. Un problema che non è stato risolto fino a quando la cristallografia a raggi X è diventata disponibile nel 20 ° secolo. Il sale di Zeise ha dato il via a un interesse per i composti organometallici anche se il chimico del 19 ° secolo non sapeva esattamente perché o come si formano questi composti. Composti come il dietil zinco e il tertracabonil nichel estremamente tossico si formarono nella seconda metà del 19 ° secolo. Con il primo, sintetizzato dal chimico britannico Ludwig Mond, avviando un’intera nuova classe di composti chiamati carbonilici metallici.
A cavallo del 20 ° secolo il chimico francese Victor Grignard scoprì un nuovo metodo di accoppiamento del carbonio al gruppo carbonilico di un chetone / aldeide mediante aggiunta nucleofila utilizzando un alogenuro alchilico/arilico accoppiato al metallo di magnesio. Il rivoluzionario reagente organometallico di Grignard, che ora porta il suo nome, ha attraversato i laboratori di chimica del primo 20 ° secolo e ha ricevuto il Premio Nobel per la chimica 1912 in aggiunta a Paul Sabatier. Oltre cento anni dopo è ancora ampiamente utilizzato come reagente di accoppiamento a una varietà di derivati carbonilici.

L’anno successivo, nel 1913, il Nobel per la chimica andò al chimico inorganico svizzero Alfred Werner per il suo lavoro sulla chimica di coordinazione dei ligandi ai metalli. In particolare la struttura del cloruro di hexaminecolbalt (III). Il lavoro di Werner nella chimica di coordinazione si è rivelato vitale nella comprensione della coordinazione organometallica e delle reazioni chimiche dei composti e ha contribuito notevolmente ad aprire la disciplina organometallica.Sebbene molti nuovi composti organometallici fossero stati creati e utilizzati, la chimica organometallica non era ancora riconosciuta come una propria sottodisciplina indipendente della chimica fino a metà del xx secolo e alla scoperta del ferrocene nel 1951.
Il ferrocene è stato creato nel 1951 dai chimici americani Peter Pauson e Tom Kealy facendo reagire il bromuro di magnesio ciclopentadiene e il cloruro ferrico insieme, risultando in una polvere arancione ora conosciuta come ferrocene. Sfortunatamente per i due chimici non hanno dedotto la struttura effettiva del loro sale organometallico e hanno erroneamente proposto che il ferro fungesse da ponte tra il primo carbonio di due molecole di ciclopentadiene. Più tardi, il chimico inglese Sir Geoffrey Wilkerson, in collaborazione con il chimico americano Robert Woodward, capì che il ferro nel ferrocene era effettivamente inserito tra due molecole di ciclopentadiene. Nel ferrocene, ogni ciclopentadiene raggiunge l’aromaticità e tutti i 12 elettroni si legano covalentemente con gli atomi di ferro disponibili sigma e pi orbitali creando una molecola contenente 18 elettroni molto stabile. Indipendentemente, anche il chimico tedesco Ernst Fischer arrivò alle stesse conclusioni del modello sandwich per il ferrocene. Fisher si rese conto che questo composto sandwich non era il risultato del metallo utilizzato, ma piuttosto il modo in cui si verificava la coordinazione dell’interazione tra il legante ciclopentadiene e il metallo. Fisher poi ampliato i composti metallocenici per includere altri metalli. Insieme, Wilkerson e Fisher hanno condiviso il premio Nobel per la Chimica 1973 per il loro rispettivo lavoro con i metalloceni.
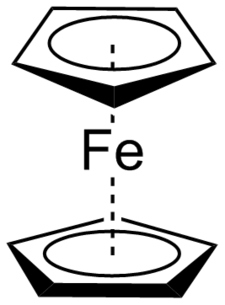
La scoperta e la comprensione dei metalloceni ha ufficialmente portato la chimica organometallica alla propria sotto-disciplina della chimica. In tal modo, ha aperto un’esplosione di nuove idee su come utilizzare composti organometallici. Sebbene un uso si sia distinto dal resto, quello di utilizzare composti organometallici come catalizzatori nelle reazioni. Un composto organometallico catalitico precoce, dicloruro diciclopentadiene zircon (IV) è stato creato congiuntamente dal chimico Karl Ziegler e Giulio Natta per polimerizzare le olefine terminali. Ciò ha portato a due intere classi di catalizzatori organometallici, ora noti come catalizzatori Ziegler-Natta e ha guadagnato ciascuno un premio Nobel per la Chimica nel 1963. Armati di nuovi catalizzatori organometallici, i chimici del tardo 20 ° secolo hanno progettato nuovi modi per accoppiare i carboni insieme. Questi includono la famosa reazione Heck, l’epossidazione Sharpless e la metatesi delle olefine di Grubbs. Ognuno dei quali ha guadagnato un Premio Nobel per la chimica nel 2010, 2001 e 2005 rispettivamente.
- Pfennig, B. W. (2015). Principi di Chimica inorganica (pp. 627-628). Hoboken, NJ: John Wiley & Sons, Inc.
- Seyferth, D. (2001). Il liquido arsenicale fumante di Cadet e i composti cacodilici di Bunsen. Organometallici, 1488-1498. doi:10.1021/om0101947
- Hunt, L. B. (1984). I primi composti organometallici. Metalli di platino Rev, 28(2), 76-83.
- Hodson, D. (1987). “Victor Grignard (1871-1935)”. Chimica in Gran Bretagna. 23: 141–2.
- Hunt, L. B. (1984). I primi composti organometallici. Metalli di platino Rev, 28(2), 76-83.
- Werner, H (2012). “At Least 60 Years of Ferrocene: The Discovery and Rediscovery of the Sandwich Complexes”. Angew. Chimica. Int. Ed. 51: 6052–6058. doi:10.1002 / anie.201201598.
- Pfennig, B. W. (2015). Principi di Chimica inorganica (pp. 627-628). Hoboken, NJ: John Wiley & Sons, Inc.