Gli oli biologici sono diversi dagli oli di petrolio (gasolio” normale”) in struttura molecolare e proprietà.

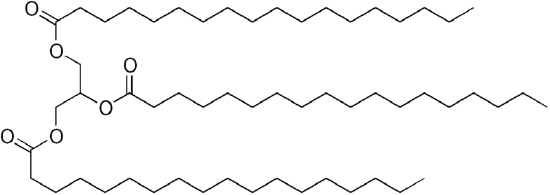
Comune di petrolio, il gasolio è un mixure di idrocarburi semplici, con una media di formula chimica C12H23 (mostrato di seguito) ma i componenti possono variare da circa C10H20 (dodecano) per C15H28(pentadecane). Al contrario, gli oli biologici sono “trigliceridi” (classificati come “esteri”) come il gliceril trilinoleato mostrato di seguito:
| C12H23, dodecano | Un trigliceride: glyceryl trilinoleate |
a Causa delle loro grandi dimensioni e le conseguenti grandi attrazioni intermolecolari, la viscosità degli olii biologici è generalmente troppo elevati per l’uso convenzionale di motori diesel. Anche gli oli biologici bruciano un po ‘ meno facilmente e con una fiamma più sootier del gasolio. Gli oli biologici possono essere utilizzati nei motori diesel convenzionali se vengono preriscaldati per ridurre la loro viscosità, ma ciò richiede un riscaldatore elettrico ausiliario fino a quando il motore non si riscalda. Per questi resons, gli oli bilogici richiedono la lavorazione per l’uso come biodiesel.
Un olio biologico è un estere, che è un tipo di composto organico avente il legame atomico mostrato di seguito.
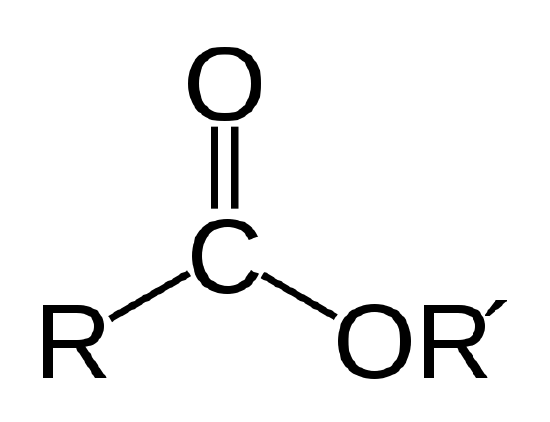 Il legame estere. R e R’ rappresentano catene di atomi di carbonio e idrogeno. R = CH3 e R’ = -C18H35O2 per il stearato di metile nell’Esempio 1 |
glicerolo |
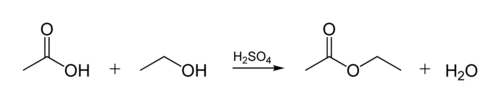
Il legame estere in olii biologici viene creato quando una molecola di glicerina reagisce con acidi organici. La molecola di glicerolo ha una catena di 3 atomi di carbonio, ciascuno con un gruppo-OH (alcol) su di esso. La figura seguente mostra come un alcol organico reagisce con un acido organico. I chimici organici abbreviano le strutture molecolari – le linee “zig-zag” nella figura rappresentano catene di carbonio con un atomo di C ad ogni “zig”o ” zag”. Ogni carbonio ha 4 legami, e se vengono mostrati meno di 4, si presume che vadano agli atomi H. In modo che l’alcol è C2H5OH (etanolo), e l’acido acetico è un acido (o ethanoic acido CH3COOH) in Figura:
Dal glicerolo 3 -OH gruppi, 3 a lunga catena biologica “acidi grassi” allega per fare il voluminoso “trigliceridi”.
Ma con la stessa facilità con cui gli esteri possono essere fatti da alcoli e acidi, possono cambiare alcoli o acidi. In presenza di un forte catalizzatore di base, come NaOH, un trigliceride può reagire con 3 piccole molecole di alcol, come il metanolo (CH3OH), che sostituiscono il glicerolo “spina dorsale”, rendendo 3 esteri separati di peso molecolare inferiore
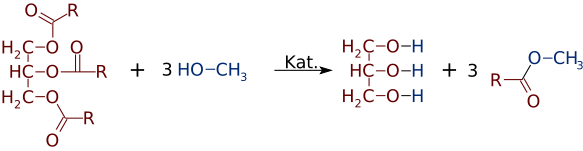
Molto spesso si forma una miscela di due o più prodotti. Ad esempio, quando un olio vegetale reagisce con il metanolo, solo uno o due degli acidi possono essere spostati dalla glicerina, producendo solo 1 o 2 FAMEs.
C3H5(C18H35O2)3 + NaOH + 2 CH3OH → C3H5(C18H35O2)2(OH) + 2 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 1 CH3OH → C3H5(C18H35O2)(OH)2 + 1 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 3 CH3OH → C3H5(OH)3 + 3 C17H35COOCH3
di Solito, un grande eccesso di metanolo di idrossido di sodio e sono aggiunti, in modo che la reazione produce la massima quantità di FAME.
Ma nel caso di una transesterificazione, anche se nessuno dei reagenti è completamente consumato, non si verifica un ulteriore aumento delle quantità dei prodotti. Diciamo che una tale reazione non va a compimento. Quando viene prodotta una miscela di prodotti o una reazione non va a completamento, l’efficacia della reazione viene solitamente valutata in termini di resa percentuale del prodotto desiderato. Una resa teorica è calcolata assumendo che tutto il reagente limitante sia convertito in prodotto. La massa di prodotto determinata sperimentalmente viene quindi confrontata con la resa teorica ed espressa in percentuale:

ESEMPIO 1 Quando 100,0 g C3H5 (C18H35O2) 3 gas e 15,0 g CH3OH vengono miscelati a 55°C con catalizzatore NaOH, reagiscono per formare 90,96 g C17H35COOCH3 metil stearato biodiesel. Calcola il rendimento percentuale.
Soluzione Dobbiamo calcolare la resa teorica di NH3, e per fare questo, dobbiamo prima scoprire se N2 o H2 è il reagente limitante. Per l’equilibrato equazione
C3H5(C18H35O2)3 + NaOH + 3 CH3OH → C3H5(OH)3 + 3 C17H35COOCH3 stearina + idrossido di sodio + 3 CH3OH → glicerolo + 3 dello stearato di metile
Il rapporto stechiometrico dei reagenti è
 Ora, iniziale importi dei due reagenti areand
Ora, iniziale importi dei due reagenti areand  Il rapporto iniziale di importo non è così
Il rapporto iniziale di importo non è così Poiché questo rapporto è inferiore
Poiché questo rapporto è inferiore  c’è un eccesso di CH3OH. La stearina è il reagente limitante. Di conseguenza dobbiamo usare 0.1122 mol stearina e 0.3366 mol CH3OH (piuttosto che 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have
c’è un eccesso di CH3OH. La stearina è il reagente limitante. Di conseguenza dobbiamo usare 0.1122 mol stearina e 0.3366 mol CH3OH (piuttosto che 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have so that
so that We can organize these calculations in a table:
We can organize these calculations in a table:
| C3H5(C18H35O2)3(s) | + 3 CH3OH (l) | → 1 C3H5(OH)3 (l) | + 3 C18H35O2)3CH3(s) | ||
|---|---|---|---|---|---|
| m, g | 100.0 g | 15.00 g | 90.96 g | ||
| M, g/mol | 891.5 | 32.04 | 298.5 | 92.1 | |
| n present, mol | 0.1122 mol | 0.4682 mol | |||
| n actual, mol | 0.1122 | 0.3366 | 0.1122 | 0.3366 | |
| m actual, mass | 100.0 | 10.78 | 10.33 | 100.47 |
The percent yield is then
Transesterification is a classic example of a reaction which does not go to completion.