INTRODUZIONE
L’ematoma intramurale aortico (IMH) è una delle diverse condizioni incluse nella sindrome aortica acuta (AAS).1,2 In termini morfologici è caratterizzato da emorragia nello strato mediale della parete aortica in assenza di una lacrima intimale-mediale, il che significa che non c’è comunicazione con il lume aortico. Alcuni autori hanno suggerito che l’IMH è il risultato della rottura spontanea del vasa vasorum aortico. La frequenza di IMH nei pazienti con AAS clinicamente sospettata varia dal 5% al 20% dei casi.2-4
Come è il caso simile alla dissezione aortica classica, IMH si distingue in due tipi secondo la classificazione di Stanford: tipo A, quando c’è coinvolgimento dell’aorta ascendente, e tipo B, quando l’aorta ascendente non è interessata.
È attualmente accettato che il trattamento per IMH di tipo A sia essenzialmente chirurgico, mentre il tipo B può essere inizialmente trattato con terapia medica, riservando un intervento chirurgico o il posizionamento dello stent per i casi con complicazioni aggiunte. La mortalità associata all’IMH nei primi mesi non è trascurabile; i principali fattori predittivi indipendenti per la morte sono il diametro aortico >50 mm e il coinvolgimento dell’aorta ascendente.5
Sussistono ancora alcune incertezze sulla storia naturale di questa malattia e sul trattamento più appropriato per i pazienti affetti. Classicamente, si consiglia di evitare l’anticoagulazione nei pazienti con AAS principalmente per due motivi: limitare la progressione dissecante dell’ematoma ed evitare il tamponamento cardiaco nei pazienti con versamento pericardico.
Lo scopo del presente studio è descrivere le caratteristiche cliniche e radiologiche, nonché l’evoluzione di un sottogruppo di pazienti con IMH che hanno ricevuto un trattamento anticoagulante durante il ricovero in ospedale.
METODI
Tutti i pazienti ricoverati nel nostro ospedale con una diagnosi di AAS da gennaio 2000 a dicembre 2005 sono stati valutati prospetticamente. Tra questi pazienti, abbiamo selezionato tutti coloro che avevano un IMH e avevano ricevuto un trattamento anticoagulante durante il ricovero in ospedale. Sono state compilate informazioni demografiche e dati clinici, radiologici e di follow-up.
La diagnosi di AAS è stata stabilita mediante scansione tomografica computerizzata (CT) con e senza miglioramento del contrasto. I successivi studi di imaging di follow-up sono stati effettuati con TC e / o risonanza magnetica (RM).
Tutti i pazienti studiati hanno ricevuto un trattamento medico diretto verso uno stretto controllo della pressione arteriosa (BP ≤120/80 mm Hg), che includeva beta-bloccanti in tutti i casi, tranne quando c’erano controindicazioni per questo trattamento.
RISULTATI
Durante il periodo di studio, 95 pazienti con una diagnosi di AAS sono stati ammessi nel nostro centro. Dodici (25.6%) di questi pazienti presentavano IMH (4 tipo A e 8 tipo B). Tre pazienti con IMH che hanno ricevuto un trattamento anticoagulante durante l’ospedalizzazione (uno con IMH di tipo A e 2 con IMH di tipo B) sono oggetto di questo rapporto.
Le caratteristiche cliniche e le principali informazioni demografiche dei pazienti con IMH che hanno ricevuto anticoagulanti sono descritte di seguito e presentate in Tabella.
Caso 1
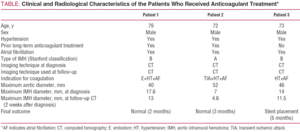
Un uomo di 79 anni con ipertensione scarsamente controllata nonostante il trattamento farmacologico e la fibrillazione atriale cronica. La storia clinica del paziente includeva un episodio di embolia arteriosa nell’arto superiore destro 5 anni prima, che era stato trattato con anticoagulante orale. È stato ricoverato per un intenso dolore di insorgenza improvvisa nella regione interscapolare, che si irradia all’addome ed è stato accompagnato da sudorazione profusa e vertigini. La tomografia computerizzata eseguita nell’unità di emergenza ha identificato un IMH di tipo B che si estendeva dall’origine dell’arteria succlavia sinistra alla biforcazione aortoiliaca e interessava i primi centimetri dell’arteria commonaca comune sinistra (Figura 1). Al momento del ricovero, il paziente è stato trattato con labetalolo e nitroprussiato per perfusione e l’anticoagulazione è stata interrotta. Dopo l’interruzione di questo trattamento, il paziente ha presentato un nuovo episodio di embolia arteriosa nell’arto superiore sinistro che ha richiesto embolectomia. Per questo motivo è stata stabilita l’anticoagulazione, inizialmente con eparina sodica e successivamente con acenocumarolo.
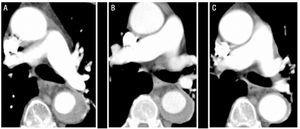
Figura 1.Evoluzione radiologica dell’ematoma intramurale aortico di tipo B (IMH) nel paziente 1. Le fette TC seriali alla biforcazione dell’arteria polmonare mostrano una progressiva diminuzione dello spessore della lesione e della risoluzione finale. A: Spessore di IMH al momento della diagnosi. B: spessore al primo follow-up CT (2 settimane di evoluzione). C: spessore IMH a 2 mesi.
Caso 2
Un uomo di 72 anni con ipertensione di lunga evoluzione sotto trattamento farmacologico e una storia di fibrillazione atriale cronica, per la quale stava ricevendo digossina e acenocumarolo. È venuto al nostro centro per il dolore toracico medio opprimente di insorgenza improvvisa che si irradia alla schiena. La TAC iniziale ha mostrato un IMH di tipo A con coinvolgimento dell’aorta ascendente, dell’arco aortico e dell’aorta discendente fino all’origine dell’arteria mesenterica superiore. L’anticoagulazione è stata interrotta. Durante l’ospedalizzazione, il paziente ha presentato un episodio di perdita di coscienza con emiparesi sinistra, da cui si è ripreso senza sequele. La TC cerebrale non ha mostrato segni di ischemia o emorragie intracraniche; quindi, l’episodio è stato interpretato come un attacco ischemico transitorio di origine embolica. A causa di questa complicanza, il trattamento anticoagulante con eparina sodica in perfusione seguita da acenocumarolo è stato ripreso durante il ricovero.
Caso 3
Un uomo di 73 anni, fumatore, con insufficienza renale cronica e una storia di ipertensione di lunga evoluzione; aveva una fibrillazione atriale cronica e stava ricevendo una terapia antiaggregante piastrinica. Il paziente è venuto al nostro ospedale per un grave dolore interscapolare che si irradia a entrambi i fianchi. La TAC iniziale ha stabilito la diagnosi di ematoma intramurale di tipo B confinato all’aorta toracica discendente. Nel segmento distale dell’ematoma, è stata osservata un’immagine a forma di lacrima (proiezione simile all’ulcera) all’interno dell’ematoma (Figura 2). Sebbene il paziente non avesse mai avuto un episodio di embolia, il trattamento anticoagulante è stato iniziato al momento del ricovero a causa del suo alto profilo di rischio embolico.
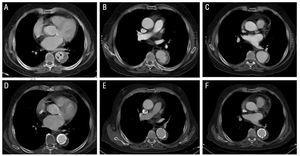
Figura 2. Evoluzione radiologica dell’ematoma intramurale aortico di tipo B (IMH) nel paziente 3. Pannello superiore: immagini alla diagnosi (A) e durante il follow-up (B e C). A: osservare l’immagine a forma di lacrima (proiezione simile all’ulcera) all’interno dell’IMH (frecce). B: dissezione localizzata durante il follow-up (2 mesi dopo). C: dilatazione progressiva del diametro aortico. Pannello inferiore: immagini a 5 mesi dalla diagnosi (D-F). La dilatazione progressiva dell’ematoma impone l’impianto di due stent.
Follow-Up radiologico
Il diametro massimo aortico e il diametro massimo IMH al momento della diagnosi, nonché l’evoluzione della lesione in ciascun paziente sono mostrati nella Tabella.
Durante il follow-up radiologico, tutti i pazienti hanno mostrato una diminuzione graduale dello spessore IMH. Nei pazienti 1 e 2, il diametro massimo dell’IMH al momento della diagnosi era rispettivamente di 17,6 e 7 mm. Allo studio di follow-up CT di 2 settimane i diametri erano rispettivamente di 13 e 4,6 mm.
Nel paziente 3, lo spessore IMH era di 14 mm sulla TC iniziale e di 11,5 mm sulla scansione di follow-up. Inoltre, il paziente ha presentato un’immagine a forma di lacrima all’estremità distale dell’IMH, che ha misurato 4×??6 mm al momento della diagnosi. Alcuni autori hanno interpretato questo come un segno che indica un’ulcera aortica (proiezione simile all’ulcera). Dopo la dimissione ospedaliera, il paziente ha sviluppato una dissezione localizzata con successiva dilatazione progressiva del segmento aortico interessato (pseudoaneurisma) che ha richiesto l’impianto di 2 stent (Excluder 34×??10 mm e 40??×10 mm). L’evoluzione successiva è stata favorevole (Figura 2).
DISCUSSIONE
Durante il periodo di studio studiato, 3 pazienti con IMH hanno ricevuto un trattamento anticoagulante. Anche se l’IMH è una lesione emorragica, l’evoluzione clinica e morfologica è stata favorevole in questo sottogruppo di pazienti, con progressiva regressione della dimensione della lesione nelle valutazioni radiologiche di follow-up, nonostante sia stata somministrata anticoagulazione. Il paziente 3 ha sviluppato una complicazione durante il follow-up in un segmento dell’aorta in cui la lesione iniziale potrebbe essere stata un’ulcera aortica penetrante (PAU). Tuttavia, l’ematoma ha subito inizialmente modifiche simili a quelle osservate negli altri due pazienti, con una graduale diminuzione del diametro durante la fase acuta. Il ruolo che l’anticoagulazione potrebbe aver svolto nella patogenesi e nell’evoluzione di uno pseudoaneurisma è difficile da stabilire.
Non ci sono dati definitivi nella letteratura scientifica riguardanti l’uso di anticoagulanti in pazienti con AAS, sebbene l’interruzione di questo trattamento sia una pratica comune. È probabile che l’anticoagulazione non modifichi il corso naturale di IMH. Tre argomenti supportano questa ipotesi: a) dato che l’emostasi non hanno un ruolo importante nella patogenesi della lesione, è improbabile che si possa avere un impatto sulla sua risoluzione; b) IMH è una condizione confinato all’interno della parete aortica e non è a contatto con il lume del vaso, così è improbabile che l’anticoagulante potrebbe penetrare la lesione; e c) gli studi epidemiologici non hanno mostrato una maggiore incidenza di FILARET in pazienti con congenite o acquisite disturbi dei componenti dell’emostasi.
Concludiamo che in situazioni in cui è necessaria l’anticoagulazione (pazienti ad alto rischio di embolia) questo trattamento può essere mantenuto, sulla base dei risultati di questo studio in cui l’anticoagulazione non sembra avere un impatto sull’evoluzione clinica o morfologica dell’IMH. Naturalmente, sono necessari ulteriori studi con serie di pazienti più ampie per trarre conclusioni definitive.