- Introduzione
- Materiali e metodi
- Materiali vegetali e condizioni di crescita
- Le misurazioni PSI e PSII
- Analisi di spostamento elettrocromico
- Trattamenti fotoinibitori
- Analisi statistica
- Risultati
- Discussione
- Il ruolo della stimolazione CEF in condizioni di scarsa illuminazione
- La variazione del rapporto di ossidazione P700 in condizioni di scarsa illuminazione non è correlata al pmf
- ETRII Controlla il rapporto di ossidazione P700 in condizioni di scarsa luminosità
- Conclusione
- Contributi dell’autore
- Finanziamento
- Dichiarazione sul conflitto di interessi
Introduzione
Sebbene la luce sia la forza trainante della fotosintesi, l’alta luce può causare una significativa fotoinibizione del photosystem II (PSII) per le foglie delle piante che creano ombra (Kitao et al., 2000; Barth et al., 2001; Krause et al., 2004; Huang et al., 2015 ter,2016 ter, c). Tuttavia, photoinhibited PSII recupera rapidamente a bassa luce (He e Chow, 2003; Zhang e Scheller, 2004, Allakhverdiev et al., 2005), a causa del rapido tasso di turnover della proteina D1 (Aro et al., 1993; Zhang e Scheller, 2004; Allakhverdiev et al., 2005). Il tasso di riparazione di PSII è stato ridotto su inibizione della sintesi di ATP via PSI o PSII (Allakhverdiev et al., 2005), indicando che la riparazione rapida di complessi PSII fotodamaged richiede una grande quantità di ATP in breve tempo. Uno studio precedente ha indicato che dopo la fotoinibizione indotta da raffreddamento di PSII, il flusso di elettroni ciclici (CEF) è stato significativamente stimolato durante il recupero a bassa luminosità (Huang et al., 2010). È stato proposto che questa stimolazione di CEF in condizioni di scarsa luminosità migliorasse la sintesi di ATP per la riparazione rapida di PSII (Huang et al., 2010). Tuttavia, sono necessarie ulteriori prove per chiarire il ruolo specifico della stimolazione CEF in condizioni di scarsa illuminazione dopo la fotoinibizione PSII.
Durante il CEF, gli elettroni provenienti da NADPH o ferredossina vengono ciclati attorno a PSI nel pool di plastochinoni. Questo trasferimento di elettroni è accoppiato alla traslocazione di protoni e genera un gradiente di protoni attraverso le membrane tilacoidi (ΔpH) (Shikanai e Yamamoto, 2017). Oltre a contribuire alla sintesi di ATP, un’altra funzione di ΔpH è la down-regulation del trasporto di elettroni fotosintetici acidificando il lume tilacoide (Shikanai, 2014, 2016). Questa regolazione coinvolge due diversi meccanismi: uno è legato alla dissipazione dell’energia termica e dissipa l’energia luminosa assorbita in eccesso come calore dalle antenne PSII (Takahashi et al., 2009), e l’altro è down-regulation dell’attività complessa Cyt b6/f e controlla la velocità di trasferimento di elettroni a PSI (Suorsa et al., 2012, 2016; Tikkanen e Aro, 2014). Nelle angiosperme tra cui Arabidopsis thaliana, sono in funzione due percorsi di trasporto ciclico di elettroni PSI (Shikanai, 2007). La prima via CEF è la via PGR5-/PGRL1-dipendente sensibile all’antimicina A (Munekage et al., 2002; Sugimoto et al., 2013), e l’altro dipende dal complesso cloroplasto NADH deidrogenasi (NDH) (Burrows et al., 1998; Shikanai et al., 1998). Il contributo della via PGR5-/PGRL1-dipendente è più significativo nelle piante C3. Sotto alta luce, l’attivazione del CEF PGR5 – / PGRL1-dipendente induce l’acidificazione del lume tilacoide e quindi porta agli alti livelli di rapporto di ossidazione P700 (Suorsa et al., 2012, 2016; Kono et al., 2014; Yamori et al., 2016). In confronto, il rapporto di ossidazione P700 a bassa luminosità è stato poco influenzato dalla carenza di CEF PGR5 – / PGRL1-dipendente (Munekage et al., 2002, 2004; Kono et al., 2014). Dopo moderata fotoinibizione PSII, la stimolazione di CEF a bassa luce è stata accompagnata da un aumento della razione di ossidazione P700 (Huang et al., 2010). Tuttavia, non è chiaro se questo aumento del rapporto di ossidazione P700 sia causato dalla stimolazione CEF.
Oltre al CEF, il trasferimento di elettroni da PSII (ETRII) svolge un ruolo importante nell’influenzare lo stato redox del PSI (Tikkanen et al., 2014; Huang et al., 2016a, c; Suorsa et al., 2016). Nelle piante pgr5 di A. thaliana, è probabile che una grave fotoinibizione di PSII funzioni come il controllo finale del trasferimento di elettroni fotosintetici che consente il mantenimento di P700 ossidato in modo ottimale sotto luce in eccesso (Tikkanen et al., 2014). Recentemente, Suorsa et al. (2016) ha indicato che le piante pgr5 hanno mostrato un elevato rapporto di ossidazione P700 in condizioni di luce elevata quando l’ETRII è stato ridotto combinando mutazioni knockout in PsbO1, PsbP2, PsbQ1, PsbQ2 e PSBR loci. Nelle foglie refrigerate di tabacco, la fotoinibizione moderata di PSII ha depresso il flusso di elettroni verso PSI e quindi ha aumentato il rapporto di ossidazione P700 durante ulteriori trattamenti di refrigerazione (Huang et al., 2016a). Inoltre, la fotoinibizione indotta dal raffreddamento di PSII ha portato a una depressione di ETRII, che è stata accompagnata da un aumento del rapporto di ossidazione P700 a bassa luminosità (Huang et al., 2010). Ipotizziamo che il rapporto di ossidazione P700 a bassa luce sia controllato principalmente dal flusso di elettroni da PSII.
Nel nostro precedente rapporto, abbiamo osservato che la pianta che stabilisce l’ombra Panax notoginseng ha mostrato una fotoinibizione selettiva di PSII sotto stress ad alta luce. Dopo l’esposizione a breve termine a stress ad alta luminosità, l’ETRII a bassa luminosità è diminuito significativamente, ma il CEF è stato significativamente stimolato. Contemporaneamente, il rapporto di ossidazione P700 è ampiamente aumentato. I nostri obiettivi specifici erano (1) indagare se la stimolazione CEF a bassa luminosità facilita principalmente la sintesi di ATP; e (2) determinare se l’aumento del rapporto di ossidazione P700 su moderata fotoinibizione PSII è più correlato all’ETRII piuttosto che alla stimolazione CEF o al cambiamento del pmf. Per rispondere a queste domande, le foglie intatte di Panax notoginseng sono state trattate a 2258 µmol fotoni m-2 s-1 per 30 min. Prima e dopo il trattamento ad alta luce, sono state determinate la distribuzione dell’energia in PSII, lo stato redox di PSI e la forza motrice protonica (pmf) a una luce bassa di 54 µmol fotoni m-2 s-1.
Materiali e metodi
Materiali vegetali e condizioni di crescita
Nel presente studio, piante di 2 anni di una pianta che stabilisce l’ombra Panax notoginseng (Burkill) F. H. Chen ex C. Chow e W. G. Huang sono state utilizzate per esperimenti. Queste piante sono state coltivate a condizioni di luce del 10% di luce solare (con intensità luminosa massima a metà giornata di circa 200 µmol fotoni m-2 s-1). Nessun stress idrico e nutrizionale è stato sperimentato per queste piante. le foglie completamente espanse di 9 settimane sono state utilizzate per le misurazioni fotosintetiche.
Le misurazioni PSI e PSII
I parametri Photosystem I e PSII sono stati misurati a 25°C mediante registrazione simultanea con un sistema di misurazione Dual PAM-100 (Heinz Walz GmbH, Effeltrich, Germania). I parametri di fluorescenza della clorofilla sono stati calcolati come segue: Fv / Fm = (Fm – Fo)/Fm, Y(II) = (Fm’ – Fs) / Fm’ (Genty et al., 1989), NPQ = (Fm-Fm’) / Fm’. Fo e Fm sono rispettivamente la fluorescenza minima e massima dopo l’acclimatazione al buio. Fs è la fluorescenza allo stato stazionario adattata alla luce. Fo e Fm sono stati determinati dopo l’acclimatazione al buio per 30 minuti prima e dopo il trattamento ad alta luminosità. I parametri fotosintetici PSI sono stati misurati con Dual PAM-100 basato sul segnale P700 (differenza di intensità di 830 e 875 nm modulati a impulsi che misurano la luce che raggiunge il fotorivelatore) (Klughammer e Schreiber, 2008). I segnali P700 + (P) possono variare tra un livello minimo (P700 completamente ridotto) e un livello massimo (P700 completamente ossidato). Il livello massimo (Pm) è stato determinato con l’applicazione di un impulso di saturazione (600 ms e 10000 µmol fotoni m-2 s-1) dopo la pre-illuminazione con luce rossa lontana, e Pm è stato utilizzato per stimare l’attività PSI. Pm ‘ è stato determinato simile al Pm, ma con luce attinica invece di far-luce rossa. La resa quantistica di PSI è stata calcolata come Y (I) = (Pm’- P)/Pm. Il rapporto di ossidazione P700 in una data luce attinica è stato calcolato come Y (ND) = P/Pm. La resa quantistica della dissipazione di energia non fotochimica PSI dovuta alla limitazione lato accettore è stata calcolata come Y (NA) = (Pm – Pm’)/Pm. I valori allo stato stazionario per Y(II), NPQ, Y(I) e Y (ND) sono stati misurati dopo l’acclimatazione alla luce bassa per 20 min.
Il flusso di elettroni fotosintetici attraverso PSI e PSII sono stati calcolati come: ETRII = Y (II) ×PPFD ×0,84 ×0,5 (Krall ed Edwards, 1992), ETRI = Y (I) ×PPFD×0,84 ×0,5 (Yamori et al., 2011), dove si presume che 0,5 sia la proporzione di luce assorbita che raggiunge PSI o PSII e che 0,84 sia l’assorbanza (la frazione della luce incidente assorbita dalle foglie). L’entità dell’attivazione del CEF è stata stimata come rapporto ETRI / ETRII (Yamori et al., 2011, 2015). Va notato che il partizionamento di eccitazione 1:1 tra PSI e PSII potrebbe non essere reale, perché le piante ombreggiate tendono ad aumentare il rapporto PSII / PSI (Lunde et al., 2003; Tikkanen et al., 2006; Grieco et al., 2012). Inoltre, in questo studio, i parametri PSI e PSII sono stati misurati utilizzando luce attinica rossa (635 nm) fornita da Dual-PAM 100 (Walz, Germania). Poiché la luce attinica rossa favorisce l’eccitazione di PSII rispetto a quella di PSI, la distribuzione dell’energia di eccitazione da LHCII a PSII e PSI può essere influenzata dalla luce attinica rossa (Tikkanen et al., 2017).
Analisi di spostamento elettrocromico
Il segnale ECS è stato monitorato come variazione di assorbanza a 515 nm utilizzando un Dual-PAM-100 (Walz, Effeltrich, Germania) dotato di un modulo emettitore-rivelatore P515 / 535 (Walz). Il segnale ECS è stato ottenuto dopo 20 min di illuminazione a 54 µmol fotoni m-2 s-1, successivamente, il decadimento ECS è stato misurato spegnendo la luce attinica per 30 s. L’analisi della cinetica di rilassamento dell’intervallo scuro ECS (DIRKECS) è stata eseguita con il metodo di Sacksteder et al. (2001) e Takizawa et al. (2008). Il pmf totale è stato stimato in base all’ampiezza totale del rapido decadimento del segnale ECS durante l’intervallo di buio di 300 ms. Il lento rilassamento del segnale ECS ha permesso di riconoscere il contributo del gradiente protonico attraverso le membrane tilacoidi (ΔpH). La costante di tempo del rilassamento ECS del primo ordine (tECS) è inversamente proporzionale alla conduttività protonica (gH+) della membrana tilacoide attraverso l’ATP sintasi (Sacksteder e Kramer, 2000; Cruz et al., 2005). Di conseguenza, gH + è stato stimato come l’inverso della costante di tempo di decadimento .
Trattamenti fotoinibitori
Dopo l’acclimatazione al buio per 30 min, Fv / Fm e Pm sono stati misurati in foglie intatte. Successivamente, queste foglie intatte sono state adattate alla luce a 59 µmol fotoni m-2 s-1 per 20 min e sono stati registrati parametri di fluorescenza clorofilla, segnale P700 e segnale ECS. Quindi la luce attinica è stata cambiata in 2258 µmol fotoni m-2 s-1. Dopo l’esposizione a questa luce alta per 30 min, la luce attinica è stata cambiata in fotoni 59 µmol m-2 s-1 immediatamente e i parametri fotosintetici sono stati registrati dopo l’acclimatazione della luce per 20 min. Infine, Fv / Fm e Pm sono stati misurati dopo l’acclimatazione al buio per 30 min.
Analisi statistica
I risultati sono stati visualizzati come valori medi di cinque esperimenti indipendenti. Il T-test indipendente è stato utilizzato a livello di significatività α = 0,05 per determinare se esistessero differenze significative tra i diversi trattamenti. Tutte le analisi statistiche sono state eseguite utilizzando SPSS 16.0.
Risultati
Durante l’induzione fotosintetica a 59 µmol fotoni m-2 s-1, ETRII gradualmente aumentato e ha raggiunto uno stato stazionario a circa 18 min (Figura 1A). In confronto, l’ETRI è risultato costante durante questa fase di induzione (Figura 1A). Dopo l’inizio di questa luce bassa, ETRI era molto più alto di ETRII. Tuttavia, dopo un’induzione fotosintetica di 20 minuti, l’ETRI era inferiore all’ETRII. Questi risultati hanno suggerito l’attivazione di CEF durante la fase iniziale di induzione, in accordo con studi precedenti (Joliot e Joliot, 2002, 2005; Makino et al., 2002). Dopo questa induzione fotosintetica a bassa luce, le foglie sono state illuminate ad una luce alta di 2258 µmol fotoni m-2 s-1 per 30 min. È interessante notare che l’ETRII è gradualmente diminuito durante il trattamento ad alta luminosità (Figura 1B). Nel frattempo, il valore di ETRI era superiore a quello di ETRII (Figura 1B), indicando l’attivazione di CEF in condizioni di luce elevata. Dopo questo trattamento ad alta luminosità, il massimo P700 foto-ossidabile (Pm) è stato mantenuto stabile (Figura 2A). In confronto, l’intensità massima di fluorescenza (Fm) è diminuita del 40% e la resa quantistica massima di PSII (Fv/Fm) è diminuita da 0,80 a 0,65 (Figure 2B,C). Questi risultati hanno indicato la fotoinibizione selettiva di PSII nelle foglie di Panax notoginseng sotto stress ad alta luce.
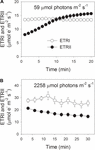
FIGURA 1. Flusso fotosintetico dell’elettrone alla luce bassa (A) ed all’alta luce (B). (A) Le foglie acclimatate al buio sono state esposte a una luce scarsa di 59 µmol fotoni m-2 s-1 per 20 min. (B) Dopo l’illuminazione a 59 µmol fotoni m-2 s-1 per 20 min per attivare il lavandino di elettroni nella fotosintesi, le foglie sono state esposte ad un’alta luce di 2258 µmol fotoni m-2 s-1 per 30 min. I valori sono mezzi ± SE (n = 5).
Prima di alta luce di trattamento, maturo foglie erano illuminati di una luce bassa del 59 µmol fotoni m-2 s-1 per 20 min per attivare la fotosintesi, e quindi i valori per ETRI, ETRII, Y(ND), e NPQ sono stati registrati. Dopo un trattamento ad alta luminosità per 30 min, i valori per ETRI, ETRII, Y(ND) e NPQ sono stati registrati dopo una nuova fase di acclimatazione di 20 min a bassa luminosità. Prima del trattamento ad alta luce, i valori per ETRI ed ETRII a 59 µmol fotoni m-2 s-1 erano 13,4 e 15,7 µmol elettroni m-2 s-1, rispettivamente (Figure 3A,B). Dopo il trattamento ad alta luce, ETRI ed ETRII a bassa luce erano 12,8 e 11,2 µmol elettroni m-2 s-1, rispettivamente (Figure 3A,B). Il valore di ETRII a 59 µmol fotoni m-2 s-1 è diminuito di circa il 30% dopo il trattamento fotoinibitorio, indicando la depressione di ETRII a seguito di moderata fotoinibizione PSII. Prima del trattamento ad alta luce, il valore del rapporto ETRI/ETRII a 59 µmol fotoni m-2 s-1 era 0,85 (Figura 3C). Dopo il trattamento fotoinibitorio, il rapporto ETRI/ETRII è aumentato significativamente a 1,14 (Figura 3C). Questi risultati hanno suggerito la stimolazione di CEF in condizioni di scarsa illuminazione dopo la fotoinibizione PSII (Yamori et al., 2011, 2015).
Dopo il trattamento ad alta luminosità, il valore allo stato stazionario di Y(I) a 59 µmol fotoni m-2 s-1 non è cambiato (Figura 4A). È interessante notare che Y (NA) è diminuito significativamente da 0,36 a 0,23(Figura 4B) e Y (ND) è aumentato significativamente da 0,1 a 0,25 (Figura 4C). Questi risultati hanno indicato la variazione dello stato redox di PSI in condizioni di scarsa luminosità dopo il trattamento fotoinibitorio. Nel frattempo, il valore di NPQ è leggermente cambiato (Figura 4D). Di conseguenza, la moderata fotoinibizione PSII ha avuto effetti diversi sul rapporto di ossidazione P700 e NPQ in condizioni di scarsa illuminazione.
Al fine di chiarire se l’aumento di Y(ND) è causato da un aumento di pmf, i segnali di spostamento elettrocromici a 54 µmol fotoni m-2 s-1 sono stati determinati dopo l’acclimatazione della luce per 20 minuti prima e dopo il trattamento ad alta luce. È interessante notare che il pmf totale è diminuito significativamente del 18% dopo un trattamento ad alta luminosità (Figura 5A), ma il livello ΔpH è cambiato in modo insignificante (Figura 5B). Poiché la formazione di pmf può essere influenzata dalla conduttività del protone thylakoid, la conduttività del protone (gH+) della membrana thylakoid a questa luce bassa è stata esaminata anche prima e dopo il trattamento ad alta luce. Il risultato ha mostrato che il gH + non è cambiato con il trattamento ad alta luce (Figura 5C), suggerendo che il trattamento ad alta luce difficilmente ha influenzato l’attività del cloroplasto ATP sintasi a bassa luce. Poiché la diminuzione di 30% in ETRII è stata accompagnata da una diminuzione di 18% in pmf, la stimolazione di CEF a bassa luce ha parzialmente compensato la formazione di pmf e ΔpH.

FIGURA 5. Valori per la forza motrice totale del protone (pmf) (A), il gradiente protonico (ΔpH) attraverso le membrane tilacoidi (B) e la conduttività protonica (gH+) della membrana tilacoide (C) in condizioni di scarsa illuminazione. Tutti i parametri sono stati misurati dopo l’adattamento a 54 µmol fotoni m-2 s-1 per 20 min. I valori sono mezzi ± SE (n = 5). L’asterisco indica una variazione significativa (P < 0,05) dopo un trattamento ad alta luminosità.
Discussione
Il ruolo della stimolazione CEF in condizioni di scarsa illuminazione
È stato indicato che il CEF svolge un ruolo importante nel sostenere la fotosintesi e la crescita delle piante (Yamori e Shikanai, 2016). Sotto alta luce, CEF è ora pensato per essere essenziale per bilanciare il bilancio energetico ATP / NADPH, nonché per proteggere PSI e PSII da danni (Munekage et al., 2002, 2004; Takahashi et al., 2009; Suorsa et al., 2012, 2016; Walker et al., 2014; Huang et al., 2015a, 2017b). A bassa intensità luminosa, CEF svolge un ruolo importante nell’ottimizzazione dell’assimilazione fotosintetica di CO2 probabilmente attraverso la fornitura di ATP extra (Yamori et al., 2011, 2015; Nishikawa et al., 2012; Huang et al., 2015a). Il ruolo principale del CEF è modulato in modo flessibile in risposta all’intensità della luce. In particolare, il CEF contribuisce principalmente a bilanciare il bilancio energetico ATP/NADPH sotto intensità di luce sub-saturante, ma protegge principalmente l’apparato fotosintetico dalla fotoinibizione quando esposto a intensità di luce saturante tramite acidificazione del lume tilacoide (Huang et al., 2015a). È interessante notare che, Huang et al. (2010) ha scoperto che il CEF è stato significativamente stimolato in condizioni di scarsa luminosità dopo la fotoinibizione indotta da raffreddamento di PSII e ha ipotizzato che questa stimolazione CEF migliorasse principalmente la sintesi di ATP per la riparazione rapida di PSII. Tuttavia, erano necessarie ulteriori prove a sostegno di questa ipotesi. Nel presente studio, abbiamo osservato che il valore di ETRI/ETRII a bassa luce è aumentato significativamente (Figura 3C), indicando la stimolazione di CEF attorno a PSI (Huang et al., 2011,2012, 2017a, b; Yamori et al., 2011, 2015). Contemporaneamente, l’ampiezza del pmf è diminuita significativamente e ΔpH è diminuita leggermente. Questi risultati hanno indicato che la stimolazione di CEF non ha innescato la down-regulation ΔpH-dipendente del trasporto di elettroni fotosintetici. In altre parole, questa stimolazione di CEF in condizioni di scarsa luminosità ha principalmente facilitato la sintesi di ATP.
Sebbene la conduttività protonica della cloroplasto ATP sintasi non sia stata influenzata dal trattamento ad alta luminosità, le dimensioni ridotte del pmf hanno determinato una diminuzione del tasso effettivo di sintesi di ATP. I tassi di riparazione di PSII e l’assimilazione fotosintetica di CO2 a bassa luce sono principalmente limitati dal tasso di sintesi di ATP (Allakhverdiev et al., 2005; Yamori et al., 2011, 2015; Nishikawa et al., 2012). Poiché l’ETRII è diminuito significativamente dopo la fotoinibizione PSII, il tasso di sintesi di ATP tramite ETRII è stato notevolmente ridotto. Al fine di bilanciare il rapporto ATP/NADPH richiesto dal metabolismo primario e la riparazione rapida di PSII, è necessario un meccanismo flessibile per fornire ATP extra. In questa condizione, ETRII è diminuito del 30%, ma il pmf totale è diminuito solo del 18%. Questi risultati indicano che la stimolazione di CEF ha compensato la riduzione della formazione ETRII-dipendente di pmf, migliorando la sintesi di ATP. La rapida riparazione di PSII fotodamaged dipende dalla sintesi di ATP (Allakhverdiev et al., 2005). L’accelerazione di CEF intorno a PSI ha aumentato la concentrazione intracellulare di ATP, accelerando così il tasso di riparazione di PSII in Synechocystis (Allakhverdiev et al., 2005). Presi insieme, proponiamo che la stimolazione del CEF in condizioni di scarsa luminosità svolga un ruolo importante nella riparazione rapida dell’attività PSII tramite un’ulteriore sintesi di ATP.
La variazione del rapporto di ossidazione P700 in condizioni di scarsa illuminazione non è correlata al pmf
Un fenomeno interessante è che il rapporto di ossidazione P700 in condizioni di scarsa illuminazione è aumentato significativamente dopo una moderata fotoinibizione PSII (Huang et al., 2010), che è anche mostrato nel presente studio. In condizioni in cui la luce assorbita supera i requisiti per la fotosintesi, la generazione dipendente da CEF di ΔpH regola l’attività dell’attività complessa Cyt b6 / f e controlla il flusso di elettroni da PSII a PSI (Suorsa et al., 2012, 2016; Shikanai, 2014, 2016), ottimizzando lo stato redox di P700 in PSI e riducendo al minimo la produzione di ROS in PSI durante la fotosintesi. Nelle piante pgr5 di A. thaliana, P700 viene ridotto dagli elettroni nella luce a causa della perdita di generazione di pmf. Tuttavia, nel mutante pgr5 che accumula la proteina flavodiron, il livello di pmf è stato anche ripristinato al livello wild-type, e quindi P700 è stato ossidato come nel wild-type (Yamamoto et al., 2016). Nelle linee mutanti del grano carenti di clorofilla b, il gradiente di protone tilacoide insufficiente porta a una riduzione eccessiva del lato dell’accettore PSI e quindi alla fotoinibizione PSI in condizioni di luce elevata o alta temperatura (Brestic et al., 2015, 2016). Recentemente, alcuni studi hanno riferito che l’aumento dell’attività del cloroplasto ATP sintasi ha compromesso la formazione di pmf e ha causato l’eccessiva riduzione della catena di trasporto degli elettroni fotosintetici, con conseguente fotodamaggio di PSI sotto luce elevata e luce fluttuante (Kanazawa et al., 2017; Takagi et al., 2017). Questi rapporti supportano il ruolo critico del pmf nel mantenere P700 ossidato in modo ottimale sotto l’energia luminosa in eccesso.
I nostri risultati attuali hanno indicato che dopo il trattamento ad alta luminosità per 30 min, il pmf totale formato a questa luce bassa è diminuito significativamente e la formazione di ΔpH è leggermente cambiata (Figure 5A,B). Nel frattempo, il rapporto di ossidazione P700 è aumentato significativamente da 0,1 (prima del trattamento) a 0,25 (dopo il trattamento) (Figura 4C). Questi risultati indicano fortemente che questo aumento del rapporto di ossidazione P700 non può essere spiegato dal cambiamento nel pmf, che è in gran parte diverso dalla correlazione tra Y(ND) e pmf sotto alta luce (Yamamoto et al., 2016; Takagi et al., 2017). Pertanto, l’effetto di regolazione del pmf sul rapporto di ossidazione P700 è minimo in condizioni di scarsa illuminazione, ma diventa particolarmente cruciale in condizioni di luce elevata o luce fluttuante. Sotto alta luce, un alto valore di Y (ND) è solitamente accompagnato da un alto valore di NPQ (Munekage et al., 2002, 2004; Kono et al., 2014; Zivcak et al., 2015), a causa dell’aumento del pmf. La compromissione della formazione di ΔpH porta a livelli ridotti di Y (ND) e NPQ sotto alta luce (Suorsa et al., 2012; Kono et al., 2014; Yamamoto et al., 2016; Kanazawa et al., 2017). L’induzione di NPQ a bassa luminosità è determinata principalmente dal livello di acidificazione del lume. Dopo il trattamento ad alta luminosità, l’entità dell’acidificazione del lume non è cambiata (Figura 5B) e l’NPQ è rimasto stabile (Figura 4D). In confronto, Y (ND) è aumentato significativamente. Questi risultati indicano che in condizioni di scarsa illuminazione, Y(ND) e NPQ erano controllati da diversi meccanismi regolatori.
ETRII Controlla il rapporto di ossidazione P700 in condizioni di scarsa luminosità
PSI diventa eccessivamente ridotto solo quando il flusso di elettroni da PSII supera la capacità degli accettori di elettroni PSI di far fronte agli elettroni. Quando il flusso di elettroni verso PSI è limitato, PSI è estremamente tollerante contro lo stress leggero nelle piante pgr5 di A. thaliana (Suorsa et al., 2012, 2016; Tikkanen et al., 2014). Per la Psychotria rubra della pianta che stabilisce l’ombra, l’attività PSI era insuscettibile allo stress ad alta luce in presenza di DCMU (Huang et al., 2016c). Nelle foglie refrigerate di tabacco, la moderata fotoinibizione PSII ha permesso il mantenimento di P700 ossidato in modo ottimale e quindi protetto l’attività PSI contro ulteriori fotodamaggi (Huang et al., 2016a). Questi risultati hanno indicato il ruolo importante di ETRII nel controllo dello stato redox del PSI in condizioni di luce elevata o di stress da raffreddamento. I nostri risultati attuali hanno mostrato che la moderata fotoinibizione PSII ha portato a una significativa depressione di ETRII a bassa luce. Nel frattempo, l’attività PSI e l’attività della cloroplasto ATP sintasi sono leggermente cambiate e il pmf totale e ΔpH non sono aumentati. Di conseguenza, la riduzione di ETRII non è stata causata dal controllo fotosintetico ΔpH-dipendente tramite il complesso Cyt b6/f, ma è stata probabilmente indotta dalla diminuzione dell’attività PSII (Tikkanen et al., 2014). La ridotta fornitura di elettroni da PSII a PSI ha portato all’aumento del livello di ossidazione P700. Pertanto, il rapporto di ossidazione P700 in condizioni di scarsa illuminazione era in gran parte controllato da ETRII.
Conclusione
Abbiamo scoperto che la fotoinibizione selettiva di PSII induceva una stimolazione del CEF e un aumento del rapporto di ossidazione P700 in condizioni di scarsa illuminazione. La stimolazione di CEF non ha innescato la down-regulation ΔpH-dipendente del trasporto di elettroni fotosintetici. Di conseguenza, questa stimolazione di CEF in condizioni di scarsa luminosità ha principalmente facilitato la sintesi di ATP, che è essenziale per la riparazione rapida di PSII fotodamaged. L’aumento del rapporto di ossidazione P700 non poteva essere spiegato dal cambiamento nel controllo fotosintetico ΔpH-dipendente al complesso Cyt b6 / f, ma era principalmente causato dalla ridotta fornitura di elettroni da PSII a PSI.
Contributi dell’autore
WH, S-BZ e TL hanno ideato e progettato la ricerca. WH e YJY hanno condotto gli esperimenti. WH, YJY, SBZ e TL hanno analizzato i dati. WH ha scritto la prima bozza del manoscritto, che è stata intensamente curata da tutti gli autori.
Finanziamento
Questo studio è stato sostenuto dalla National Natural Science Foundation of China (31670343), Youth Innovation Promotion Association dell’Accademia cinese delle Scienze (2016347) e dai principali programmi di scienza e tecnica nella provincia dello Yunnan (2016ZF001).
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Kono, M., Noguchi, K., e Terashima, I. (2014). Ruoli del flusso di elettroni ciclici intorno a PSI (CEF-PSI) e percorsi alternativi O2-dipendenti nella regolazione del flusso di elettroni fotosintetici in luce fluttuante a breve termine in Arabidopsis thaliana. Physiol delle cellule vegetali. 55, 990–1004. doi: 10.1093/pcp/pcu033
PubMed Abstract | CrossRef Full Text/Google Scholar
Shikanai, T. (2016). Rete regolatoria della forza motrice protonica: contributo del trasporto ciclico di elettroni attorno al fotosistema I. Photosynth. Res. 129, 253-260. doi: 10.1007 / s11120-016-0227-0
PubMed Abstract | CrossRef Full Text/Google Scholar
Yamori, W., Makino, A., e Shikanai, T. (2016). Un ruolo fisiologico del trasporto di elettroni ciclici intorno al fotosistema I nel sostenere la fotosintesi sotto luce fluttuante nel riso. Sic. Rep. 6: 20147. doi: 10.1038/srep20147
PubMed Abstract | CrossRef Full Text/Google Scholar
Yamori, W., and Shikanai, T. (2016). Funzioni fisiologiche del trasporto di elettroni ciclici intorno al fotosistema I nel sostenere la fotosintesi e la crescita delle piante. Annu. Rev. Pianta Biol. 67, 81–106. doi: 10.1146/annurev-arplant-043015-112002
PubMed Abstract | CrossRef Full Text/Google Scholar
Yamori, W., Shikanai, T., e Makino, A. (2015). Photosystem I flusso di elettroni ciclici tramite cloroplasto NADH deidrogenasi-come complesso svolge un ruolo fisiologico per la fotosintesi a bassa luce. Sic. Rep. 5: 13908. doi: 10.1038/srep13908
PubMed Abstract | CrossRef Full Text/Google Scholar
Zhang, S. P., and Scheller, H. V. (2004). Fotoinibizione del fotosistema I a temperatura di raffreddamento e successivo recupero in Arabidopsis thaliana. Physiol delle cellule vegetali. 45, 1595–1602. doi: 10.1093/pcp/pch180
PubMed Abstract / CrossRef Full Text / Google Scholar