Forma di dosaggio: iniezione
Medicamente recensito da Drugs.com. Ultimo aggiornamento il 22 dicembre 2020.
- Effetti collaterali
- Dosaggio
- Professionale
- Interazioni
- Gravidanza
- Più
Rx SOLO.
Soluzione endovenosa sterile
- Inamrinone Descrizione
- Inamrinone-Farmacologia clinica
- Farmacocinetica
- Farmacodinamica
- Indicazioni e utilizzo per Inamrinone
- Controindicazioni
- Avvertenze
- Precauzioni
- Generale
- Gli esami di laboratorio
- Interazioni farmacologiche
- Interazioni chimiche
- Carcinogenesi, mutagenesi, compromissione della fertilità
- Gravidanza
- Madri che allattano
- Uso pediatrico
- Reazioni avverse
- Gestione delle reazioni avverse
- Sovradosaggio
- Dosaggio e somministrazione di Inamrinone
- Interazioni chimiche
- Come viene fornito Inamrinone
- VIAL LABEL
- More about inamrinone
- Related treatment guides
Inamrinone Descrizione
Inamrinone Injection USP rappresenta una nuova classe di agenti inotropi cardiaci distinti dai glicosidi digitalici o dalle catecolamine. Inamrinone il lattato viene designato chimicamente come 5-Amino-6(1H)-one 2-hydroxypropanate e ha la seguente struttura:
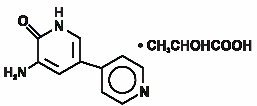
Inamrinone è un giallo paglierino cristallino composto con un peso molecolare di 187.20 e la formula molecolare di C10H9N3O. Ogni mole di acido lattico ha un peso molecolare di 90.08 e una formula empirica di C3H6O3. Le solubilità di Inamrinone a pH 4.1, 6.0 e 8.0 sono 25, 0.9 e 0.7 mg/mL, rispettivamente.
Inamrinone injection è una soluzione sterile di colore giallo chiaro disponibile in flaconcini da 20 mL per somministrazione endovenosa. Ogni ml contiene Inamrinone lattato equivalente a 5 mg di Inamrinone e 0,25 mg di metabisolfito di sodio aggiunto come conservante in acqua per preparazioni iniettabili. Tutti i dosaggi espressi nel foglietto illustrativo sono espressi in termini di base, Inamrinone. Il pH viene regolato tra 3,2 e 4,0 con acido lattico o idrossido di sodio. La concentrazione totale di acido lattico può variare tra 5 mg e 7,5 mg.
Inamrinone-Farmacologia clinica
L’inamrinone è un agente inotropico positivo con attività vasodilatatrice, diverso per struttura e modalità di azione dai glicosidi digitalici o dalle catecolamine.
Il meccanismo dei suoi effetti inotropi e vasodilatatori non è stato completamente chiarito.
Per quanto riguarda il suo effetto inotropico, prove sperimentali indicano che non è un agonista beta-adrenergico. Inibisce l’attività ciclica miocardica della fosfodiesterasi dell’adenosina monofosfato (c-AMP) e aumenta i livelli cellulari di c-AMP. A differenza della digitale, non inibisce l’attività dell’adenosina trifosfatasi sodio-potassio.
Per quanto riguarda la sua attività vasodilatatrice, l’Inamrinone riduce il postcarico e il precarico per il suo effetto rilassante diretto sulla muscolatura liscia vascolare.
Farmacocinetica
Dopo somministrazione endovenosa in bolo (da 1 a 2 minuti) di 0,68 mg/kg a 1,2 mg/kg a volontari normali, Inamrinone aveva un volume di distribuzione di 1,2 litri / kg e, dopo un’emivita di fase distributiva di circa 4,6 minuti nel plasma, aveva un’emivita media apparente di eliminazione terminale del primo ordine di circa 3,6 ore. Nei pazienti con insufficienza cardiaca congestizia che ricevevano infusioni di Inamrinone l’emivita media apparente di eliminazione terminale del primo ordine era di circa 5,8 ore.
Inamrinone è stato dimostrato in uno studio di essere 10% al 22% legato alle proteine plasmatiche umane mediante ultrafiltrazione in vitro, e in un altro studio 35% al 49% legato da ultrafiltrazione o dialisi di equilibrio.
La via primaria di escrezione nell ‘ uomo è attraverso le urine sia come Inamrinone che come diversi metaboliti (N-glicolil, N-acetato, O-glucuronide e N-glucuronide). Nei volontari normali, circa il 63% di una dose orale di Inamrinone marcato con 14C è stato escreto nelle urine per un periodo di 96 ore. Nelle prime 8 ore, il 51% della radioattività nelle urine era Inamrinone con il 5% come N-acetato, l ‘ 8% come N-glicolato e meno del 5% per ciascun glucuronide. Circa il 18% della dose somministrata è stato escreto nelle feci in 72 ore.
In uno studio endovenoso nonradioattivo di 24 ore, dal 10% al 40% della dose è stata escreta nelle urine come Inamrinone immodificato con il metabolita N-acetile che rappresenta meno del 2% della dose.
In pazienti con insufficienza cardiaca congestizia, dopo una dose di carico in bolo, i livelli plasmatici allo steady-state di circa 2,4 mcg/mL sono stati mantenuti da un’infusione da 5 mcg/kg/min a 10 mcg/kg / min. In alcuni pazienti con insufficienza cardiaca congestizia, con associata perfusione renale ed epatica compromessa, è possibile che i livelli plasmatici di Inamrinone possano aumentare durante il periodo di infusione; pertanto, in questi pazienti, può essere necessario monitorare la risposta emodinamica e/o il livello del farmaco. Le principali misure di risposta del paziente includono l’indice cardiaco, la pressione del cuneo capillare polmonare, la pressione venosa centrale e la loro relazione con le concentrazioni plasmatiche. Inoltre, le misurazioni della pressione sanguigna, della produzione di urina e del peso corporeo possono rivelarsi utili, così come i sintomi clinici come ortopnea, dispnea e affaticamento.
Farmacodinamica
Nei pazienti con funzione miocardica depressa, l’Inamrinone produce un rapido aumento della gittata cardiaca a causa delle sue azioni inotropiche e vasodilatatrici.
A seguito di una singola dose in bolo endovenoso di Inamrinone pari a 0.75 mg/kg a 3 mg/kg in pazienti con insufficienza cardiaca congestizia, si verificano aumenti massimi della gittata cardiaca correlati alla dose (da circa il 28% a 0,75 mg/kg a circa il 61% a 3 mg/kg). L’effetto di picco si verifica entro 10 minuti a tutte le dosi. La durata dell’effetto dipende dalla dose, che dura circa 1/2 ora a 0,75 mg / kg e circa 2 ore a 3 mg / kg.
Nello stesso intervallo di dosi, la pressione del cuneo capillare polmonare e la resistenza periferica totale mostrano diminuzioni dose-correlate (diminuzioni massime medie del 29% nella pressione del cuneo capillare polmonare e del 29% nella resistenza vascolare sistemica). A dosi fino a 3 mg/kg sono state osservate diminuzioni dose-correlate della pressione diastolica (fino al 13%). La pressione arteriosa media diminuisce (9,7%) alla dose di 3 mg/kg. La frequenza cardiaca è generalmente invariata.
Le variazioni dei parametri emodinamici vengono mantenute durante l ‘ infusione endovenosa continua e per diverse ore successive.
Inamrinone è efficace in pazienti completamente digitalizzati senza causare segni di tossicità cardiaca del glicoside. I suoi effetti inotropi sono additivi a quelli della digitale. Nei casi di flutter atriale/fibrillazione, è possibile che Inamrinone possa aumentare il tasso di risposta ventricolare a causa del suo leggero miglioramento della conduzione A/V. In questi casi, si raccomanda un precedente trattamento con digitale.
Sono stati osservati un miglioramento della funzione ventricolare sinistra e un sollievo dall’insufficienza cardiaca congestizia in pazienti con cardiopatia ischemica. Il miglioramento si è verificato senza indurre sintomi o segni elettrocardiografici di ischemia miocardica.
A frequenza cardiaca e pressione sanguigna costanti, gli aumenti della gittata cardiaca si verificano senza aumenti misurabili del consumo di ossigeno miocardico o cambiamenti nella differenza di ossigeno artero-venoso.
L ‘ attività inotropa viene mantenuta dopo ripetute dosi endovenose di Inamrinone. La somministrazione di Inamrinone produce benefici emodinamici e sintomatici per i pazienti non controllati in modo soddisfacente dalla terapia convenzionale con diuretici e glicosidi cardiaci.
Indicazioni e utilizzo per Inamrinone
L’iniezione di Inamrinone è per la gestione a breve termine dell’insufficienza cardiaca congestizia. A causa della limitata esperienza e del potenziale di effetti avversi gravi (vedere REAZIONI AVVERSE), Inamrinone deve essere usato solo in pazienti che possono essere strettamente monitorati e che non hanno risposto adeguatamente a digitale, diuretici e/o vasodilatatori. L’esperienza con Inamrinone per via endovenosa in studi clinici controllati non si estende oltre le 48 ore di boli ripetuti e / o infusioni continue.
Sia somministrato per via orale, continuamente per via endovenosa, o intermittente per via endovenosa, né Inamrinone né qualsiasi altro inotropo ciclico-AMP-dipendente è stato dimostrato in studi controllati per essere sicuro o efficace nel trattamento a lungo termine di insufficienza cardiaca congestizia. Negli studi controllati di terapia orale cronica con vari agenti di questo tipo (incluso Inamrinone), i sintomi non sono stati alleviati in modo coerente e gli inotropi ciclico-AMP-dipendenti sono stati costantemente associati ad un aumento dei rischi di ospedalizzazione e morte. I pazienti con sintomi di classe IV NYHA sembravano essere particolarmente a rischio.
Controindicazioni
Inamrinone è controindicato nei pazienti che sono ipersensibili ad esso.
È inoltre controindicato nei pazienti notoriamente ipersensibili ai bisolfiti.
Avvertenze
Contiene metabisolfito di sodio, un solfito che può causare reazioni di tipo allergico, inclusi sintomi anafilattici ed episodi asmatici potenzialmente letali o meno gravi in alcune persone sensibili. La prevalenza complessiva della sensibilità al solfito nella popolazione generale è sconosciuta e probabilmente bassa. La sensibilità al solfito è vista più frequentemente nelle persone asmatiche che nelle persone non asmatiche.
Precauzioni
Generale
Inamrinone non deve essere usato in pazienti con grave malattia valvolare aortica o polmonare al posto del sollievo chirurgico dell’ostruzione. Come altri agenti inotropi, può aggravare l’ostruzione del tratto di deflusso nella stenosi subaortica ipertrofica.
Durante la terapia endovenosa con Inamrinone, la pressione arteriosa e la frequenza cardiaca devono essere monitorate e la velocità di infusione deve essere rallentata o interrotta nei pazienti che presentano diminuzioni eccessive della pressione arteriosa.
I pazienti che hanno ricevuto una terapia diuretica vigorosa possono avere una pressione di riempimento cardiaca insufficiente per rispondere adeguatamente all’Inamrinone, nel qual caso può essere indicata una cauta liberalizzazione dell’assunzione di liquidi ed elettroliti.
Aritmie sopraventricolari e ventricolari sono state osservate nella popolazione ad alto rischio trattata. Mentre Inamrinone di per sé non ha dimostrato di essere aritmogena, il potenziale di aritmia, presente in sé insufficienza cardiaca congestizia, può essere aumentata da qualsiasi farmaco o combinazione di farmaci.
Sono state osservate trombocitopenia ed epatotossicità (vedere REAZIONI AVVERSE).
USO NELL’INFARTO MIOCARDICO ACUTO
Non sono stati condotti studi clinici in pazienti nella fase acuta dell’infarto postmiocardico. Pertanto, Inamrinone non è raccomandato in questi casi.
Gli esami di laboratorio
Fluidi ed elettroliti
I cambiamenti di fluidi ed elettroliti e la funzionalità renale devono essere attentamente monitorati durante la terapia con Inamrinone. Il miglioramento della gittata cardiaca con conseguente diuresi può richiedere una riduzione della dose di diuretico. La perdita di potassio dovuta a diuresi eccessiva può predisporre i pazienti digitalizzati alle aritmie. Pertanto, l’ipopotassiemia deve essere corretta con l’integrazione di potassio prima o durante l’uso di Inamrinone.
Interazioni farmacologiche
In un’esperienza relativamente limitata, non sono state osservate manifestazioni cliniche spiacevoli in pazienti in cui l’Inamrinone è stato usato in concomitanza con i seguenti farmaci: glicosidi digitalici; lidocaina, chinidina; metoprololo, propranololo; idralazina, prazosina; isosorbide dinitrato, nitroglicerina; clortalidone, acido etacrinico, furosemide, idroclorotiazide, spironolattone; captopril; eparina, warfarin; integratori di potassio; insulina; diazepam.
È stato riportato un caso di ipotensione eccessiva quando Inamrinone è stato usato in concomitanza con disopiramide.
Fino a quando non siano disponibili ulteriori esperienze, la somministrazione concomitante con disopiramide deve essere intrapresa con cautela.
Interazioni chimiche
Un’interazione chimica si verifica lentamente per un periodo di 24 ore quando la soluzione endovenosa di Inamrinone viene miscelata direttamente con soluzioni contenenti destrosio (glucosio). PERTANTO, Inamrinone NON DEVE ESSERE DILUITO CON SOLUZIONI CHE CONTENGONO DESTROSIO (GLUCOSIO) PRIMA DELL’INIEZIONE.
Si verifica immediatamente un’interazione chimica, che è evidenziata dalla formazione di un precipitato quando la furosemide viene iniettata in una linea endovenosa di un’infusione di Inamrinone. Pertanto, furosemide non deve essere somministrata in linee endovenose contenenti Inamrinone.
Carcinogenesi, mutagenesi, compromissione della fertilità
Non è stato suggerito un potenziale cancerogeno con Inamrinone quando somministrato per via orale fino a due anni a ratti e topi a livelli di dose fino alla dose massima tollerata di 80 mg/kg / die.
Il test del micronucleo nel topo (da 7,5 a 10 volte la dose massima nell ‘uomo) e il test di aberrazione cromosomica dell’ ovaio di criceto cinese sono risultati positivi indicando sia il potenziale clastogenico che la soppressione del numero di eritrociti policromatici. Tuttavia, il test della salmonella di Ames, lo studio sul linfoma del topo e l’analisi della metafasi dei linfociti umani in coltura erano tutti negativi. Gli effetti clastogenici sono in contrasto con i risultati negativi ottenuti negli studi sulla fertilità maschile e femminile nel ratto e in uno studio di tre generazioni nel ratto, entrambi con somministrazione orale.
In questi studi è stato osservato un leggero prolungamento del periodo di gestazione nel ratto a dosi di 50 mg/kg/die e 100 mg/kg/die. La distocia si è verificata in dighe che ricevevano 100 mg / kg / die con conseguente aumento del numero di nati morti, diminuzione delle dimensioni della cucciolata e scarsa sopravvivenza dei cuccioli.
Gravidanza
Effetti teratogeni-Gravidanza Categoria C
Nei conigli bianchi della Nuova Zelanda, è stato dimostrato che l ‘ Inamrinone produce malformazioni fetali scheletriche e grossolane esterne a dosi orali di 16 mg/kg e 50 mg/kg che erano tossiche per il coniglio. Studi in conigli francesi Hy/Cr con dosi orali fino a 32 mg / kg / die non hanno confermato questo risultato. Non sono state osservate malformazioni nei ratti trattati con Inamrinone per via endovenosa alla dose massima utilizzata, 15 mg / kg / die (approssimativamente la dose giornaliera raccomandata per via endovenosa per i pazienti con insufficienza cardiaca congestizia). Non ci sono studi adeguati e ben controllati in donne in gravidanza. Inamrinone deve essere usato durante la gravidanza solo se il potenziale beneficio giustifica il potenziale rischio per il feto.
Madri che allattano
Si deve usare cautela quando Inamrinone viene somministrato a donne che allattano, poiché non è noto se sia escreto nel latte materno.
Uso pediatrico
La sicurezza e l’efficacia nei pazienti pediatrici non sono state stabilite.
Reazioni avverse
Trombocitopenia: L’iniezione endovenosa di Inamrinone ha determinato riduzioni della conta piastrinica al di sotto di 100.000/mm3 o limiti normali nel 2,4% dei pazienti.
È più comune nei pazienti che ricevono una terapia prolungata. Ad oggi, in studi clinici strettamente monitorati, in pazienti la cui conta piastrinica non è stata autorizzata a rimanere depressa, non sono stati osservati fenomeni emorragici.
La riduzione piastrinica è dose-dipendente e appare a causa di una diminuzione del tempo di sopravvivenza piastrinica. Diversi pazienti che hanno sviluppato trombocitopenia durante il trattamento con Inamrinone sono stati sottoposti a esami del midollo osseo che sono risultati normali. Non ci sono prove che collegano la riduzione piastrinica alla risposta immunitaria o ad un fattore di attivazione piastrinica.
Effetti gastrointestinali: Le reazioni avverse gastrointestinali riportate con Inamrinone durante l’uso clinico hanno incluso nausea (1,7%), vomito (0,9%), dolore addominale (0,4%) e anoressia (0,4%).
Effetti cardiovascolari: Le reazioni avverse cardiovascolari riportate con Inamrinone includono aritmia (3%) e ipotensione (1,3%).
Tossicità epatica: Nei cani, a dosi IV comprese tra 9 mg / kg / die e 32 mg/kg/die, Inamrinone ha mostrato epatotossicità dose-correlata manifestata sia come aumento degli enzimi che come necrosi delle cellule epatiche o entrambi. Nell ‘uomo è stata osservata epatotossicità dopo somministrazione orale a lungo termine ed è stata osservata, in un’ esperienza limitata (0,2%), dopo somministrazione endovenosa di Inamrinone. Ci sono state anche rare segnalazioni di aumento degli enzimi e della bilirubina e ittero.
Ipersensibilità: Sono state segnalate diverse reazioni di ipersensibilità apparente in pazienti trattati con Inamrinone orale per circa due settimane. Segni e sintomi erano variabili ma includevano pericardite, pleurite e ascite (1 caso), miosite con ombreggiatura interstiziale sulla radiografia del torace e velocità di sedimentazione elevata (1 caso) e vasculite con densità polmonare nodulare, ipossiemia e ittero (1 caso). Il primo paziente è morto, non necessariamente della possibile reazione, mentre gli ultimi due si sono risolti con l’interruzione della terapia. Nessuno dei casi è stato riesaminato in modo che l’attribuzione a Inamrinone non sia certa, ma eventuali reazioni di ipersensibilità devono essere prese in considerazione in qualsiasi paziente mantenuto per un periodo prolungato con Inamrinone.
Generalità: Ulteriori reazioni avverse osservate negli studi clinici con Inamrinone per via endovenosa comprendono febbre (0,9%), dolore toracico (0,2%) e bruciore nel sito di iniezione (0,2%).
Gestione delle reazioni avverse
Riduzione della conta piastrinica: La riduzione asintomatica della conta piastrinica (a <150.000/mm3) può essere invertita entro una settimana da una diminuzione del dosaggio del farmaco. Più ulteriormente, con nessun cambiamento nel dosaggio della droga, il conteggio può stabilizzarsi ai livelli più bassi del pre-farmaco senza alcune sequele cliniche. Si raccomanda la conta piastrinica pre-farmaco e la conta piastrinica frequente durante la terapia per aiutare nelle decisioni riguardanti le modifiche del dosaggio.
Se si verifica una conta piastrinica inferiore a 150.000 / mm3, possono essere prese in considerazione le seguenti azioni:
• Mantenere la dose totale giornaliera invariata, poiché in alcuni casi la conta si è stabilizzata o è tornata ai livelli di pretrattamento. * Diminuire la dose giornaliera totale. * Interrompere Inamrinone se, a giudizio clinico del medico, il rischio supera il potenziale beneficio.
Effetti collaterali gastrointestinali: Mentre gli effetti collaterali gastrointestinali sono stati osservati raramente con la terapia endovenosa, se si verificano gravi o debilitanti, il medico potrebbe voler ridurre il dosaggio o interrompere il farmaco in base alle solite considerazioni beneficio-rischio.
Tossicità epatica: Nell ‘ esperienza clinica fino ad oggi con somministrazione endovenosa, è stata osservata raramente epatotossicità. Se si verificano alterazioni acute marcate degli enzimi epatici insieme a sintomi clinici che suggeriscono una reazione di ipersensibilità idiosincratica, la terapia con Inamrinone deve essere immediatamente interrotta.
Se si verificano alterazioni enzimatiche meno marcate senza sintomi clinici, queste alterazioni non specifiche devono essere valutate su base individuale. Il clinico può desiderare continuare Inamrinone, ridurre il dosaggio, o interrompere la droga basata sulle considerazioni usuali di rischio/beneficio.
Sovradosaggio
È stato riportato un decesso con un sovradosaggio accidentale massiccio (840 mg in tre ore in bolo iniziale e infusione) di Inamrinone, sebbene la relazione causale sia incerta. Durante la preparazione e la somministrazione del prodotto deve essere esercitata diligenza.
Le dosi di Inamrinone possono produrre ipotensione a causa del suo effetto vasodilatatore. Se ciò si verifica, la somministrazione di Inamrinone deve essere ridotta o interrotta. Non è noto alcun antidoto specifico, ma devono essere prese misure generali per il supporto circolatorio.
Nei ratti, la LD50 di Inamrinone, come sale lattato, era 102 mg/kg o 130 mg/kg per via endovenosa in due diversi studi e 132 mg/kg per via orale (intragastrica); come sospensione in tragacanto gengivale acquoso la LD50 orale era 239 mg / kg.
Dosaggio e somministrazione di Inamrinone
Le dosi di caricamento dell’iniezione di Inamrinone devono essere somministrate come fornite (non diluite). Le infusioni di Inamrinone possono essere somministrate in soluzione salina normale o metà normale ad una concentrazione da 1 mg/mL a 3 mg/mL. Le soluzioni diluite devono essere utilizzate entro 24 ore.
L’iniezione di Inamrinone può essere somministrata nelle infusioni correnti di destrosio (glucosio) attraverso un connettore a Y o direttamente nel tubo dove è preferibile.
Interazioni chimiche
Un’interazione chimica si verifica lentamente per un periodo di 24 ore quando la soluzione endovenosa di Inamrinone viene miscelata direttamente con soluzioni contenenti destrosio (glucosio). PERTANTO, Inamrinone NON DEVE ESSERE DILUITO CON SOLUZIONI CHE CONTENGONO DESTROSIO (GLUCOSIO) PRIMA DELL’INIEZIONE.
Si verifica immediatamente un’interazione chimica, che è evidenziata dalla formazione di un precipitato quando la furosemide viene iniettata in una linea endovenosa di un’infusione di Inamrinone. Pertanto, furosemide non deve essere somministrata in linee endovenose contenenti Inamrinone.
La seguente procedura è raccomandata per la somministrazione di iniezione di Inamrinone:
1. Iniziare la terapia con una dose di carico di 0,75 mg/kg somministrata lentamente nell’arco di 2-3 minuti.
|
LOADING DOSE DETERMINATION 0.75 mg/kg (undiluted) |
||||||||||
|
Patient Weight in kg |
||||||||||
|
mL of undiluted Inamrinone Injection |
||||||||||
2. Continue therapy with a maintenance infusion between 5 mcg/kg/min and 10 mcg/kg/min.
3. Based on clinical response, an additional loading dose of 0.75 mg/kg may be given 30 minutes after the initiation of therapy.
4. La velocità di infusione varia solitamente da 5 mcg / kg / min a 10 mcg/kg/min in modo tale che la dose giornaliera totale raccomandata (comprese le dosi di carico) non superi i 10 mg / kg. Un numero limitato di pazienti studiati a dosi più elevate supporta un regime posologico fino a 18 mg/kg/die per una durata ridotta della terapia.
La seguente tabella della velocità di infusione può essere utilizzata per assicurare che i calcoli siano eseguiti correttamente.
Per utilizzare il grafico, la concentrazione della soluzione per infusione di Inamrinone utilizzata deve essere di 2,5 mg/mL (2500 mcg/mL). Questa concentrazione viene preparata miscelando la soluzione di Inamrinone con un volume uguale di diluente (soluzione salina normale o metà normale).
| * Diluizione: per preparare la concentrazione di 2,5 mg / ml raccomandata per infusione miscelare Inamrinone con un volume uguale di diluente. Ad esempio, miscelare tre flaconcini da 20 ml di Inamrinone (3 x 20 mL = 60 mL) con 60 ml di diluente per un volume totale di 120 mL della soluzione finale da 2,5 mg/mL di Inamrinone. | ||||||||||
|
Inamrinone IV INFUSION RATE (mL/hr) CHART Using 2.5 mg/mL Infusion Concentration* |
||||||||||
|
Patient Weight in kg |
||||||||||
|
Dosage: 5.0 mcg/kg/min |
||||||||||
|
7.5 mcg/kg/min |
||||||||||
|
10.0 mcg/kg/min |
||||||||||
Example: A 70 kg patient would require a loading dose of 10.5 mL of undiluted Inamrinone. If the physician selects a dose of 7.5 mcg / kg / min per l’infusione, la portata sarebbe di 13 ml/ora alla concentrazione di 2,5 mg/mL di Inamrinone.
5. La velocità di somministrazione e la durata della terapia devono essere aggiustate in base alla risposta del paziente. Il medico può decidere di ridurre o titolare l’infusione verso il basso in base alla reattività clinica o agli effetti indesiderati.
Ci si può aspettare che i regimi posologici sopra riportati collochino la concentrazione plasmatica di Inamrinone della maggior parte dei pazienti a circa 3 mcg/mL. Gli aumenti dell’indice cardiaco mostrano una relazione lineare con la concentrazione plasmatica di un intervallo di 0.5 mcg / ml a 7 mcg / mL. Non sono state effettuate osservazioni a concentrazioni plasmatiche maggiori.
Il miglioramento del paziente può essere riflesso da un aumento della gittata cardiaca, una riduzione della pressione del cuneo capillare polmonare e risposte cliniche come una diminuzione della dispnea e un miglioramento di altri sintomi di insufficienza cardiaca, come ortopnea e affaticamento.
Il monitoraggio della pressione venosa centrale (CVP) può essere utile nella valutazione dell’ipotensione e della gestione dell’equilibrio dei liquidi. Per ottenere una risposta soddisfacente con Inamrinone è essenziale una correzione o una regolazione preventiva del fluido/elettroliti.
I farmaci parenterali devono essere ispezionati visivamente e non devono essere utilizzati se si osserva particolato o scolorimento.
Come viene fornito Inamrinone
Inamrinone Injection USP viene fornito in flaconcini monodose da 20 mL sterili, soluzione di colore giallo chiaro confezionati singolarmente. NDC 55390-042-10.
Ogni 1 ml contiene Inamrinone lattato equivalente a 5 mg di Inamrinone.
Proteggere dalla luce. L’imballaggio è resistente alla luce per la protezione durante lo stoccaggio. Conservare in scatola fino al momento dell ‘ uso.
Conservare a temperatura ambiente controllata da 15 ° a 30 ° C (da 59° a 86°F).
Manufactured by: Manufactured for:
Ben Venue Laboratories, Inc. Bedford Laboratories™
Bedford, OH 44146 Bedford, OH 44146
August 2002 AMR-P01
VIAL LABEL

Vial Label 100 mg/20 mL
| Inamrinone Inamrinone injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Bedford Laboratories (884528407)
Registrant – Ben Venue Laboratories (004327953)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Ben Venue Laboratories Inc. | 004327953 | MANUFACTURE(55390-042) | |
More about inamrinone
- Side Effects
- During Pregnancy
- Dosage Information
- Drug Interactions
- Drug class: inotropic agents
Related treatment guides
- Heart Failure
Medical Disclaimer