Forma di dosaggio: Iniezione
Medicamente recensito da Drugs.com. Ultimo aggiornamento il 22 maggio 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Interactions
- More
FOR USE IN NERVE AGENT POISONING ONLY
A Sterile Solution For Intramuscular Use Only
Rx Only
- Pralidoxime Chloride Description
- Pralidoxima cloruro – Farmacologia clinica
- Indicazioni e utilizzo per Pralidoxime Chloride
- Controindicazioni
- Avvertenze
- Precauzioni
- Generale:
- Informazioni per i pazienti:
- Prove di laboratorio:
- Interazioni farmacologiche:
- Carcinogenesi, Mutagensis, Compromissione della fertilità:
- Gravidanza
- Madre che allatta:
- Uso pediatrico:
- Reazioni avverse
- Abuso e dipendenza da droghe
- Sovradosaggio
- Manifestazioni di sovradosaggio:
- Trattamento del sovradosaggio:
- Acute Toxicity:
- Pralidoxime Cloruro di Dosaggio e Amministrazione
- Istruzioni per l’uso:
- Come viene fornito il cloruro di Pralidoxime
- le Principali Display del Pannello – Pralidoxime Cloruro di Iniezione, 300mg Etichetta
- Ulteriori informazioni su pralidoxime
- risorse per i Consumatori
- risorse Professionali
- relativo trattamento guide
Pralidoxime Chloride Description
Pralidoxime Chloride Injection (auto-injector) provides Pralidoxime Chloride in a sterile solution for intramuscular injection.
Ogni autoiniettore precompilato fornisce una dose dell’antidoto, cloruro di Pralidoxima in un’unità autonoma, appositamente progettata per l’auto-amministrazione automatica o buddy da parte del personale militare. Pralidoxima nell ‘autoiniettore può essere somministrato anche da personale civile qualificato che ha ricevuto un addestramento adeguato nel riconoscimento in loco e nel trattamento dell’ intossicazione da agente nervino in caso di rilascio accidentale di agente nervino. La procedura raccomandata (vedere DOSAGGIO E SOMMINISTRAZIONE) consiste nell’iniettare il contenuto dell’autoiniettore nei muscoli di una coscia esterna.
Dopo che un autoiniettore è stato attivato, il contenitore vuoto deve essere smaltito correttamente (vedere DOSAGGIO E SOMMINISTRAZIONE), non può essere riempito nuovamente né l’ago sporgente può essere retratto.
Quando attivato, ogni autoiniettore eroga 600 mg di Pralidoxima cloruro in 2 ml di una soluzione sterile contenente 20 mg/mL di alcool benzilico, 11,26 mg/mL di glicina in acqua per preparazioni iniettabili, USP. Il pH viene regolato con acido cloridrico. L’intervallo di pH è 2.0-3.0. Il prodotto è privo di pirogeni.
La pralidoxima cloruro è un riattivatore della colinesterasi.
Nome chimico: cloruro di 2-formil-1 metilpiridinio ossima (metocloruro di piridina-2-aldossima). Indicato anche come cloruro 2-PAM.
Formula strutturale:
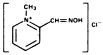
Il cloruro di pralidoxima si presenta come polvere cristallina inodore, bianca, non igroscopica, solubile in acqua nella misura di 1 g in meno di 1 mL. Stabile all’aria, si scioglie tra 215°C e 225°C, con decomposizione.
L’attività specifica del farmaco risiede nello ion metilpiridinio 2-formil-1 ed è indipendente dal particolare sale impiegato. Il cloruro è preferito a causa della compatibilità fisiologica, dell’idrosolubilità eccellente a tutte le temperature e dell’alta potenza per grammo, dovuto il suo peso molecolare basso (173).
Pralidoxima cloruro – Farmacologia clinica
Pralidoxima cloruro è un riattivatore della colinesterasi.
L’azione principale di pralidoxima consiste nel riattivare la colinesterasi (principalmente al di fuori del sistema nervoso centrale) che è stata inattivata dalla fosforilazione dovuta ad un pesticida organofosfato o ad un composto correlato. La distruzione dell’acetilcolina accumulata può quindi procedere e le giunzioni neuromuscolari funzioneranno di nuovo normalmente. Pralidoxime rallenta anche il processo di” invecchiamento ” della colinesterasi fosforilata in una forma non riattivabile e disintossica alcuni organofosfati per reazione chimica diretta. Il farmaco ha il suo effetto più critico nell’alleviare la paralisi dei muscoli della respirazione. Poiché pralidoxime è meno efficace nell’alleviare la depressione del centro respiratorio, l’atropina è sempre necessaria in concomitanza per bloccare l’effetto dell’acetilcolina accumulata in questo sito. Pralidoxime allevia segni e sintomi muscarinici, salivazione, broncospasmo, ecc., ma questa azione è relativamente poco importante poiché atropine è adeguato con questo scopo.
La pralidoxima è distribuita in tutta l’acqua extracellulare, non è legata alle proteine plasmatiche. Il farmaco viene rapidamente escreto nelle urine in parte invariato e in parte come metabolita prodotto dal fegato. Di conseguenza, pralidoxima ha una durata d’azione relativamente breve e possono essere necessarie dosi ripetute, specialmente quando vi è evidenza di un continuo assorbimento del veleno.
La concentrazione terapeutica minima di pralidoxima nel plasma è di 4 µg/mL, questo livello viene raggiunto in circa 16 minuti dopo una singola iniezione di 600 mg di Pralidoxima cloruro. L’emivita apparente di Pralidoxima cloruro è di 74-77 minuti.
È stato riportato che l’uso supplementare di riattivatori della colinesterasi ossima (come pralidoxima) riduce l’incidenza e la gravità dei difetti dello sviluppo negli embrioni di pulcini esposti a teratogeni noti come paration, bidrin, carbachol e neostigmina. Questo effetto protettivo degli ossimi si è dimostrato correlato alla dose.
Indicazioni e utilizzo per Pralidoxime Chloride
Questo autoiniettore per Pralidoxime Chloride è specificamente indicato per uso intramuscolare in aggiunta all’atropina nel trattamento dell’avvelenamento da agenti nervosi con attività anticolinesterasica.
Controindicazioni
L’autoiniettore di Pralidoxima cloruro è controindicato nei pazienti che sono ipersensibili a qualsiasi componente del prodotto.
Avvertenze
La pralidoxima non è efficace nel trattamento dell’avvelenamento dovuto a fosforo, fosfati inorganici o organofosfati che non hanno attività anticolinesterasica.
Precauzioni
Generale:
La pralidoxima è stata molto ben tollerata nella maggior parte dei casi, ma va ricordato che le condizioni disperate del paziente avvelenato da organofosfato generalmente mascherano segni e sintomi minori come sono stati osservati nei soggetti normali.
Poiché pralidoxima viene escreto nelle urine, una diminuzione della funzionalità renale comporterà un aumento dei livelli ematici del farmaco. Pertanto, il dosaggio di pralidoxime deve essere ridotto in presenza di insufficienza renale.
Informazioni per i pazienti:
L’autoiniettore di cloruro di Pralidoxima deve essere auto-somministrato o buddy da personale militare o somministrato da personale civile qualificato di pronto intervento solo dopo che si sono verificati i seguenti eventi:
– l’individuo ha indossato la maschera dopo aver riconosciuto l’esistenza di un pericolo di agenti chimici nella sua zona – alcuni o tutti i sintomi di avvelenamento da agenti nervini citati di seguito sono presenti: inspiegabile naso che cola oppressione toracica con difficoltà nella respirazione individuati gli alunni dell’occhio con conseguente visione offuscata, scialorrea, sudorazione eccessiva, nausea, vomito e crampi addominali involontaria la minzione e la defecazione spasmi, contrazioni, e sconcertante mal di testa, sonnolenza, coma, convulsioni, arresto della respirazione
misure Appropriate devono essere adottate per assicurare che il personale è dotato di auto-iniettori capire le loro indicazioni e utilizzo, compreso l’esame dei sintomi di avvelenamento e di funzionamento dell’auto-iniettore.
Prove di laboratorio:
Il trattamento dell’avvelenamento da organofosfato deve essere istituito senza attendere i risultati dei test di laboratorio. Le misurazioni dei globuli rossi, della colinesterasi plasmatica e del paranitrofenolo urinario (in caso di esposizione a parationi) possono essere utili per confermare la diagnosi e seguire il decorso della malattia. Una riduzione della concentrazione di colinesterasi dei globuli rossi al di sotto del 50% del normale è stata osservata solo con avvelenamento da estere organofosfato.
Interazioni farmacologiche:
Quando atropina e pralidoxima sono usati insieme, i segni di atropinizzazione (vampate di calore, midriasi, tachicardia, secchezza della bocca e del naso) possono verificarsi prima di quanto ci si possa aspettare quando atropina viene usata da sola. Ciò è particolarmente vero se la dose totale di atropina è stata elevata e la somministrazione di pralidoxima è stata ritardata.2, 3, 4
Le seguenti precauzioni devono essere tenute a mente nel trattamento dell’avvelenamento da anticolesterinasi, sebbene non sopportino direttamente l’uso di pralidoxima; poiché i barbiturici sono potenziati dalle anticolinesterasi, devono essere usati con cautela nel trattamento delle convulsioni; morfina, teofillina, aminofillina, succinilcolina, pino di riserva e tranquillanti di tipo fenotiazinico devono essere evitati nei pazienti con avvelenamento da organofosfato.
Carcinogenesi, Mutagensis, Compromissione della fertilità:
Poiché l’autoiniettore di Pralidoxima cloruro è indicato solo per uso di emergenza a breve termine, il produttore non ha condotto né riportato in letteratura indagini sul suo potenziale di carcinogenesi, mutagenesi o compromissione della fertilità.
Gravidanza
Non sono stati condotti studi sulla riproduzione animale con pralidoxima. Non è inoltre noto se pralidoxime possa causare danni al feto quando somministrato a una donna incinta o possa influire sulla capacità riproduttiva. Pralidoxime deve essere somministrato a una donna incinta solo se chiaramente necessario.
Madre che allatta:
Non è noto se questo farmaco sia escreto nel latte materno. Poiché molti farmaci sono escreti nel latte umano, si deve usare cautela quando pralidoxime viene somministrato a una donna che allatta.
Uso pediatrico:
La sicurezza e l’efficacia nei bambini non sono state stabilite.
Reazioni avverse
Da quaranta a 60 minuti dopo l’iniezione intramuscolare, si può avvertire dolore da lieve a moderato nel sito di iniezione.
Pralidoxime può causare visione offuscata, diplopia e con problemi di alloggio, vertigini, mal di testa, sonnolenza, nausea, tachicardia, aumento della pressione arteriosa sistolica e diastolica, iperventilazione, e debolezza muscolare quando somministrato per via parenterale normale volontari che non sono stati esposti a anticholinesterase veleni. Nei pazienti è molto difficile differenziare gli effetti tossici prodotti dall’atropina o dai composti organofosfati da quelli del farmaco.
Sono stati osservati aumenti dei livelli enzimatici di SGOT e / o SGPT in 1 su 6 volontari normali trattati con 1200 mg di Pralidoxima Cloruro per via intramuscolare, e in 4 volontari su 6 trattati con 1800 mg per via intramuscolare. I livelli sono tornati alla normalità in circa 2 settimane. Sono stati osservati aumenti transitori della creatinfosfochinasi in tutti i volontari normali trattati con il farmaco. Una singola iniezione intramuscolare di 330 mg in 1 mL nei conigli ha causato mionecrosi, infiammazione ed emorragia.
Quando atropina e pralidoxima sono usati insieme, i segni di atropinizzazione possono verificarsi prima di quanto ci si possa aspettare quando atropina viene usata da sola. Ciò è particolarmente vero se la dose totale di atropina è stata elevata e la somministrazione di pralidoxima è stata ritardata.2, 3, 4 Eccitazione e comportamento maniacale immediatamente dopo il recupero della coscienza sono stati riportati in diversi casi. Tuttavia, un comportamento simile si è verificato nei casi di avvelenamento da organofosfato che non sono stati trattati con pralidoxime.3, 5, 6
Abuso e dipendenza da droghe
Il cloruro di Pralidoxima non è soggetto ad abuso e non possiede alcun potenziale noto di dipendenza.
Sovradosaggio
Manifestazioni di sovradosaggio:
Osservate solo in soggetti normali: capogiri, visione offuscata, diplopia, mal di testa, alterazione della sistemazione, nausea, leggera tachicardia. Nella terapia è stato difficile differenziare gli effetti collaterali dovuti al farmaco da quelli dovuti agli effetti del veleno.
Trattamento del sovradosaggio:
La respirazione artificiale e altre terapie di supporto devono essere somministrate secondo necessità.
Acute Toxicity:
i.v.—man TDLo: 14 mg/kg (toxic effects: CNS) i.v.— rat LD50: 96 mg/kg i.m.—rat LD50: 150 mg/kg oral—mouse LD50: 4100 mg/kg i.p.—mouse LD50: 155 mg/kg i.v.—mouse LD50: 90 mg/kg i.m.—mouse LD50: 180 mg/kg i.v.—rabbit LD50: 95 mg/kg i.m.—guinea pig LD50: 168 mg/kg
Pralidoxime Cloruro di Dosaggio e Amministrazione
l’Esposizione ad agenti nervini in possesso di anticholinesterase attività (organofosfati tipo)
LIEVE CASO il mal di testa, visione offuscata, lieve muscarinici segni
MODERATAMENTE GRAVE CASO di eccessiva sudorazione, lacrimazione, salivazione, diarrea, senso di oppressione al petto
ottimale Per la riattivazione di organofosfati inibito colinesterasi, atropina e pralidoxime dovrebbe essere somministrato il più presto possibile dopo l’esposizione. A seconda della gravità dei sintomi, somministrare immediatamente un autoiniettore contenente atropina, seguito da un autoiniettore contenente pralidoxima. Atropina deve essere somministrata prima fino a quando i suoi effetti diventano evidenti e solo successivamente deve essere somministrata pralidoxima. Se i sintomi dell’agente nervino sono ancora presenti dopo 15 minuti, ripetere le iniezioni. Se i sintomi esistono ancora dopo altri 15 minuti, ripetere le iniezioni per la terza volta. Se dopo la terza serie di iniezioni, i sintomi rimangono, non dare più antidoti ma cercare aiuto medico.
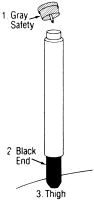
Istruzioni per l’uso:
Quando, come descritto sopra, è indicato l’uso dell’autoiniettore, procedere come segue:
|
 |
MOLTO GRAVE CASO — Cianosi, difficoltà Respiratoria, Coma
le prime misure dovrebbero includere la rimozione delle secrezioni, la manutenzione di un brevetto delle vie aeree e, se necessario, la ventilazione artificiale. L’atropina non deve essere utilizzata fino a quando la cianosi non è stata superata poiché l’atropina produce fibrillazioni ventricolari in presenza di ipossia. Morfina, teofillina, aminofillina o succincilcolina sono controindicati. I tranquillanti del tipo reserpina o fenotiazina devono essere evitati.
“Pralidoxime è più efficace se somministrato immediatamente dopo l’avvelenamento. Generalmente, poco si ottiene se il farmaco viene somministrato più di 36 ore dopo la cessazione dell’esposizione. Quando il veleno è stato ingerito, tuttavia, l’esposizione può continuare per qualche tempo a causa del lento assorbimento dall’intestino inferiore e sono state riportate ricadute fatali dopo un miglioramento iniziale. La somministrazione continuata per diversi giorni può essere utile in questi pazienti. Una stretta supervisione del paziente è indicata per almeno 48-72 ore. Se si è verificata l’esposizione cutanea, gli indumenti devono essere rimossi e i capelli e la pelle lavati accuratamente con bicarbonato di sodio o alcool il prima possibile. Il diazepam può essere somministrato con cautela se le convulsioni non sono controllate dall’atropina.”7
IMPORTANTE: I MEDICI E / O ALTRO PERSONALE MEDICO CHE ASSISTE LE VITTIME EVACUATE DI AGENTI NERVINI, DOVREBBERO EVITARE DI ESPORSI ALLA CONTAMINAZIONE DA INDUMENTI DELLE VITTIME.
Come viene fornito il cloruro di Pralidoxime
Il cloruro di Pralidoxime viene fornito in soluzione acquosa preriempita nell’autoiniettore (600 mg, 2 ml) per uso militare e per l’uso da parte di soccorritori civili qualificati. Auto-iniettori sono forniti attraverso la Direzione di materiale medico, Difesa Supply Center Philadelphia o altri analoghi locali, statali o federali agenzia.
Quando attivato, ogni autoiniettore eroga 600 mg di Pralidoxima cloruro in 2 ml di una soluzione sterile contenente 20 mg/mL di alcool benzilico, 11,26 mg/mL di glicina in acqua per preparazioni iniettabili, USP. Il pH viene regolato con acido cloridrico. Il pH è 2.0 – 3.0 Il prodotto è privo di pirogeni.
Conservare a 25°C (77 ° F); Escursioni consentite a 15-30°C (59-86°F).
Evitare il congelamento.
Meridian Medical Technologies, Inc.
Columbia, MD 21046
A Pfizer Company
00001976
08/16
Stampato negli Stati Uniti
- Landauer, W.: tetrogeni colinomimetici. V. L’effetto degli ossimi e dei relativi riattivatori della colinesterasi, Teratologia 15: 33 (Feb.) 1977.
- Moller, K. O., Jenson-Holm, J., e Lausen, S. H.: Ugeskr. Laeg.123:501, 1961.
- Namba, T., Nolte, C. T., Jackrel, Jr., e Grob, D.: Avvelenamento a causa di insetticidi organofosfati. Manifestazioni acute e croniche, Amer. J. Med. 50: 475 (Apr.) 1971.
- Arena, J. M.: Avvelenamento. Tossicologia. Sintomatologia. Trattamenti, ed. 4, Springfield, Ill., Charles C. Thomas, 1979, p. 133.
- Brachfeld, J. e Zavon, M. R.: Intossicazione da fosfato organico (Fosdrin®). Relazione del caso e dei risultati del trattamento con 2-PAM, Arch. Ambiente. Salute 11: 859,1965.
- Hayes, W. J., Jr.: Toxicology of Pesticides, Baltimore, The Williams & Wilkins Company, 1975, p. 416.
- Dipartimento di Droga AMA: Valutazioni di droga AMA, ed. 4, Chicago, American Medical Association, 1980, p. 1455.
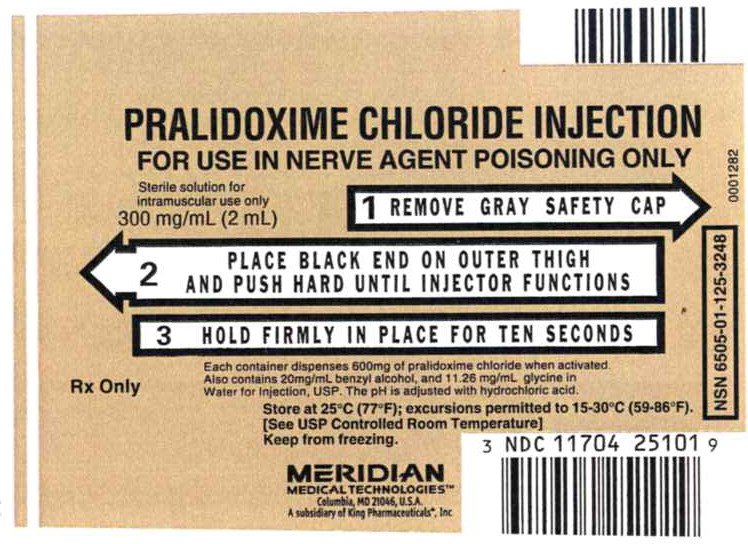
le Principali Display del Pannello – Pralidoxime Cloruro di Iniezione, 300mg Etichetta
NDC 11704-107-01
Pralidoxime Cloruro di INIEZIONE
PER UTILIZZARE al NERVO AGENTE di AVVELENAMENTO da SOLO
soluzione Sterile per uso intramuscolare solo
300 mg/mL (2 mL)
1 RIMUOVERE GRIGIO TAPPO di SICUREZZA
2 POSTO FINALE NERO SULL’ESTERNO COSCIA E SPINGERE FINO INIETTORE FUNZIONI
3 TENERE SALDAMENTE IN posizione PER DIECI SECONDI
Ogni contenitore dispensa 600mg di Pralidoxime Cloruro quando attivato.
Contiene anche 20 mg/ml di alcool benzilico e 11.26 mg/mL di glicina in
Acqua per preparazioni iniettabili, USP. Il pH viene regolato con acido cloridrico.
Solo Rx
Conservare a 25°C (77 ° F); escursioni consentite a 15-30°C (59-86°F).
Evita il congelamento.
MERIDIAN MEDICAL TECHNOLIGIESTM
Columbia, MD 21046, USA
A subsidiary of King Pharmaceuticals®, Inc
NDC 11704-251-01
NSN 6505-01-125-3248
| Pralidoxime Chloride Pralidoxime Chloride injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Meridian Medical Technologies, Inc. (167671341)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Meridian Medical Technologies, Inc. | 038889234 | MANUFACTURE(11704-251), ANALYSIS(11704-251) | |
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Meridian Medical Technologies, Inc. | 078808315 | MANUFACTURE(11704-251), LABEL(11704-251), PACK(11704-251) | |
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Meridian Medical Technologies, Inc. | 167671341 | MANUFACTURE(11704-251), LABEL(11704-251), PACK(11704-251), ANALYSIS(11704-251) | |
Ulteriori informazioni su pralidoxime
- Effetti collaterali
- Durante la gravidanza
- Informazioni sul dosaggio
- Interazioni farmacologiche
- En Español
- Classe di farmaci: antidoti
- FDA Avvisi (1)
risorse per i Consumatori
- Informazioni Paziente
- Pralidoxime Iniezione (Avanzate di Lettura)
risorse Professionali
- la Prescrizione di Informazione;
- Pralidoxime (Professional Paziente di Consulenza)
Altre marche Protopam Cloruro
relativo trattamento guide
- Anticholinesterase Overdose
- Avvelenamento da Organofosfati
- Nervo Agente di Avvelenamento
Disclaimer Medico