Introduzione
Le perdite d’aria polmonari prolungate sono comuni e possono causare un alto livello di morbilità, soggiorni ospedalieri prolungati, complicanze infettive e cardiopolmonari.1,2
Sebbene vi sia una variazione tra diversi autori nella loro definizione di perdite d’aria, recenti studi sulla lobectomia polmonare hanno stabilito una durata media approssimativa della degenza ospedaliera di 5 giorni; e quindi è stato proposto che una perdita d’aria persistente dovrebbe essere definita come una perdita d’aria che dura oltre il quinto giorno postoperatorio.3 In realtà, questo è coerente con la definizione del database della Society of Thoracic Surgeons, che si riferisce alle perdite d’aria persistenti come quelle che tipicamente si presentano quando il paziente sarebbe altrimenti dimesso se non fosse per la continua perdita d’aria.
La stragrande maggioranza delle perdite d’aria postoperatorie sono perdite d’aria alveolari; questo è rilevante poiché la gestione di queste è molto diversa dalla gestione della fistola broncopleurale che spesso richiede un intervento chirurgico immediato.3
Il fattore di rischio più costantemente identificato per perdite d’aria prolungate è la malattia polmonare ostruttiva cronica,4 un basso volume espiratorio forzato al 1 ° secondo e una bassa percentuale massima di ventilazione volontaria.5,6
Le opzioni di trattamento delle perdite d’aria prolungate includono l’attesa vigile con drenaggio continuo attraverso un tubo toracostomico,6 pleurodesi, procedure chirurgiche,2 nonché l’uso di tecniche endoscopiche.
Gli approcci endobronchiali includono l’applicazione di gelfoam, l’uso di colla di fibrina, bobine o valvole endobronchiali.1,7 Generalmente l’inflazione del catetere a palloncino viene utilizzata per identificare le vie aeree segmentali o sub-segmentali o le vie aeree responsabili della perdita d’aria.8 Schweigert et al.9 ha riportato un metodo diverso utilizzando blu di metilene attraverso i tubi del torace. Descriviamo un caso di una perdita d’aria persistente trattata con posizionamento delle valvole endobronchiale in segmenti identificati usando il blu di metilene attraverso il tubo toracico.
Case report
Un maschio di 68 anni presentava tosse, perdita di peso e una massa polmonare nel lobo medio destro (ML).
Era un ex fumatore con una storia di fumo di 45 anni e durante la sua vita professionale era stato esposto all’amianto per molti anni. La sua precedente storia medica includeva una prostatectomia dovuta a cancro alla prostata 6 anni prima senza alcuna prova di recidiva.
Un adenocarcinoma polmonare è stata diagnosticata da transtoracica aspirazione con ago biopsia della ML lesione e la tomografia ad emissione di positroni–tomografia computerizzata (PET/CT) scansione eseguita per la messa in scena, ha rivelato fluorodesossiglucosio (FDG) assorbimento non solo sulla ML di massa (massimo standardizzata, il valore di assorbimento (SUVmax)-11), ma anche il diritto pleura, che ha portato a ulteriori pleurico indagini con biopsie multiple che era negativo per cellule maligne. È stato messo in scena T2N0M0 ed è stato sottoposto a intervento chirurgico
È stata eseguita una toracotomia con lobectomia centrale destra, che includeva la divisione del legamento triangolare più una linfoadenectomia sistematica e, poiché durante la procedura sono state trovate placche pleuriche, sono state rimosse e una decorticazione pleurica del lobo inferiore destro è stata eseguita.
La patologia ha confermato un adenocarcinoma pT1bN0R0, senza evidenza di coinvolgimento maligno pleurico, ma è stata diagnosticata anche una pleurite fibrinosa cronica.
L’estubazione del paziente è stata possibile subito dopo l’intervento e non è stata necessaria la ventilazione meccanica postoperatoria. La kinesioterapia, che è un intervento di routine e ampiamente riconosciuto volto a migliorare l’espansione polmonare, è stata avviata il prima possibile.
Sebbene l’espansione polmonare sia stata raggiunta entro 2 giorni, è stata identificata una perdita d’aria e l’aspirazione necessaria per mantenere l’espansione polmonare è stata continuata per altri dieci giorni fino a quando non si è verificata alcuna perdita d’aria visibile durante la normale respirazione di marea. A questo punto, l’aspirazione è stata interrotta e i tubi sono stati bloccati dopo 2 giorni. Poiché non vi era alcun compromesso clinico, nessun peggioramento del pneumotorace né alcun aumento dell’aria sottocutanea, il tubo toracico è stato rimosso (Fig. 1) e il paziente è stato dimesso dall’ospedale entro 48h.
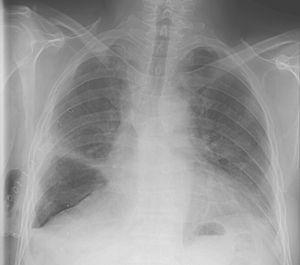
Radiografia del torace il 12 ° giorno dopo la lobectomia midle destra e 24 ore dopo la rimozione del tubo toracico.
Due settimane dopo la dimissione dall’ospedale – 1 mese dopo l’intervento chirurgico – è stato riammesso con i sintomi clinici dell’infezione toracica. Una TAC al torace ha mostrato un grande hidropneumotorace anteriore destro, spessore pleurico ed enfisema sottocutaneo. Sono stati diagnosticati un empiema e una perdita d’aria postoperatoria. Sono stati avviati antibiotici ad ampio spettro, è stato immediatamente messo in atto un tubo toracico e una broncofibroscopia utilizzata per valutare l’integrità del moncone e l’assenza di altre complicanze endobronchiale. Nonostante queste misure, il paziente è stato sottoposto a decorticazione pleuro-polmonare, complicata da fitte aderenze pleuriche. Durante la procedura è stata eseguita la sutura delle lacerazioni polmonari e lo spray Tissucol® utilizzato per controllare le perdite d’aria. Sebbene lo stato di salute clinica e i parametri di infezione siano inizialmente migliorati, il paziente ha avuto una perdita d’aria persistente con un pneumotorace asintomatico stabile sulla tenuta dell’acqua che aumentava ogni volta che l’aspirazione negativa veniva sospesa e il drenaggio del torace veniva lasciato in drenaggio libero.
L’attesa vigile con drenaggio continuo attraverso un tubo toracico è stata mantenuta per 2 mesi, durante quel periodo, fino a quando la perdita d’aria sembrava essere risolta e il paziente poteva tollerare che lo scarico venisse bloccato; una pleurodesi di talco attraverso il tubo toracico è stata tentata senza risultati soddisfacenti.
È stato provato un approccio endoscopico per gestire la perdita d’aria. Un catetere a palloncino introdotto attraverso il broncoscopio è stato gonfiato su diversi segmenti mentre l’osservazione del sistema di drenaggio toracico ha valutato la perdita d’aria. Una riduzione della perdita d’aria sembrava essere raggiunta quando i segmenti B7 e B8 del lobo inferiore destro erano occlusi e le valvole (Zephyr EBV) erano posizionate in questi segmenti. Le valvole endobronchiale sono state messe in posizione utilizzando un catetere flessibile. Le valvole sono state compresse nella punta distale del catetere di mandata utilizzando un caricatore di valvole fornito con il sistema. Il catetere di consegna è stato quindi fatto passare attraverso il canale di lavoro di un broncoscopio adulto standard (>2,8 mm di diametro interno) e guidato verso le vie aeree target. Una volta sul posto la valvola è stata dispiegata. Tuttavia, questo ha raggiunto solo una riduzione della perdita d’aria.
Tre settimane dopo (4 mesi dopo l’intervento chirurgico iniziale) è stata eseguita una toracomioplastica utilizzando un lembo retto addominale per obliterare lo spazio pleurico e le valvole endobronchiale sono state rimosse. Tre settimane dopo questo intervento successivo è stato possibile bloccare e rimuovere il tubo toracico senza peggioramento clinico o radiologico.
Sfortunatamente due settimane dopo il paziente è stato riammesso con distress respiratorio e pneumotorace, quindi un tubo toracico è stato rimesso e tenuto sotto aspirazione (Fig. 2). Il paziente non era clinicamente idoneo per un intervento chirurgico, quindi è stato tentato di nuovo un approccio endoscopico.

TAC toracica che mostra cavità pleurica con un tubo toracico all’interno e ispessimento pleurico.
Questa volta, l’instillazione di blu di metilene (1 fiala diluita in soluzione salina da 1 litro) attraverso il tubo toracico è stata utilizzata per localizzare il segmento bronchiale che porta alla fistola. Mentre la soluzione blu veniva instillata, un altro medico guardava attraverso il broncoscopio e osservava la soluzione blu che appariva sui segmenti che portavano alla fistola. I segmenti B6 e B7 sono stati identificati visivamente (Fig. 3) e le valvole endobronchiali sono state messe in atto come descritto sopra.
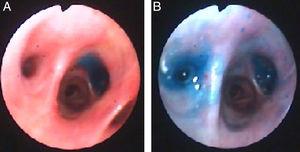
Blu di metilene sul segmento B7 (pannello A) e B6 (Pannello B) del lobo inferiore destro dopo instillazione attraverso il tubo toracico.
Dopo la procedura la dimensione della perdita d’aria sembrava essere ridotta ed è stato tentato il bloccaggio. Poiché non vi era evidenza di peggioramento del pneumotorace, progressivo sviluppo di aria sottocutanea o dispnea, il tubo toracico è stato rimosso.
Lo stato di salute del paziente è lentamente migliorato ed è stato dimesso dall’ospedale. Al follow-up, sono state trovate metastasi su entrambi i polmoni e il paziente è morto 8 mesi dopo.
Discussione
Gli autori descrivono un caso di perdita d’aria persistente dopo resezione polmonare. Le perdite d’aria sono un problema comune spesso associato a soggiorni ospedalieri prolungati, complicanze infettive e cardiopolmonari e occasionalmente richiedono reintervento3 e/o tecniche broncoscopiche.
Il paziente presentato presentava diversi fattori di rischio per lo sviluppo di una perdita d’aria poiché aveva una broncopneumopatia cronica ostruttiva,10 e di particolare rilevanza in questo caso, la presenza di significative aderenze pleuriche.5,11 È molto probabile che le aderenze pleuriche fossero legate alla sua nota esposizione all’amianto durante l’età adulta.
Le opzioni di trattamento delle perdite d’aria includono l’attesa vigile, le procedure chirurgiche e la terapia medica come la pleurodesi, e in particolare l’uso di diverse tecniche di broncoscopia come colle, bobine e sigillanti. Il successo è stato variabile e non sembra esserci una terapia ottimale. Gli attuali possibili interventi sembrano essere complementari e il trattamento dovrebbe essere individualizzato.7 Non esistono studi controllati che confrontino i diversi approcci.
Nel caso in esame, la prima opzione era una procedura chirurgica perché era necessaria una toracotomia per controllare l’infezione che non rispondeva agli antibiotici e per il drenaggio attraverso il tubo toracico. Durante l’intervento è stato fatto un tentativo di chiudere il sito della perdita d’aria e lo spray Tissucol® è stato utilizzato, tuttavia è persistito anche dopo un periodo di attesa di diverse settimane.
È stata quindi tentata una pleurodesi chimica. L’instillazione di un agente sclerosante nello spazio pleurico attraverso il tubo toracostomico promuove la sinfisi pleurica, che potrebbe portare alla chiusura di perdite,12 ma come mostrato in letteratura non è stato molto efficace.
La presenza di empiema postoperatorio in cui la decorticazione è fallita e la presenza di fistole bronchiali sono attualmente considerate indicazioni per le procedure di toracomioplastica.13 Consente l’obliterazione completa e definitiva dello spazio pleurico infetto mediante una combinazione di toracoplastica e l’uso di lembi muscolari vicini (gran dorsale, serrato anteriore, pettorale, retto addominale, ecc.).
Questo è accaduto in questo caso ma, anche se recenti pubblicazioni mostrano un tasso di successo complessivo del 90%, con una guarigione rapida e definitiva, è stato efficace solo nel controllare l’infezione non la fistola.
Gli approcci broncoscopici alla gestione delle perdite d’aria polmonari sono diventati più popolari non solo come strumenti diagnostici ma anche come terapeutici.
Per gestire con successo una fistola con tecniche broncoscopiche, la fistola deve essere visualizzata direttamente (fistole prossimali) e dovrebbero esserci prove che l’occlusione sia diminuita significativamente o che la perdita d’aria si sia fermata. La tecnica più comunemente utilizzata per localizzare il segmento bronchiale che porta alle fistole distali è l’uso di palloncini, come il catetere Swan-Ganz, per occludere sistematicamente i segmenti bronchiali8 con osservazione simultanea del sistema di drenaggio toracico per valutare la perdita d’aria. Questo metodo può rivelarsi impegnativo nei pazienti con piccole perdite d’aria che sono presenti solo quando tossiscono e non durante la normale respirazione del volume di marea.
anche se il blu di metilene è stato utilizzato per diagnosticare la presenza di fistole per molti anni, da instillazione attraverso il moncone e se rilevato nel tubo toracico può confermare un brochopleural fistola, il suo uso per individuare il bronchiale segmento leader per la fistola è stato descritto solo in 2011.9 il blu di Metilene è stato utilizzato tramite il tubo toracico e immediatamente dopo l’instillazione, se una fistola era presente; il blu di metilene potrebbe essere visto dal broncoscopista sul segmento bronchiale che porta alla fistola.
Nel nostro paziente l’uso del blu di metilene ha permesso l’identificazione di due segmenti bronchiali coinvolti nella perdita d’aria, uno comune a quello identificato con il metodo del palloncino ma anche uno diverso insospettito dalla tecnica precedente.
Dopo l’identificazione del segmento bronchiale, si potrebbero prendere in considerazione approcci multipli tra cui l’applicazione di gelfoam, l’uso di colla di fibrina, il posizionamento della bobina, gli stent e le valvole endobronchiale.7 Non esistono studi controllati per determinare quale di questi sia il più efficace o il più sicuro. Travaline et al.1 ha mostrato che l’impianto di valvole unidirezionali endobronchiale (Zephyr EBV) è stato efficace per un gran numero di pazienti con perdite d’aria prolungate. La completa cessazione della perdita d’aria è stata raggiunta nel 48% dei pazienti e la diminuzione della grandezza nel 45%.
In questo caso l’impianto di una valvola Zefir sui segmenti B6 e B7, in associazione con la guarigione e l’ispessimento pleurico, ha ridotto l’entità della perdita d’aria sufficiente per rimuovere il tubo toracico. Questi approcci non chirurgici sembrano promettenti e, per alcuni pazienti possono essere l’unica opzione di trattamento. Gli autori vorrebbero sottolineare l’uso del blu di metilene attraverso il tubo toracico per identificare i segmenti della perdita d’aria persistente e per guidare il posizionamento delle valvole endobronchiale.
Informazioni etiche
Protezione di soggetti umani e animali. Gli autori dichiarano che non sono stati eseguiti esperimenti su esseri umani o animali per questo studio.
Riservatezza dei dati. Gli autori dichiarano di aver seguito i protocolli del loro centro di lavoro sulla pubblicazione dei dati dei pazienti e che tutti i pazienti inclusi nello studio hanno ricevuto informazioni sufficienti e hanno dato il loro consenso informato scritto per partecipare allo studio.