
Sau (Larry) Lee, Ph. D., Vice Direttore dell’Ufficio di Ricerca e Test, e il presidente del Emerging Technology Team, Ufficio di Qualità Farmaceutica, CDER
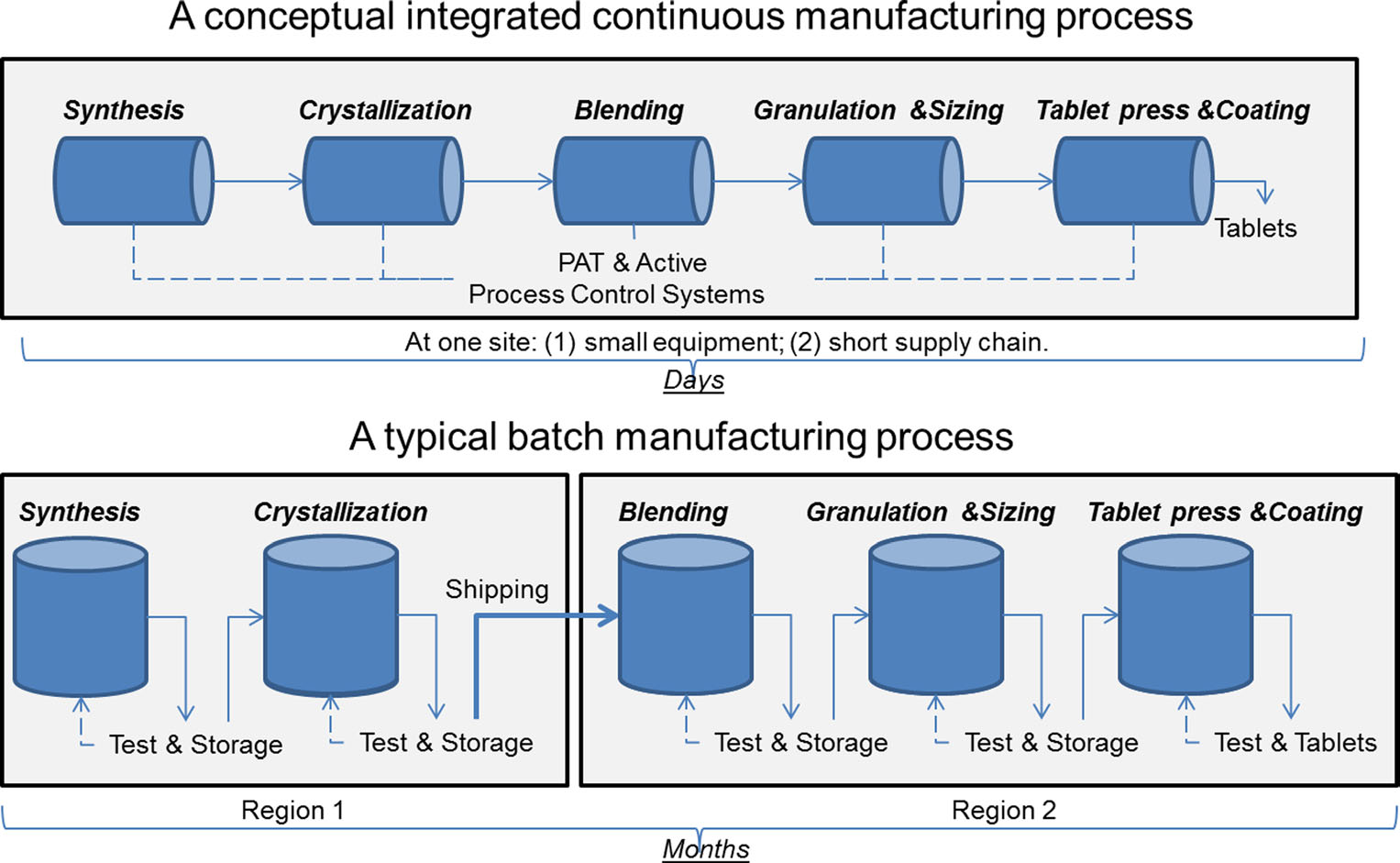 Un confronto tra produzione continua e produzione in serie. Immagine gentilmente concessa da Sau Lee. J. Pharm Innov (2015) 10:191-199.
Un confronto tra produzione continua e produzione in serie. Immagine gentilmente concessa da Sau Lee. J. Pharm Innov (2015) 10:191-199.Per più di 50 anni, i prodotti farmaceutici sono stati prodotti utilizzando un metodo noto come “batch manufacturing”, un processo lungo e multi-step che prevede l’uso di attrezzature sgraziate e su larga scala. Tuttavia, i recenti progressi nella tecnologia di produzione hanno spinto l’industria farmaceutica a considerare di passare dalla produzione in serie a un processo più veloce ed efficiente noto come produzione continua. La FDA sta adottando misure proattive per facilitare l’implementazione delle tecnologie emergenti da parte dell’industria farmaceutica, inclusa la produzione continua, per migliorare la qualità del prodotto e affrontare molte delle cause alla base della carenza di farmaci e dei richiami.
Produzione batch vs produzione continua
La produzione batch comporta più passaggi discreti. Dopo ogni fase del processo, la produzione si interrompe in genere in modo che i campioni possano essere testati offline per la qualità. A volte durante questi “tempi di attesa” tra le fasi, il materiale può essere conservato in contenitori o spedito ad altre strutture in tutto il mondo per completare il processo di produzione. Questo può aggiungere settimane o mesi al tempo di elaborazione. Per alcuni principi attivi che sono sensibili all’ambiente, può anche introdurre il rischio di degradazione. Inoltre, se la domanda di un certo farmaco aumenta, l’aumento della produzione può richiedere attrezzature più grandi. Questo ridimensionamento delle apparecchiature richiede più spazio fisico, un ingombro maggiore e più tempo e denaro.
Al contrario, i prodotti farmaceutici realizzati utilizzando la produzione continua vengono spostati senza sosta all’interno della stessa struttura, eliminando i tempi di attesa tra le fasi. Il materiale viene alimentato attraverso una catena di montaggio di componenti completamente integrati. Questo metodo consente di risparmiare tempo, riduce la probabilità di errore umano e può rispondere in modo più agile ai cambiamenti del mercato. Per tenere conto di una maggiore domanda, la produzione continua può funzionare per un periodo di tempo più lungo, il che può ridurre la probabilità di carenza di farmaci.
Entrambi i tipi di produzione sono soggetti agli stessi standard di controllo della qualità, ma il monitoraggio è automatizzato negli impianti di produzione continua e tende ad essere più frequente rispetto alla produzione in serie. Come tutte le tecnologie, le apparecchiature di produzione continua possono subire usura, ma il monitoraggio automatizzato può rilevare i problemi molto prima che si verifichi un guasto. Tale monitoraggio può anche aiutare a prevedere l’aspettativa di vita di un pezzo di apparecchiatura, portando a una migliore manutenzione proattiva.
Infine, la produzione continua può consentire un tracciamento e una tracciatura più flessibili, il che sarebbe un vantaggio in caso di guasto del prodotto. Ad esempio, nella produzione di lotti, una quantità specifica (o lotto) di un farmaco è definita dalla dimensione dell’apparecchiatura che lo ha prodotto. Nella produzione continua, una quantità (o lotto) può essere delineata da un timestamp, quantità di farmaco prodotto, o la quantità di materiale di input grezzo. Questi metodi di tracciamento consentono al produttore di isolare una quantità minore di materiale difettoso in caso di guasto del processo, il che comporta meno sprechi e minori possibilità di carenza.
Una transizione impegnativa ma utile
Diverse industrie—come le industrie chimiche e petrolchimiche—hanno già subito un’evoluzione produttiva e utilizzano tecnologie continue efficienti per fabbricare prodotti in sicurezza. Ma per l’industria farmaceutica, la transizione alla produzione continua è ancora nelle sue fasi iniziali per diversi motivi. Innanzitutto, i costi di avvio per tale transizione possono essere elevati. Il ritiro delle vecchie apparecchiature in lotti, l’acquisto di nuove tecnologie e la formazione del personale su come utilizzarle e il rinnovamento delle infrastrutture del settore sono costosi, richiedendo un serio impegno da parte di un produttore di farmaci. Tuttavia, le analisi economiche hanno mostrato potenziali significativi risparmi a lungo termine. Inoltre, alcune tecnologie devono ancora maturare prima di essere commercialmente valide. Per alcuni tipi di farmaci, come i prodotti biologici, la tecnologia per produrli mediante produzione continua potrebbe non esistere ancora. La ricerca è in corso per affrontare queste e altre sfide. Inoltre, i produttori di farmaci percepiscono ancora l’incertezza normativa che può ritardare l’approvazione del prodotto quando viene utilizzata una nuova tecnologia di produzione.
Mentre l’industria considera come effettuare il passaggio, la FDA sta fornendo risorse e informazioni per facilitare la transizione. Ad esempio, l’agenzia sta collaborando con la Biomedical Advanced Research and Development Authority, un programma all’interno del Dipartimento della Salute e dei servizi umani degli Stati Uniti, per aiutare a finanziare e sostenere la ricerca in questo settore. Stiamo anche formando il nostro staff di revisione e conducendo ricerche interne sulle aree di rischio associate alla produzione continua, in modo da poter valutare meglio le tecnologie correlate.
Guido un team multidisciplinare nell’ambito del programma Emerging Technology nell’Ufficio di qualità farmaceutica di CDER. Il programma è stato istituito per aiutare l’industria a implementare tecnologie innovative per migliorare la qualità del prodotto e modernizzare il settore, nel tentativo di affrontare le cause alla base della carenza di farmaci o richiami. Il programma Emerging Technology affronta non solo le tecnologie di produzione continua, ma anche altri progressi come la stampa 3D, nuove forme di dosaggio e nuovi sistemi di contenitori. Nell’ambito di questo programma, ci impegniamo con l’industria nelle prime fasi del processo di sviluppo di nuove tecnologie e discutiamo eventuali questioni normative o scientifiche previste che potrebbero far parte di un’applicazione futura.
Molte aziende hanno applicato al programma Emerging Technology per quanto riguarda il loro interesse per la produzione continua. Il documento della FDA intitolato, Avanzamento delle applicazioni tecnologiche emergenti per modernizzare la guida di base di produzione farmaceutica per l’industria fornisce informazioni e consigli su come lavorare con l’agenzia nelle prime fasi del processo di sviluppo.
Per saperne di più sugli sforzi della FDA per modernizzare la produzione di farmaci nel blog vocale della FDA.