はじめに
大動脈壁内血腫(IMH)は、急性大動脈症候群(AAS)に含まれるいくつかの状態の一つです。1,2形態学的には、内膜-内側裂傷がない場合に大動脈壁の媒体層への出血を特徴とし、これは大動脈内腔との通信ではないことを意味する。 いくつかの著者は、IMHは大動脈脈管の自発的な破裂の結果であることを示唆している。 臨床的に疑われるAASを有する患者におけるIMHの頻度は、症例の5%から20%の範囲である。2-4
古典的な大動脈解離と同様に、IMHはスタンフォード分類に従って、上行大動脈の関与がある場合のA型と、上行大動脈に影響がない場合のB型に区別される。
現在、タイプA IMHの治療は本質的に外科的であることが認められているが、タイプBは最初に医学療法で治療することができ、合併症が追加された 死亡の主な独立した予測因子は、大動脈径>50mmおよび上行大動脈の関与である。5
この病気の自然史および影響を受けた患者のための最も適切な処置に関してまだある不確実性があります。 古典的には、血腫の解離進行を制限し、心膜滲出液を有する患者の心タンポナーデを避けるために、主に二つの理由のためにAAS患者の抗凝固を避けるこ
本研究の目的は、臨床的および放射線学的特徴、ならびに入院中に抗凝固治療を受けたIMH患者のサブグループの進化を記述することである。
方法
2000年から2005年にかけてAASの診断を受けて当院に入院したすべての患者は、前向きに評価されました。 これらの患者の中で,IMHを有し,入院中に抗凝固療法を受けていたすべての患者を選択した。 人口統計学的情報だけでなく、臨床、放射線、およびフォローアップデータがコンパイルされました。
AASの診断は、コントラスト増強の有無にかかわらず、コンピュータ断層撮影(CT)スキャンによって確立された。 その後のフォローアップ画像研究は、C Tおよび/または磁気共鳴(MR)を用いて行った。
研究されたすべての患者は、この治療に禁忌があった場合を除いて、すべての症例においてβ遮断薬を含む血圧の厳密な制御(BP≥120/80mm Hg)に向け
結果
研究期間中、AASと診断された95人の患者が私たちのセンターに入院しました。 トゥエルブ(25.これらの患者の6%)はIMH(4タイプAおよび8タイプB)を提示した。 入院中に抗凝固療法を受けたIMH患者(A型IMHとB型IMHの2人)がこの報告の対象となっている。
抗凝固を受けたIMH患者の臨床的特徴および主な人口統計情報を以下に記載し、表に示す。/P>
ケース1
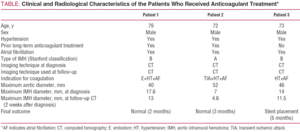
薬理学的治療および慢性心房細動にもかかわらず、制御されていない高血圧を有する79歳の男性。 患者の臨床歴には、5年前に右上肢の動脈塞栓症のエピソードが含まれており、これは経口抗凝固療法で治療されていた。 肩甲間部に突然発症した激しい痛みのために入院したが,腹部に放射され,多量の発汗とめまいを伴っていた。 緊急ユニットで行われたコンピュータ断層撮影では、左鎖骨下動脈の原点から大動脈分岐まで伸びたB型IMHが同定され、左総腸骨動脈の最初の数センチメートルに影響を与えた(図1)。 アドミタンス時に潅流によりラベタロールとニトロプルシドで治療し,抗凝固を中止した。 この治療の中止に続いて、患者は塞栓術を必要とする左上肢の動脈塞栓症の新しいエピソードを提示した。 このため、最初はヘパリンナトリウムで、後にアセノクマロールで抗凝固が確立された。
図1。患者1におけるB型大動脈壁内血腫(IMH)の放射線学的進化。 肺動脈分岐部の連続C tスライスは病変の厚さと最終的な解像度の進行性の減少を示した。 A:診断の時のIMHの厚さ。 B:最初のCTフォローアップ(進化の2週間)での厚さ。 C:2か月のIMHの厚さ。
ケース2
薬理学的治療の下で長い進化の高血圧を持つ72歳の男性、および彼はジゴキシンとアセノクマロールを受けていた慢性心房細動の病 彼は背中に放射突然発症の圧迫的な中胸痛のために私たちのセンターに来ました。 最初のCTでは上行大動脈,大動脈弓,下行大動脈が上腸間膜動脈の起源に関与するA型IMHを示した。 抗凝固は中止された。 入院中,患者は左片麻ひを伴う意識喪失のエピソードを提示し,その後後遺症なしに回復した。 脳CTでは虚血や頭蓋内出血の徴候はなく,塞栓起源の一過性虚血発作と解釈された。 この合併症により,入院中にアセノクマロールによる潅流中ヘパリンナトリウムによる抗凝固治療を再開した。
ケース3
慢性腎不全と長い進化の高血圧の歴史を持つ73歳の男性、喫煙者; 慢性心房細動を呈し,抗血小板療法を受けていた。 患者は両脇腹に放射する重度の肩甲間痛のために当院に来た。 初回CTで下行胸部大動脈に限局したb型壁内血腫と診断した。 血腫の遠位部分では、血腫内に涙形の画像(潰瘍様の投影)が見られた(図2)。 塞栓症のエピソードはなかったが,塞栓リスクプロファイルが高いため,入院時に抗凝固療法を開始した。
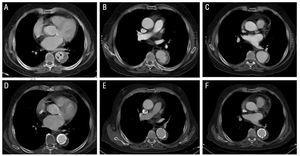
図2。 患者3におけるB型大動脈壁内血腫(IMH)の放射線学的進化。 上部パネル:診断時の画像(A)およびフォローアップ中の画像(BおよびC)。 A:IMH(矢印)内の涙形の画像(潰瘍のような投影)を観察します。 B:フォローアップの間の集中させた解剖(2か月後)。 C:大動脈径の進行性拡張。 下部パネル:診断後5ヶ月後の画像(D-F)。 血腫の進行性の拡張は、二つのステントの移植を指示します。
放射線学的フォローアップ
診断時の最大大動脈径および最大IMH径、ならびに各患者における病変の進化を表に示す。
放射線学的フォローアップでは、すべての患者はIMH厚さの緩やかな減少を示した。 患者1および2では、診断時のIMHの最大直径はそれぞれ17.6および7mmであった。 2週間のCTフォローアップ研究では、直径はそれぞれ13および4.6mmであった。
患者3では、IMHの厚さは、最初のCTでは14mm、フォローアップスキャンでは11.5mmでした。 さらに、患者はIMHの遠位端に涙形の画像を提示し、これは4×?を測定した。?診断時に6mm。 一部の著者は、これを大動脈潰瘍(潰瘍様突起)を示す徴候と解釈している。 病院の退院後、患者は2つのステント(Excluder34×の注入を必要とした影響を受けた大動脈セグメント(pseudoaneurysm)のその後の進行性拡張と局所解剖を開発しましたか??10mmと40??×10ミリ)。 その後の進化は良好であった(図2)。
議論
研究期間中、IMH患者3人は抗凝固療法を受けた。 IMHは出血性病変であるにもかかわらず,抗凝固が与えられたにもかかわらず,フォローアップ放射線評価における病変サイズの進行性退行を伴う臨床的および形態学的進化は患者のこのサブグループで良好であった。 患者3は、初期病変が貫通性大動脈潰瘍(PAU)であった可能性がある大動脈のセグメントにおけるフォローアップ中に合併症を発症した。 それにもかかわらず、血腫は最初に他の二つの患者に見られるものと同様の変化を受け、急性期の間に直径が徐々に減少した。 抗凝固が病因に果たしている可能性があり、偽動脈瘤への進化は確立することは困難である。
AAS患者における抗凝固の使用に関する科学文献には決定的なデータはないが、この治療の中止は一般的な慣行である。 抗凝固はIMHの自然経過を変化させない可能性が高い。 三つの引数は、この仮説をサポートしています: a)止血が病変の病因に大きな役割を持たないことを考えると、その解決に影響を与える可能性は低い;b)IMHは大動脈壁の内部に限定された状態であり、血管内腔と接触していないため、抗凝固剤が病変に浸透する可能性は低い;c)疫学的研究では、止血成分の先天性または後天性障害を有する患者におけるIMHの発生率が高いことは示されていない。
我々は、抗凝固が必要な状況(塞栓症のリスクが高い患者)では、抗凝固がIMHの臨床的または形態学的進化に影響を与えなかったこの研究の結果に基づ 当然のことながら、決定的な結論を引き出すためには、より大きな患者シリーズを用いたさらなる研究が必要である。