Rhizobiumと植物パートナー間の宿主特異的相互作用
α-およびβ-プロテオバクテリアの多様なグループに属するマメ科植物と窒素固定共生を形成する細菌を総称してrhizobiaと呼ぶ(Chen et al. 2003年;マックリーンet al., 2007). 多くのα-プロテオバクテリアは、高等真核生物との長期的な相互作用に従事している。 これらの相互作用は、表面の植民地化から通性共生関係を経て、細胞内病原体または内共生生物のライフスタイルを偏性化するまでの範囲である。 根茎形成,宿主細胞感染,窒素固定に必要な共生遺伝子は,根茎の遺伝的多様性の主要な源である側方遺伝子移入によって獲得されている。 したがって、根茎恐怖症は、互いによりも病原体(AgrobacteriumまたはBrucellaなど)とより密接に関連している可能性がある。 Rhizobiaは大きなゲノムを持つ傾向があります(最大10。急速に成長している根茎は、複数のレプリコン上に分散されている(MacLean et al., 2007). 例えば、Sinorhizobium meliloti、Medicago種のendosymbiontは、3.65Mbp染色体と2つのmegaplasmids、pSymAとpSymB(1.35と1.68Mbp)の両方が不可欠であり、共生遺伝子の大部分を持っています。 しかしながら、多くのS.meliloti株は、さらなる補助中サイズのプラスミドを含有し、したがって、S.melilotiゲノムは、最大9,0 0 0個の遺伝子を含有し得る(Barnett e t a l. ら、2 0 0 1;Capela e t a l., 2001). Rhizobiaとは対照的に、昆虫の偏性内共生体は、通常、宿主の必要性を満たすものを含むいくつかの特定の生合成経路のためのそれらの乗算とコードを確実にする強く減少した(160-450Kbp)ゲノムを有する(Moran et al. 2008年、Price et al., 2011). それにもかかわらず、これらの信じられないほど減少したゲノムは、倍数体DNA含量で減少したゲノムを補償する増幅される。
rhizobiaの植物パートナーはマメ科/マメ科の家族に属します。 窒素固定共生はいくつかの系統で進化してきましたが、すべてのマメ科植物が共生を形成するわけではありません。 これまでに12,000の結節性マメ科植物が知られており、それぞれが独自のRhizobiumパートナー(複数可)を持っています。 共生は根圏の細菌の十億からRhizobiumパートナーを選ばなければならないホストの植物の窒素の飢餓によって誘発されます。 これは、化学誘引物質として作用するが、最も重要なのはRhizobium結節遺伝子の誘導物質として作用する根からのフラボノイド信号分子の分泌によって達成される(Oldroyd、2013)。 これらの遺伝子は、細菌のシグナル分子の産生に必要とされる; 宿主植物における結節発生プログラムを誘発するNod因子(Nfs)(Walker and Downie,2 0 0 0)。 NFsは、LysM型ホスト受容体によって認識され、結節の発生と細菌感染の両方に必要とされる末端糖残基と特徴的な脂質鎖上のホスト特異的置換を運ぶlipochitooligosaccharide分子 興味深いことに、陸上植物とアーバスキュラー菌根菌(A M)真菌との古代の共生は、類似しているが異なるLysm型受容体によってNfsとして認識されるMyc因子であ、2012年;Oldroyd、2013年)。 Myc因子とNFsは共通のシグナル伝達経路を活性化するが、植物に保存されている共通の共生遺伝子の関与の後、経路は逸脱する。
植物の感染と結節の形成は複雑なプロセスです; Nod因子は、結節の器官形成および根毛感染において明確な役割を果たす。 さらに、Nod因子の他に、種々の細菌表面多糖類が、効率的な感染のために重要である(Fraysse e t a l., 2003). ほとんどのマメ科植物では、rhizobiaは原形質膜の陥入によって増殖の細菌を含み、根の皮質の方に育つ伝染の糸(IT)が形作られる根毛によってホストに入 感染の頻度が低く、古代のモードは、特定のマメ科植物の根の表面に亀裂を介して発生します。
決定的および不確定結節の開発
結節の開発は、バクテロイド中の酸素感受性ニトロゲナーゼ酵素の機能のための中央ゾーンで微好気状態を提 宿主細胞増殖の一過性および持続性の性質に依存して、結節は、決定型または不確定型のいずれかであり得る(Terpolilli e t a l. ら、2 0 1 2;Kondorosiら、2 0 1 3;Kondorosiら、, 2013). 決定的な結節は分裂組織を有さず、共生細胞の均質な集団を含む。 確定結節は、例えば、phaseolus vulgarisおよびLotus japonicus根に発生する。
逆に、活性な細胞分裂は不確定な結節で維持される。 結節分裂組織は、新しい細胞の一定の生成によって連続的な成長と細長い結節形状を引き起こす頂端領域(ゾーンI)に存在する。 分裂組織を離れる細胞はもはや分裂せず、分化期に入る。 感染糸は細菌を水中細胞に放出し、感染ゾーン(ゾーンII)の12-15細胞層に沿って徐々に分化し、結節ゾーンIIIにおける窒素固定共生細胞の発達につながる(図1;Franssen et al., 1992). Medicago sativa、M.truncatula、Vicia sativa、およびPisum sativumは、不確定な結節を形成する植物の例である。
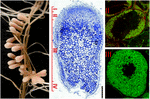
図1. S.meliloti-M.truncatula共生において形成された窒素固定根結節の構造。 異なる結節ゾーンは、縦結節セクションに示されている:(I)分裂組織、(II)感染ゾーン、(III)窒素固定ゾーン、(IV)老化ゾーン。 ゾーンIIの共生細胞は分化したエンドシンビオンを含み、ゾーンIIIでは宿主細胞質は長い窒素固定バクテロイドで完全に充填されている。 Syto9で染色されたEndosymbiontsは緑色の蛍光を持っています。
共生細胞の成長は、内挿複製サイクルによる宿主ゲノムの増幅を伴う
極端な植物細胞の拡大は、決定された結節と不確定な結節の両方で観察することができる。 窒素固定共生細胞の細胞質は約50,000バクテロイドを宿主とする。 このような多数の内因性シンビオンを収容するために、宿主細胞は増殖する。 M.truncatula結節では、窒素固定細胞の体積は、二倍体分裂組織細胞のそれよりも80倍大きい。 感染細胞の増殖は、ゾーンIIで段階的に起こり、有糸分裂のないゲノムの反復内挿複製(ER)の結果である。 ゾーンIIでは、細胞周期機構は依然として活性であるが、有糸分裂サイクリンの欠如は有糸分裂を阻害し、有糸分裂周期を内重複周期に変換する(Cebolla et al., 1999). これは、有糸分裂サイクリンの破壊によって、ゲノム重複の反復ラウンドを誘導し、徐々に成長する倍数体細胞の形成をもたらす細胞周期スイッチCCS52A ら,2 0 0 3;KondorosiおよびKondorosi,2 0 0 4)。 Medicago種では、倍数性レベルは、一倍体細胞と比較して64倍高いDNA含有量を表す64Cに達することができる(Cは一倍体DNA含有量に対応する;Vinardell et al., 2003). M.truncatulaにおけるCCS52Aのダウンレギュレーションは、原基形成に影響を与えなかったが、ERサイクルと大きな高度倍数体細胞の形成が結節機能に不可欠であ, 2003). 興味深いことに、A m真菌を含む皮質細胞もまた倍数体であり、また線虫を供給する巨大根細胞である(Favery e t a l., 2002; ジャンル他, 2008). 同様に、昆虫共生細胞は、細胞内内共生体を保有する細菌細胞も大きく倍数体である(Nakabachi et al., 2010). 被子植物では、倍数性が頻繁であり、異なる器官、組織および細胞型における倍数性の特異的な遺伝パターンは、それが宿主細胞の特殊な生理学の主要な源であり得ることを示唆している(Nagl,1976;Edgar et al., 2014). 細胞増殖のほかに、複数の遺伝子コピー、染色体凝縮の欠如は、より高い転写および代謝活性に寄与することができる。 しかし、異なる細胞機能と倍数性の関連付けは、ヌクレオソームのアーキテクチャと特定のゲノム領域の活性化または抑制を制御するエピゲノムにも倍数性の影響を示唆している。 したがって、共生細胞の倍数体ゲノム含量は、結節の分化およびほとんどの共生宿主遺伝子の発現のための前提条件であると思われる(Maunoury e t a l., 2010).
窒素固定バクテロイドの異なる運命
それから放出された細菌は、symbiosomesと呼ばれるオルガネラ様構造として宿主細胞質に存在する。 彼らは共生体膜(SM)としても知られているペリバクテロイド膜に囲まれているように細菌は、細胞質との直接接触を持っていません。 バクテロイド、SMおよびそれらの間の空間は、シンビオソームを含む(Catalano e t a l., 2004). その形成中のSMは、その原形質膜の起源を反映し、その組成の後の改変は、宿主−内膜界面で新しい、特殊な役割を開く(Limpens e t a l. ら,2 0 0 9;Ivanov e t a l. ら、2 0 1 2;Brear e t a l. 2013年Sinharoy et al., 2013). バクテロイドは、成長する宿主結節細胞で一定の細胞密度まで増殖し、内共生生活様式および微好気性条件に適応し、窒素固定バクテロイドに成熟する。 しかし、バクテロイドの形態と生理は、様々なマメ科植物で著しく異なる可能性があります。 特定のマメ科植物宿主では、窒素固定バクテロイドは培養細胞と同じ形態を有し、このタイプのバクテロイドは自由生活形態に戻ることができる。 他の関連では、バクテロイドは、不可逆的に倍数体、拡大した、非栽培可能な内共生体に形質転換される。 これらの最終的に分化したバクテロイドは、伸長しても分岐してもよく、自由生細胞よりも5〜1 0倍長く、または宿主に応じて8〜少なくとも2 0倍の増幅 ら,2 0 0 6;Nakabachi e t a l., 2010). バクテロイドの末端分化は、宿主制御され、マメ科の複数の枝で進化し、宿主の優位性およびおそらくより高い共生性能を示す(Oono et al., 2010). 終末バクテロイド分化はS.meliloti–m.truncatula共生において最もよく解明されている。 Mで。 バクテロイドの増殖は、細胞の伸長とendoreduplicationサイクルによる複数のレプリコンの均一な増幅が始まるゾーンIIの途中で停止します。 ゾーンIIとIIIの境界にある2-3の細胞層(ゾーン間と呼ばれる)に沿って、バクテロイドの突然の成長は実質的に最終的なサイズに達することが見えるが、窒素固定はゾーンIIIでのみ行われる。
宿主ペプチドがバクテロイド分化を支配する
マメ科植物の結節トランスクリプトームと可逆的および不可逆的なバクテロイド分化との比較は、バクテロイド分化が末端であった宿主植物のゲノムにのみ存在する数百の小さな遺伝子の存在を明らかにした。 M.truncatulaでは、結節細胞は少なくとも600個の結節特異的共生ペプチド(symPEPs)を産生する。 SYMPEP遺伝子は、S.meliloti感染倍数体共生細胞においてのみ活性化される(Kevei e t a l. ら,2 0 0 2;Mergaert e t a l.,2003),しかし、以前の特定のセット,結節の開発の後の段階の間に他の人. 大部分は、5 0 0以上の遺伝子が、結節特異的システインに富む(NCR)ペプチドをコードする(Mergaert e t a l. ら、2 0 0 3;Alunni e t a l. ら、2 0 0 7;Nallu e t a l., 2014). NCRペプチドは、バクテロイドに標的化され、内共生体へのそれらの送達が遮断されたとき、バクテロイド分化が廃止され、ペプチドがS.melilotiバクテロイドの末端分化に関与していることを実証した(Van d E Velde e t a l., 2010). NCR遺伝子の高い配列の多様性と特徴的な発現パターンは、バクテロイド成熟の異なる段階での機能、作用様式および細菌標的の多様性を示唆している(図2)。 しかし、なぜ宿主細胞はNcrの兵器庫を産生するのですか? このような多様なペプチドレパートリーの利点は何ですか? 宿主と様々な細菌との相互作用に必要ですか? M.truncatulaの共生パートナーはS.melilotiとS.medicaeですが、土壌には両方の種の無数の株の変種があります。 M. truncatulaはまた、NCR遺伝子の数、配列、および発現プロファイル、ならびに異なるS.melilotiおよびS.medicae株とのそれらの共生的相互作用において異なる多くの異なるエコ ら、2 0 1 4;Roux e t a l., 2014). 結節には単一の細菌タイプが含まれていますが、同じ根系上の異なる結節は異なる細菌集団を有する可能性があります。 様々なエンドシンビオンを認識する植物は、ペプチドの株特異的なレパートリーでそれらを操作することが可能である。 これらの相違はホストsymbiontの特定性とそれによりnodulationの効率のための付加的な制御レベルを加えることができる。

M.truncatula結節におけるsymPEP遺伝子の差動発現。 黒シグナル:in situハイブリダイゼーション、青シグナル:トランスジェニック結節におけるsymPEPプロモーター-GUS融合のGUS活性。symPEPsはユニークなペプチドクラスを表しますが、その構造は抗菌ペプチド(AMPs)に似ています。 微生物細胞殺傷活性の広いスペクトルを有するAMPsは、最も頻繁には、細孔形成、膜破壊および微生物細胞の結果としての溶解によるカチオン誘発細胞死 細胞分裂能力がエンドシンビオン分化中に決定的に失われるという事実は、少なくとも特定のsymPEPsが抗菌活性を有することを示している。 合成カチオン性Ncrによる細菌の処理は、実際に、重要なヒトおよび植物病原体を含む種々のグラム陰性およびグラム陽性細菌の迅速かつ効率的な用量依存的排除を引き起こした(Van de Velde et al., 2010; Tiricz et al., 2013). このex-planta殺害効果は微生物膜の透過性と相関していたが、結節細胞の自然環境におけるsymPEPsは細菌膜を透過性化せず、endosymbiontsを殺すことはなかった。 結節中のペプチド濃度は、in vitroアッセイで適用されるものよりも有意に低い可能性が最も高い。 さらに,カチオン性ペプチドはアニオン性ペプチドと中性ペプチドと一緒に同じ細胞内で生成され,数十または数百のペプチドと種々の電荷および疎水性を組み合わせてカチオン性ペプチドの直接殺菌効果を中和する可能性がある。
AMPsまたはAMP様ペプチドの関与は、Rhizobium-マメ科植物の共生にとってユニークではありません。 ゾウムシでは、共生細胞は、細胞分裂を阻害することによって巨大な糸状内共生体の発達を誘発し、細菌の侵入から隣接する昆虫組織を保護する抗菌ペプ, 2011). このシステムでは単一のペプチッドは何百ものsymPEPsと作動し、endosymbiontsとして無数の緊張の変形を催すことができる小節とは違ってobligateの縦に送信されたendosymbiontの微分 アブラムシ-ブフネラ共生では、宿主細胞はまた、メディカゴNCRペプチドに似たシステインリッチペプチド(Bcr)を含む細菌細胞特異的ペプチドを産生するが、これらの共生ペプチドの機能はまだ報告されていない(Shigenobu and Stern、2013)。
NCR247:マルチターゲットホストエフェクターの例
Mのトランスクリプトーム解析。 truncatula結節は、その開発の異なる段階で、結節領域のレーザーマイクロダイセクション、in situハイブリダイゼーション、選択されたペプチドの免疫局在、およびトランスジェニック結節におけるsymPEPプロモーター-レポーター遺伝子融合は、初期の感染から後期窒素固定状態までの共生細胞における個々のペプチドの作用をマッピングすることを可能にする。 NCR2 4 7は、ゾーンIIのより古い細胞層および細菌の細胞分裂が停止し、内共生体の顕著な伸長が生じるゾーン間で発現される(Farkas e t a l., 2014). この小さなカチオン性ペプチドはinvitroで様々な微生物を効果的に殺し,insilico分析はその極端な蛋白質結合能力を示した。 FITC標識されたNCR247は、多数の細菌タンパク質との相互作用が可能であった細菌のサイトゾルに入った。 結合パートナーは、S.meliloti細菌またはバクテロイドを、Strepii/FLAGタグ付きペプチドで処理した後、アフィニティークロマトグラフィーおよびLC−MS/MSとの相互作用パートナーの同定および西部分析によって同定した(Farkas e t a l.,2 0 0 2,1 9 9 4)。, 2014).
インターアクターの一つは、細胞分裂において重要な主要な役割を果たしているFtsZ細胞分裂タンパク質であった。 多くの抗生物質ペプチドが、Ftszとの相互作用を介して殺菌または静菌効果を発揮し、その重合を阻害し、それによって適切なZ環および中隔形成を, 2008). NCR247は、細菌の細胞質からFtsZと共精製され、中隔形成を破壊することが示された。 NCR035は、in vitroでも殺菌効果を示し、NCR247と同じ共生細胞で生産され、これらのペプチドの同時または連続した作用とエンドシンビオン増殖を阻害するための複数のホスト戦略の進化を示す分裂中隔に蓄積する。 別の研究は、Z環機能に必要な遺伝子を含む重要な細胞分裂遺伝子の発現が、NCR2 4 7によって処理された細胞において強く減衰したことを示した(Penterman e t a l., 2014). 致命的以下のNCR2 4 7濃度を有する細菌の前処理は、中隔へのFITC−NCR0 3 5の局在化を廃止し、細胞伸長を誘発した(Farkas e t a l., 2014).
リボソームタンパク質は、最も豊富なNCR247相互作用パートナーであった。 NCR2 4 7は、in vivoおよびin vitroの両方で用量依存的に細菌タンパク質合成を強く阻害することが観察された(Farkas e t a l., 2014). これらの結果は、NCR247ペプチド作用の一つのモードは、細菌細胞とバクテロイドの両方でリボソームに結合していることを示唆した。 興味深いことに,相互作用する蛋白質の変化したパターンと減少した複雑さがバクテロイドで観察された。 したがって、リボソームタンパク質の一般的な発現レベルは、個々のリボソームタンパク質の転写産物の異なる相対的な存在量を有する自由生きている細胞 バクテロイドのリボソーム多様化は、それによって非常に豊富な窒素固定機能の特殊な、エネルギー要求の厳しい生理学をサポートする特定のタンパク質の高度な翻訳に貢献することによって重要な役割を持っている可能性があります。
GroELシャペロンはまた、NCR247の直接相互作用パートナーであった(Farkas et al., 2014). 5つのGroelタンパク質のうち、groel1またはGroel2は生存に十分であり、一方、結節中で高レベルで発現されるGroel1は共生に必須である(Bittner e t a l., 2007). これは、結節遺伝子の完全な活性化およびニトロゲナーゼ複合体の組み立てのために必要である。 GroELは何百もの蛋白質との相互作用によって極度な機能多様性を所有している。 NCR247-Groel1相互作用は、GroELに直接影響を与えることができますが、間接的にもGroEL基板および関連する生物学的プロセスに影響を与えることができます。 Groel1の欠如は深刻な細菌感染と窒素固定結節開発のすべての段階でGroel1の一般的な必要性を示すバクテロイドの維持と分化に影響を与えました。
微生物-宿主相互作用におけるGroELおよび宿主ペプチドの関与は、Rhizobium-マメ科植物の共生にとってユニークではありません。
微生物-宿主相互作用におけるGroELおよび宿主ペプチドの関与は、Rhizobium-マメ科 ゾウムシ共生細胞では、コレオプテリシン-A(ColA)はGroELとも相互作用する(Login et al., 2011). Groelはまた、内シンビオンの維持において重要な役割を果たす(Moran,1 9 9 6;Kupper e t a l., 2014). ほとんどの共生システムはまだ未踏であり、ハイスループットのゲノムとプロテオームツールは最近利用可能であるため、我々は唯一の宿主ペプチドを介した内胚葉分化、同様に宿主細胞のゲノム増幅と最終的に分化した内胚葉が共生の一般的な戦略であることを予測することができます。
結論
共生細菌と病原菌は、これらの相互作用の結果が著しく異なる場合でも、宿主と相互作用し、宿主細胞内で生き残るために同様のアプ 植物および動物は、Mamp(微生物関連分子パターン)の認識時に微生物に対する自然免疫応答を生成することができる。 この知覚は、シグナル伝達カスケードの活性化、および抗菌エフェクターの生産をもたらす。 MなどのAMP様宿主ペプチド。 truncatula NCRのペプチッドかゾウムシのコーラの抗菌ペプチッドはそれにより共生の細胞に細菌の存在を制限するendosymbiontsの乗法そして微分の制御の中枢および多 したがって、宿主生物は、これらのエフェクターペプチドを利用して、選択された微生物侵入者を飼いならし、サービスのために雇う。
利益相反に関する声明
著者らは、この研究は、利益相反の可能性と解釈される可能性のある商業的または財政的関係がない場合に行われたと宣言している。
謝辞
私たちの研究室での作業は、Éva Kondorosiへの欧州研究評議会の”SYM-BIOTICS”高度な助成金(助成金番号269067)とTÁMOP-4.2.2によってサポートされています。A-11/1/KONV-2012-0035欧州連合によってサポートされ、欧州社会基金によって共同融資されました。P>
Abdel-Lateif,K.,Bogusz,D.,And Hocher,V.(2012). Arbuscular菌根菌、rhizobiaおよびFrankiaの細菌との植物の根のendosymbiosesの確立におけるフラボノイドの役割。 植物信号。 行動する。 7, 636–641. ドイ:10.4161/psb。20039
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Alunni, B., Kevei, Z., Redondo-Nieto, M., Kondorosi, A., Mergaert, P., and Kondorosi, E. (2007). Genomic organization and evolutionary insights on GRP and NCR genes, two large nodule-specific gene families in Medicago truncatula. Mol. Plant Microbe Interact. 20, 1138–1148. doi: 10.1094/MPMI-20-9-1138
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Barnett, M. J., Fisher, R. F., Jones, T., Komp, C., Abola, A. P. ら,barloy−Hubler,F.,et a l. (2001). ———– プロク… ナトル アカド サイ… 米国98,9883-9888. ドイ:10.1073/pnas.161294798
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Bittner,A.N.,Foltz,A.,And Oke,V.(2007). Sinorhizobium melilotiの生存率と共生の成功には、5つのgroEL遺伝子のうち1つだけが必要です。 J.Bacteriol. 189, 1884–1889. 土井:10.1128/JB.01542-06
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Brear, E. M., Day, D. A., and Smith, P. M. (2013). Iron: an essential micronutrient for the legume-Rhizobium symbiosis. Front. Plant Sci. 4:359. doi: 10.3389/fpls.2013.00359
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Catalano, C. M., Lane, W. S., and Sherrier, D. J. (2004). Biochemical characterization of symbiosome membrane proteins from Medicago truncatula root nodules. Electrophoresis 25, 519–531. doi: 10.1002/elps.200305711
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Capela,D.,Barloy-Hubler,F.,Gouzy,J.,Bothe,G.,Ampe,F.,Batut,J.,et al. (2001). マメ科植物のsymbiont Sinorhizobium meliloti株1021の染色体配列の解析。 プロク… ナトル アカド サイ… 98,9877-9882 ドイ:10.1073/pnas.161294398
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Cebolla,A.,Vinardell,J.M.,Kiss,E.,Oláh,B.,Roudier,F.,Kondorosi,A.,et al. (1999). 有糸分裂阻害剤ccs52は、植物におけるendoreduplicationと倍数性依存性細胞の拡大のために必要とされます。 EMBO J.18,4476-4484. doi:10.1093/emboj/18.16.4476
CrossRef全文
Chen,W.M.,Moulin,L.,Bontemps,C.,Vandamme,P.,Béna,G.,And Boivin-Masson,C.(2003). Β-プロテオバクテリアによるマメ科植物の共生窒素固定は自然界で広く普及している。 J.Bacteriol. 185, 7266–7272. 土井:10.1128/JB.185.24.7266-7272.2003
CrossRef全文
Edgar,B.A.,Zielke,N.,And Gutierrez,C.(2014). Endocycles:有糸分裂後の細胞増殖のための再発進化の革新。 ナット モル牧師 セル バイオル 15, 197–210. doi:10.1038/nrm3756
Pubmed Abstract|Pubmed Full Text/CrossRef Full Text
Farkas,A.,Maróti,G.,Dürgý,H.,Györgypál,Z.,Lima,R.M.,Medzihradszky,K.F.,et al. (2014). Medicago truncatula共生ペプチドNCR247は、複数のメカニズムを介してバクテロイド分化に貢献しています。 プロク… ナトル アカド サイ… 米国111、5183-5188。 ドイ:10.1073/pnas.1404169111
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Favery, B., Complainville, A., Vinardell, J. M., Lecomte, P., Vaubert, D., Mergaert, P.,et al. (2002). The endosymbiosis-induced genes ENOD40 and CCS52a are involved in endoparasitic-nematode interactions in Medicago truncatula. Mol. Plant-Microbe Interact. 15, 1008–1013. doi: 10.1094/MPMI.2002.15.10.1008
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franssen, H. J., Vijn, I., Yang, W. C., and Bisseling, T. (1992). Developmental aspects of the Rhizobium-legume symbiosis. Plant Mol. Biol. 19, 89–107. doi: 10.1007
CrossRef Full Text
Fraysse, N., Couderc, F., and Poinsot, V. (2003). Surface polysaccharide involvement in establishing the Rhizobium–legume symbiosis. Eur. J. Biochem. 270, 1365–1380. doi: 10.1046/j.1432-1033.2003.03492.x
CrossRef Full Text
Genre, A., Chabaud, M., Faccio, A., Barker, D. G., and Bonfante, P. (2008). Prepenetrationの器具アセンブリはMedicago truncatulaおよびDaucus carota両方の根の皮質内のarbuscular菌根の菌類の植民地化パターンに先行し、予測する。 植物細胞20、1407-1420。 doi:10.1105/tpc。108.059014
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Handler,A.A.,Lim,J.E.,And Losick,R.(2008). 枯草菌における胞子形成中の細胞質分裂のペプチド阻害剤。 モル ミクロビオール 68, 588–599. ドイ:10.1111/j.1365-2958.2008.06173.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ivanov, S., Fedorova, E. E., Limpens, E., De Mita, S., Genre, A., Bonfante, P.,et al. (2012). Rhizobium–legume symbiosis shares an exocytotic pathway required for arbuscule formation. Proc. Natl. Acad. Sci. U.S.A. 109, 8316–8321. doi: 10.1073/pnas.1200407109
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kevei, Z., Vinardell, J. M., Kiss, G. B., Kondorosi, A., and Kondorosi, E. (2002). 結節特異的遺伝子ファミリーによってコードされるグリシンに富むタンパク質は、Medicago sppにおける共生結節の開発の異なる段階に関与している。 モル 植物の微生物が相互作用します。 15, 922–931. ドイ:10.1094/MPMI。2002.15.9.922
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Kondorosi,E.,And Kondorosi,A.(2004). 共生細胞の発達中の後期促進複合体のEndoreduplicationと活性化。 FEBS Lett. 567, 152–157. 土井:10.1016/j.febslet.2004.04.075
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Kondorosi,E.,Mergaert,P.,And Kereszt,A.(2013). エンドシンバイオティクス生命のパラダイム:宿主植物因子によって誘発される根茎細菌の細胞分化。 アンヌ ミクロビオルスコーニのページへのリンク 67, 611–628. doi:10.1146/annurev-micro-092412-155630
CrossRef全文
Kupper,M.,Gupta,S.K.,Feldhaar,H.,And Gross,R.(2014). 微生物-昆虫相互作用におけるシャペロニンGroELの汎用性の高い役割。 フェムスミクロビオルスモーカー レット 353, 1–10. 土井: 10.1111/1574-6968.12390
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Limpens,E.,Ivanov,S.,van Esse,W.,Voets,G.,Fedorova,E.,And Bisseling,T.(2009). メディカゴN2固定シンビオソームはendocytic idマーカー Rab7を取得しますが、液胞アイデンティティの取得を遅らせます。 植物細胞21、2811-2828。 doi:10.1105/tpc。108.064410
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Login,F.H.,Balmand,S.,Vallier,A.,Vincent-Monégat,C.,Vigneron,A.,Weiss-Gayet,M.、ら。 (2011). 抗菌ペプチッドは制御の下で昆虫のendosymbiontsを保ちます。 科学334,362-365. 土井:10.1126/科学。1209728
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
MacLean,A.M.,Finan,T.M.,And Sadowsky,M.J.(2007). マメ科植物の共生窒素固定細菌のゲノム。 植物フィジオール。 144, 615–622. doi:10.1104/pp.107.101634
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Maunoury,N.,Redondo-Nieto,M.,Bourcy,M.,Van de Velde,W.,Alunni,B. ら,laporte,P.,et a l. (2010). 共生細胞とendosymbiontsの分化は、Medicago truncatula結節における二つのトランスクリプトームスイッチに結合されています。 PLoS ONE5:e9519. doi:10.1371/ジャーナル。ポネ0009519
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Mergaert,P.,Nikovics,K.,Kelemen,Z.,Maunoury,N.,Vaubert,D.,Kondorosi,A.,et al. (2003). 保存されたシステインモチーフを持つ小さな、分泌ポリペプチドをコードする300以上の結節特異的遺伝子からなるMedicago truncatulaの新規ファミリー。 植物フィジオール。 132, 161–173. doi: 10.1104/pp.102.018192
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mergaert, P., Uchiumi, T., Alunni, B., Evanno, G., Cheron, A., Catrice, O.,et al. (2006). Eukaryotic control on bacterial cell cycle and differentiation in the Rhizobium-legume symbiosis. Proc. Natl. Acad. Sci. U.S.A. 103, 5230–5235. doi: 10.1073/pnas.0600912103
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Moran, N. A. (1996). 内共生細菌における進化とミュラーのラチェットを加速した。 プロク… ナトル アカド サイ… 93,2873-2878 ドイ:10.1073/pnas.93.7.2873
CrossRef全文
Moran,N.A.,McCutcheon,J.P.,and Nakabachi,A.(2008). 遺伝性細菌の共生のゲノミクスと進化。 アンヌ ジュネット牧師 42, 165–690. ドイ:10.1146/annurev.ジュネット41.110306.130119
CrossRef全文
Nakabachi,A.,Koshikawa,S.,Miura,T.,Miyagishima,S.(2010). Pachypsylla venusta(半翅目)のゲノムサイズ: Psyllidae)とその細菌細胞の倍数性、最小の細胞ゲノムを持つ細胞内mutualistic細菌を保有する共生宿主細胞。 ブル エントモール・エントモール・エント 100,27-33 doi:10.1017/S0007485309006737
Pubmed Abstract|Pubmed Full Text/CrossRef Full Text
Nagl,W.(1976). DNA複製とポリテニーは進化戦略として理解されていた。 261,614-615. doi:10.1038/261614a0
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Nallu,S.,Silverstein,K.A. とができるようになりました。 Medicago truncatulaのアクセッションにおける結節システイン豊富なペプチドの大家族の発散のパターン。 植物J.78、697-705。 土井:10.1111/tpj.12506
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Oldroyd,G.E.(2013). 話す、友人、そして入る:植物の有益な共生関係を促進するシグナル伝達システム。 ナット ミクロビオルスコーニのページへのリンク 11, 252–263. 土井:10.1038/nrmicro2990
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Oono, R., Schmitt, I., Sprent, J. I., and Denison, R. F. (2010). Multiple evolutionary origins of legume traits leading to extreme rhizobial differentiation. New Phytol. 187, 508–520. doi: 10.1111/j.1469-8137.2010.03261.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Penterman, J., Abo, R. P., De Nisco, N. J., Arnold, M. F., Longhi, R., Zanda, M.,et al. (2014). 宿主植物ペプチドは共生の間にSinorhizobiummeliloti細胞周期を制御するための転写応答を誘発する。 プロク… ナトル アカド サイ… 米国111、3561-3566。 ドイ:10.1073/pnas.1400450111
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Price,D.R.,Duncan,R.P.,Shigenobu,S.,And Wilson,A.C.(2011). アブラムシ/buchnera共生インターフェイスでのアミノ酸輸送体のゲノム拡張と差動発現。 モル バイオル エヴォル 28, 3113–3126. 土井:10.1093/molbev/msr140
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Roudier, F., Fedorova, E., Lebris, M., Lecomte, P., Györgyey, J., Abad, P.,et al. (2003). The Medicago species A2-type cyclin is auxin regulated and involved in meristem formation but dispensable for endoreduplication-associated developmental programs. Plant Physiol. 131, 1091–1103. doi: 10.1104/pp.102.011122
CrossRef Full Text
Roux, B., Rodde, N., Jardinaud, M. F., Timmers, T., Sauviac, L., Cottret, L.,et al. (2014). RNAシークエンシングに結合されたレーザーキャプチャマイクロダイセクションを使用して共生根結節における植物および細菌の遺伝子発現の統合解析。 植物J.77、817-837。 土井:10.1111/tpj.12442
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Shigenobu,S.,And Stern,D.L.(2013). アブラムシは、細菌内共生のための新規分泌タンパク質を進化させた。 プロク… バイオル サイ… 280, 20121952. ドイ:10.1098/rspb.2012.1952
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Sinharoy,S.,Torres-Herez,I.,Bandyopadhyay,K.,Kereszt,A.,Pislariu,C.I.,Nakashima,J.,et al. (2013). Symbiosome分化のC2H2転写因子レギュレータは、分泌経路遺伝子Vamp721Aの転写を抑制し、Medicago truncatulaにおけるsymbiosomeの開発を促進します。 植物細胞25、3584-3601。 doi:10.1105/tpc。113.114017
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Terpolilli,J.J., Hood, G. A., and Poole, P. S. (2012). What determines the efficiency of N(2)-fixing Rhizobium-legume symbioses? Adv. Microb. Physiol. 60, 325–389. doi: 10.1016/B978-0-12-398264-3.00005-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tiricz, H., Szûcs, A., Farkas, A., Pap, B., Lima, R. M., Maróti, G.,et al. (2013). Antimicrobial nodule-specific cysteine-rich peptides induce membrane depolarization associated changes in Sinorhizobium meliloti. Appl. Env. Microbiol. 79, 6737–6746. doi: 10.1128/AEM.01791-13
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Van de Velde, W., Zehirov, G., Szatmari, A., Debreczeny, M., Ishihara, H., Kevei, Z.,et al. (2010). Plant peptides govern terminal differentiation of bacteria in symbiosis. Science 327, 1122–1126. doi: 10.1126/science.1184057
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vinardell, J. M., Fedorova, E., Cebolla, A., Kevei, Z., Horvath, G., Kelemen, Z.,et al. (2003). 後期促進複合活性化剤CCS52Aによって媒介Endoreduplicationは、Medicago truncatula結節における共生細胞分化のために必要とされる。 植物細胞15、2093-2105。 doi:10.1105/tpc。014373
Pubmed Abstract|Pubmed Full Text|CrossRef Full Text
Walker,S.A.,And Downie,J.A.(2000). Rhizobium leguminosarum bvのエントリ。 根毛へのviciaeは最小限のNod因子特異性を必要とするが、その後の感染糸の成長にはnodOまたはnodEが必要である。 モル 植物-微生物が相互作用する。13, 54–62. ドイ:10.1094/MPMI。2000.13.7.754
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text