Introduction
光は光合成の駆動力であるが、高い光は日陰を確立する植物の葉の光化学系II(PSII)の有意な光阻害を引き起こす可能性がある(Kitao et al. ら,2 0 0 0;Barth e t a l. ら、2 0 0 1;Krause e t a l. ら、2 0 0 4;Huang e t a l.,2015b,2016b,c). しかし、光阻害されたPSIIは低光で急速に回復する(He and Chow、2003; ZhangおよびScheller,2 0 0 4,Allakhverdiev e t a l. ら、2 0 0 5)、D1タンパク質の速い回転率に起因する(Aro e t a l. ら、1 9 9 3;ZhangおよびScheller、2 0 0 4;Allakhverdiev e t a l., 2005). PSII修復の速度は、PSIまたはPSIIのいずれかを介してATPの合成を阻害すると低下した(Allakhverdiev e t a l.,2005),光損傷PSII複合体の高速修復は、短時間で大量のATPを必要とすることを示しています. 以前の研究では、PSIIの冷却誘起光阻害後、環状電子流(CEF)が低光での回復中に有意に刺激されたことが示された(Huang et al., 2010). 低光でのCEFのこの刺激は、PSIIの迅速な修復のためのATPの合成を増強することが提案された(Huang e t a l., 2010). しかし、PSII光阻害後の低光でのCEF刺激の特定の役割を明らかにするためには、より多くの証拠が必要である。
CEFの間に、NADPHまたはフェレドキシンからの電子はPLASTOQUINONEのプールにPSIのまわりで循環します。 この電子移動はプロトン転座に結合し、チラコイド膜(Δ Ph)を横切ってプロトン勾配を生成する(Shikanai and Yamamoto、2017)。 Atp合成に寄与することに加えて、Δ Phの別の機能は、チラコイド内腔を酸性化することによる光合成電子輸送のダウンレギュレーションである(Sikanai、2014、2016)。 この調節には、2つの異なるメカニズムが含まれています:1つは熱エネルギー散逸にリンクされ、PSIIアンテナからの熱として過剰に吸収された光エネル 他の1つは、Cyt b6/f複合体活性の下方制御であり、PSIへの電子移動速度を制御する(Suorsa e t a l.,2 0 0 9)。 とができると考えられている。 シロイヌナズナを含む被子植物では、PSI環状電子輸送の二つの経路が作動している(Shikanai、2007)。 第一のCEF経路は、アンチマイシンAに感受性のPGR5−/PGRL1依存性経路である(Munekage e t a l. ら,2 0 0 2;Sugimoto e t a l. 他のものは葉緑体NADHデヒドロゲナーゼ様(NDH)複合体に依存している(Burrows et al.,2013)。 ら、1 9 9 8;Schakani e t a l., 1998). PGR5-/PGRL1依存性経路の寄与は、C3植物においてより重要である。 高い光の下で、PGR5−/PGRL1依存性CEFの活性化は、チラコイド内腔の酸性化を誘導し、したがって、高レベルのP7 0 0酸化比をもたらす(Suorsa e t a l. ら,2 0 1 2,2 0 1 6;Konoら,2 0 1 2,2 0 1 6;Konoら, ら,2 0 1 4;Yamoriら,2 0 1 4;Yamoriら,, 2016). 比較すると、低光でのP7 0 0酸化比は、PGR5−/PGRL1依存性CEFの欠乏によってほとんど影響されなかった(Munekage e t a l. ら,2 0 0 2,2 0 0 4;Konoら,2 0 0 3,2 0 0 4;Konoら,, 2014). 中等度のPSII光阻害時に、低光でのCEFの刺激は、P7 0 0酸化比の増加を伴った(Huang e t a l., 2010). しかし、この増加したP700酸化比がCEF刺激によって引き起こされるかどうかは不明である。CEFに加えて、PSII(ETRII)からの電子移動は、PSIの酸化還元状態に影響を与える上で重要な役割を果たす(Tikkanen et al. ら、2 0 1 4;Huang e t a l. ら,2 0 1 6a,c;Suorsaら,2 0 1 6a,c;Suorsaら,, 2016). A.thalianaのpgr5植物では、PSIIの厳しい光阻害は、過剰な光の下で最適に酸化されたP700の維持を可能にする光合成電子移動の究極の制御として機能する可能性, 2014). 最近、Suorsa e t a l. ら(2 0 1 6)は、Psbo1、Psbp2、Psbq1、Psbq2、およびPsbr遺伝子座におけるノックアウト変異を組み合わせることによってETRIIが減少したとき、pgr5植物が高光下で高いP7 0 0酸化比 タバコの冷やされた葉では、適度なPSII光阻害はPSIへの電子流れを弱め、その後、さらなる冷やされた処理中にP700酸化比を増加させた(Huang et al.、2016a)。 さらに、PSIIの冷却誘起光阻害は、低光でのP700酸化比の増加を伴っていたETRIIのうつ病につながった(Huang et al., 2010). 我々は、低光でのP700酸化比は、主にPSIIからの電子の流れによって制御されると仮定します。
以前の報告では、日陰確立植物Panax notoginsengは、高光ストレス下でPSIIの選択的光阻害を示したことを観察しました。 高光ストレスへの短期曝露後,低光でのETRIIは有意に減少したが,CEFは有意に刺激された。 同時に、P700酸化比は大幅に増加した。 我々の特定の目的は、(1)低光でのCEF刺激は、主にATPの合成を容易にするかどうかを調査することでした; そして(2)適度なPSII光阻害時のP700酸化比の増加は、CEF刺激またはpmfの変化ではなく、ETRIIに関連しているかどうかを決定します。 これらの質問に対処するために、Panax notoginsengの無傷の葉を、2 2 5 8μ mol光子m−2s−1で3 0分間処理した。 高光処理の前後に、PSIIのエネルギー分布、PSIの酸化還元状態および54μ mol光子m-2s-1の低光でのプロトン原動力(pmf)を決定した。
材料と方法
植物材料と成長条件
本研究では、日陰確立植物Panax notoginseng(Burkill)F.H.Chen ex C.ChowとW.G.Huangの2歳の植物を実験に使用しました。 これらの植物は、10%の日光(約200μ mol光子m-2s-1の最大昼光強度を有する)の光条件で成長させた。 これらの植物では水と栄養ストレスは経験されなかった。 9週齢の完全に拡張された葉は、光合成測定のために使用されました。光化学系iおよびPSIIパラメータを、二重PAM−1 0 0測定システム(Heinz Walz Gmbh,Effeltrich,Germany)を使用して同時に記録することにより、2 5℃で測定した。</p><h3>PSIおよびPSII測定 クロロフィル蛍光パラメータを以下のように計算した:Fv/Fm=(Fm−Fo)/FM、Y(I I)=(Fm’−Fs)/Fm’(Genty e t a l.(1 9 8 9)、NPQ=(Fm−Fm’)/Fm’である。 FoおよびFmは、それぞれ暗順応後の最小蛍光および最大蛍光である。 Fsは、光適合定常状態蛍光である。 FoおよびFmを、高光処理の前後3 0分間暗順応後に決定した。 PSI光合成パラメータを、P7 0 0シグナル(光検出器に到達する8 3 0および8 7 5nmのパルス変調測定光の強度の差)に基づいて、二重PAM−1 0 0によって測定した(KlughammerおよびSchreiber、2 0 0 8)。 P7 0 0+信号(P)は、最小レベル(P7 0 0が完全に減少する)と最大レベル(p7 0 0が完全に酸化される)との間で変化し得る。 最大レベル(Pm)は、遠赤色光で事前照明した後、飽和パルス(600msおよび10000μ mol光子m-2s-1)の適用で決定され、PmはPSI活性を推定するために使用された。 Pm’は、Pmと同様であるが、遠赤色光の代わりに化学線光を用いて決定した。 PSIの量子収率は、Y(i)=(Pm’−P)/Pmとして計算された。 所与の化学線光におけるP7 0 0酸化比は、Y(N d)=P/Pmとして計算された。 アクセプタ側の制限によるPSI非光化学エネルギー散逸の量子収率をY(N a)=(Pm-P M’)/Pmとして計算した。 Y(II)、NPQ、Y(I)、およびY(ND)の定常状態値を、低光での光順応後に20分間測定した。PSIおよびPSIIを通る光合成電子流は、ETRII=Y(I I)×PPFD×0. ここで、0.5はPSIまたはPSIIに到達する吸収された光の割合であると仮定され、0.84は吸収率(葉によって吸収された入射光の割合)であると仮定される。 CEF活性化の程度は、ETRI/ETRII比として推定された(Yamori e t a l., 2011, 2015). 日陰植物はPSII/PSI比を増加させる傾向があるので、PSIとPSIIとの間の1:1励起分配は現実的ではない可能性があることに留意すべきである(Lunde e t a l. ら、2 0 0 3;Tikkanen e t a l. ら、2 0 0 6;Grieco e t a l., 2012). さらに、この研究では、DUAL−PAM1 0 0(Walz、Germany)によって提供される赤色化学光(6 3 5nm)を使用して、PSIおよびPSIIパラメータを測定した。 赤色光はPSIの励起よりもPSIIの励起に有利であるため、LHCIIからPSIIおよびPSIへの励起エネルギー分布は、赤色光によって影響される可能性がある(Tikkanen e t a l., 2017).Ecs信号は、P5 1 5/5 3 5エミッタ−検出器モジュール(Walz)を装備したDual−PAM−1 0 0(Walz、Effeltrich、Germany)を使用して、5 1 5nmでの吸光度変化として監視した。 ECS信号は、20分の照明の後に54μ mol光子m-2s-1で得られ、その後、ECS減衰は30秒の活性光をオフにすることによって測定された。ECS暗間隔緩和速度論(DIRKECS)の分析は、Sacksteder et al. ら(2 0 0 1)およびTakizawaら(2 0 0 2)。 (2008). 総pmfは、300ミリ秒の暗い間隔の間にECS信号の急速な減衰の総振幅から推定された。 ECSシグナルのゆっくりとした緩和はチラコイド膜(Δ P h)を横切るプロトン勾配の寄与を認識することを可能にした。 一次ECS緩和(TECS)の時定数は、ATPシンターゼを介したチラコイド膜のプロトン伝導率(g H+)に反比例する(Sacksteder and Kramer,2 0 0 0;Cruz e t a l.,2 0 0 0;Sacksteder and Kramer,2 0 0 0;Cruz e t a l.,2 0 0 1)。, 2005). その結果,gh+は減衰時定数の逆数として推定された。
光阻害処理
30分間暗順応した後、fv/FmおよびPmを無傷の葉で測定した。 その後、これらの無傷の葉を59μ mol光子m-2s-1で20分間光適応させ、クロロフィル蛍光、P700信号およびECS信号のパラメータを記録した。 その後、活性光は2258μ mol光子m-2s-1に変化した。 この高い光に30分間曝露した後、活性光を直ちに59μ mol光子m-2s-1に変更し、光合成パラメータを20分間光順化した後に記録した。 最後に、3 0分間暗順応後にFv/FmおよびPmを測定した。
統計分析
結果は、五つの独立した実験の平均値として表示されました。 異なる治療間に有意差が存在するかどうかを決定するために、独立したT検定をα=0.05有意水準で使用した。 すべての統計分析は、SPSS16.0を使用して行った。
結果
59μ molの光子m-2s-1での光合成誘導中に、ETRIIは徐々に増加し、約18分で定常状態に達しました(図1A)。 比較すると、ETRIはこの誘導段階で一定であった(図1A)。 この低光の発症後,ETRIはETRIIよりもはるかに高かった。 しかし、20分光合成誘導後、ETRIはETRIIよりも低かった。 これらの結果は、以前の研究(Joliot and Joliot,2002,2005;Makino et al., 2002). 低光でのこの光合成誘導の後、葉を2258μ mol光子m-2s-1の高光で30分間照明した。 興味深いことに、ETRIIは高光処理中に徐々に減少した(図1B)。 一方、ETRIの値はETRIIの値よりも高く(図1B)、高光下でCEFの活性化を示しています。 この高光処理の後、最大の光酸化性P7 0 0(P m)は安定に維持された(図2A)。 比較すると、最大蛍光強度(Fm)は40%減少し、PSIIの最大量子収率(Fv/Fm)は0.80から0.65に減少した(図2B、C)。 これらの結果は,高光ストレス下でのPanaxnotoginsengの葉におけるPSIIの選択的光阻害を示した。
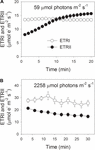
図1。 低光(A)および高光(B)での光合成電子の流れ。 (A)暗順応した葉を、5 9μ molの光子m−2s−1の低光に2 0分間曝露した。 (B)光合成における電子シンクを活性化するために59μ mol光子m-2s-1で20分間照明した後、葉は2258μ mol光子m-2s-1の高い光に30分間曝された。 値は平均±SE(n=5)である。
高光処理の前に、成熟した葉を59μ molの光子m-2s-1の低光で20分間照射し、光合成を活性化し、ETRI、ETRII、Y(ND)、NPQの値を記録した。 3 0分間の高光処理後、etri、ETRII、Y(N D)、およびNPQの値を、低光に対する2 0分間の新たな順化段階に続いて記録した。 高光処理の前には、59μ molの光子m-2s-1におけるETRIおよびETRIIの値は、それぞれ13.4および15.7μ molの電子m-2s-1であった(図3A、B)。 高光処理後、低光でのETRIおよびETRIIは、それぞれ12.8および11.2μ mol電子m-2s-1であった(図3A、B)。 59μ mol光子m-2s-1でETRIIの値は、適度なPSII光阻害時にETRIIのうつ病を示す、光阻害治療後約30%減少した。 高光処理の前は、59μ molの光子m-2s-1でのETRI/ETRII比の値は0.85であった(図3C)。 光阻害処理後、ETRI/ETRII比は1.14に有意に増加した(図3C)。 これらの結果は、PSII光阻害時の低光でのCEFの刺激を示唆した(Yamori e t a l., 2011, 2015).
高光処理後、59μ molの光子m-2s-1でのY(I)の定常状態値は変化しませんでした(図4A)。 興味深いことに、Y(NA)は0.36から0.23に有意に減少し(図4B)、Y(ND)は0.1から0.25に有意に増加した(図4C)。 これらの結果は,光阻害処理後の低光におけるPSIの酸化還元状態の変化を示した。 一方、NPQの値はわずかに変化しました(図4D)。 その結果、中程度のPSII光阻害は、低光でP700酸化比とNPQに異なる効果を持っていた。
Y(ND)の増加がpmfの増加によって引き起こされるかどうかを明らかにするために、54μ mol光子m-2s-1におけるエレクトロクロミックシフト信号を、高光処理の前後に20分間光順化した後に決定した。 興味深いことに、総pmfは、高光処理後に1 8%有意に減少したが(図5A)、Δ P Hレベルは有意に変化しなかった(図5B)。 Pmfの形成はチラコイドプロトン伝導率の影響を受けることから,この低光におけるチラコイド膜のプロトン伝導率(g h+)も高光処理の前後で調べた。 その結果、gH+は高光処理では変化しないことが示され(図5C)、高光処理は低光での葉緑体ATPシンターゼの活性にほとんど影響しないことが示唆された。 ETRIIの30%の減少はpmfの18%の減少を伴っていたので、低光でのCEFの刺激はpmfおよびΔ Phの形成を部分的に補償した。

図5。 低光におけるチラコイド膜の全プロトン駆動力(pmf)(A)、チラコイド膜を横切るプロトン勾配(Δ P h)(B)、およびチラコイド膜(C)のプロトン伝導率(g h+)の値。 すべてのパラメータは、54μ mol光子m-2s-1で20分間適応後に測定した。 値は平均±SE(n=5)である。 アスタリスクは、高輝度処理後の有意な(P<0.05)変化を示します。
ディスカッション
低光でのCEF刺激の役割
CEFは光合成と植物の成長を維持する上で重要な役割を果たすことが示されている(Yamori and Shikanai、2016)。 高い光の下では、CEFは、ATP/NADPHエネルギー予算のバランスをとるため、ならびにPSIおよびPSIIを損傷から保護するために不可欠であると考えられている(Munekage e t a l.,2002,2004;Takahashi et al. ら、2 0 0 9;Suorsa e t a l. ら,2 0 1 2,2 0 1 6;Walker e t a l. ら、2 0 1 4;Huang e t a l.、2015a、2017b)。 低光強度では、CEFはおそらく余分なATPの供給を介して光合成CO2同化を最適化する上で重要な役割を果たす(Yamori et al. ら,2 0 1 1,2 0 1 5;Nikwaら,2 0 1 1,2 0 1 5. ら、2 0 1 2;Huang e t a l.、2015a)。 CEFの主な役割は、光強度に応じて柔軟に変調されます。 特に、CEFは、主に、亜飽和光強度の下でATP/NADPHエネルギーバジェットのバランスをとることに寄与するが、チラコイド内腔の酸性化を介して飽和光強度に曝されたときに、主に光合成装置を光阻害から保護する(Huang e t a l.、2015a)。 興味深いことに、Huang et al. (2010)は、CEFがPSIIの冷却誘導光阻害後に低光で有意に刺激されたことを発見し、このCEF刺激は主にPSIIの高速修復のためのATPの合成を強化したと仮定した。 しかし、この仮説を支持するためには、より多くの証拠が必要であった。 本研究では、低光でのETRI/ETRIIの値が有意に増加し(図3C)、PSI周辺のCEFの刺激を示すことが観察された(Huang et al. ら,2 0 1 1,2 0 1 2,2 0 1 7a,b;Yamori e t a l., 2011, 2015). 同時に,pmfの振幅は有意に減少し,Δ Phはわずかに減少した。 これらの結果は,CEFの刺激が光合成電子輸送のΔ P h依存的ダウンレギュレーションを誘発しないことを示した。 言い換えれば、低光でのこのCEFの刺激は、主にATPの合成を促進した。
葉緑体ATP合成酵素のプロトン伝導率は高光処理によって影響されなかったが、pmfのサイズが小さいほどATP合成の実際の速度が低下した。 低光でのPSII修復および光合成CO2同化の速度は、主にATP合成の速度によって制限される(Allakhverdiev e t a l. ら,2 0 0 5;Yamoriら,2 0 0 5;Yamoriら, ら,2 0 1 1,2 0 1 5;Nikwaら,2 0 1 1,2 0 1 5., 2012). ETRIIはPSII光阻害時に有意に減少したので,ETRIIを介したATP合成速度は著しく減少した。 一次代謝とPSIIの迅速な修復によって必要とされるATP/NADPH比のバランスをとるためには、余分なATPを提供するために柔軟な機構が必要である。 この条件下では、ETRIIは30%減少したが、総pmfはわずか18%減少した。 これらの結果は,CEFの刺激がpmfのETRII依存性形成の減少を補償し,ATPの合成を増強することを示している。 光損傷したPSIIの迅速な修復は、ATP合成に依存する(Allakhverdiev e t a l., 2005). PSIの周りのCEFの加速は、ATPの細胞内濃度を増加させ、したがって、シネコシスチスにおけるPSII修復の速度を加速させた(Allakhverdiev e t a l., 2005). 一緒に取られて、我々は、低光でのCEFの刺激は、追加のATP合成を介してPSII活性の高速修復に重要な役割を果たしていることを提案します。
低光でのP700酸化比の変化はpmfに関連していません
興味深い現象は、低光でのP700酸化比が適度なPSII光阻害時に有意に増加することです(Huang et al.,2010),これはまた、本研究で示されています. 吸収された光が光合成の要件を超える条件下では、Δ PhのCEF依存性生成は、Cyt b6/f複合体活性の活性を下方調節し、PSIIからPSIへの電子流を制御する(Suorsa e t a l., 2012, 2016; Sikanai,2014,2016)、PSIにおけるP700の酸化還元状態を最適化し、光合成中のPSIにおけるROS産生を最小限に抑える。 A.thalianaのpgr5植物では、p700はpmfの生成の損失によるライトの電子によって減ります。 しかし、フラボジironタンパク質を蓄積するpgr5変異体では、pmfのレベルも野生型レベルに回復し、したがってp700は野生型と同様に酸化された(Yamamoto et al., 2016). クロロフィルb欠損小麦変異株では、不十分なチラコイドプロトン勾配は、高い光または高温下でのPSI受容体側の過剰還元、したがってPSI光阻害をもたらす(Brestic e t a l., 2015, 2016). 最近、いくつかの研究では、葉緑体ATPシンターゼの活性の増加は、pmfの形成を障害し、光合成電子輸送鎖の過剰還元を引き起こし、高光および変動光下でPSIの光ダメージをもたらすことが報告されている(Kanazawa et al. ら、2017;Takagi et al., 2017). これらの報告は、過剰な光エネルギーの下で最適に酸化されたP700を維持する上でpmfの重要な役割をサポートしています。
我々の現在の結果は、30分間の高光処理後、この低光で形成された総pmfが有意に減少し、Δ Phの形成がわずかに変化することを示した(図5A、B)。 一方、P700酸化比は、0.1(処理前)から0.25(処理後)に有意に増加した(図4C)。 これらの結果は、p700酸化比のこの増加は、高光下でのY(ND)とpmfとの相関とは大きく異なるpmfの変化によって説明できないことを強く示している(Yamamoto et al. ら,2016;Takagiら,2 0 1 6., 2017). 従って、p700酸化比率に対するpmfの調整の効果は微光で最低ですが、高いライトか変動ライトの下で特に重大になります。 高い光の下では、高い値のY(N d)は、通常、高い値のNPQを伴う(Munekage e t a l. ら,2 0 0 2,2 0 0 4;Konoら,2 0 0 3,2 0 0 4;Konoら, 2014年Zivcak et al.,2015),pmfの増加に起因します。. Δ P H形成の障害は、高光下でのY(N d)およびNPQのレベルの低下をもたらす(Suorsa e t a l. ら,2 0 1 2;Kono e t a l. ら,2 0 1 4;Yamamoto e t a l. ら,2 0 1 6;Kanazawaら,2 0 1 6., 2017). 低照度でのNPQの誘導は、主に内腔の酸性化のレベルによって決定される。 高光処理後、内腔の酸性化の程度は変化せず(図5B)、NPQは安定したままであった(図4D)。 比較すると,Y(N d)は有意に増加した。 これらの結果は,低光では,Y(N d)とNPQが異なる調節機構によって制御されることを示している。
ETRIIは、低光でP700酸化比を制御します
PSIは、PSIIからの電子の流れが電子に対処するためにPSI電子アクセプターの容量を超えた場合にのみ過 PSIへの電子の流れが制限されている場合、PSIは、A.thalianaのpgr5植物における光ストレスに対して極めて耐性である(Suorsa e t a l. ら,2 0 1 2,2 0 1 6;Tikkanenら,2 0 1 2,2 0 1 6;Tikkanenら,, 2014). 日陰確立植物Psychotria rubraのために、PSI活性は、DCMUの存在下で高光ストレスにinsusceptibleであった(Huang et al.、2016c)。 タバコの冷やされた葉では、適当なPSII光阻害は、最適に酸化されたP700の維持を可能にし、その後、さらなる光損傷に対してPSI活性を保護した(Huang et al.、2016a)。 これらの結果は,高光または冷光ストレス下でのPSIの酸化還元状態を制御する上でETRIIの重要な役割を示した。 これらの結果から,中等度のPSII光阻害は低光でのETRIIの有意な低下をもたらすことが分かった。 一方,PSI活性と葉緑体ATPシンターゼの活性はわずかに変化し,総pmfとΔ Phは増加しなかった。 その結果、ETRIIの減少は、Cyt b6/f複合体を介したΔ Ph依存性光合成制御によって引き起こされたのではなく、おそらくPSII活性の減少によって誘導された(Tikkanen e t a l., 2014). PSIIからPSIへの電子の供給の減少は、P700酸化のレベルの増加をもたらした。 したがって、低光でのP700酸化比は、ETRIIによって主に制御された。
結論
我々は、PSIIの選択的光阻害は、CEFの刺激と低光でP700酸化比の増加を誘導することがわかった。 CEFの刺激は光合成電子輸送のΔ P h依存性ダウンレギュレーションを誘発しなかった。 その結果,低光でのCEFのこの刺激は,光損傷PSIIの迅速な修復に不可欠なATPの合成を主に促進した。 P700酸化比の増加は、Cyt b6/f複合体におけるΔ Ph依存光合成制御の変化によって説明することができなかったが、主にPSIIからPSIへの電子の供給の減
著者の貢献
WH、S-BZ、およびTLは、研究を考案し、設計しました。 WHとY-JYが実験を行った。 WH、Y-JY、S-BZ、およびTLはデータを分析しました。 WHはすべての著者によって集中的に編集された原稿の最初の草案を書いた。
資金調達
この研究は、中国国家自然科学財団(31670343)、中国科学院青年イノベーション推進協会(2016347)、雲南省の主要な科学技術プログラム(2016ZF001)によって支
利益相反に関する声明
著者らは、この研究は、利益相反の可能性と解釈される可能性のある商業的または財政的関係がない場合に行われたと宣言している。
河野、M.、野口、K.、寺島、I.(2014)。 シロイヌナズナの短期変動光における光合成電子流の調節におけるPSI(CEF-PSI)とO2依存的な代替経路の周りの環状電子流の役割。 植物細胞Physiol。 55, 990–1004. 土井:10.1093/pcp/pcu033
Pubmed Abstract|CrossRef Full Text|Google Scholar
Shikanai,T.(2016). プロトン駆動力の制御ネットワーク:光化学系の周りの環状電子輸送の寄与I.Photosynth. Res.129,253-260. 土井:10.1007/s11120-016-0227-0PubMed Abstract/CrossRef Full Text/Google Scholar
Yamori,W.,Makino,A.,Shikanai,T.(2016). イネの変動する光の下で光合成を維持する際の光化学系Iの周りの環状電子輸送の生理学的役割。 サイ… 第6回:2014年7月 doi:10.1038/srep20147
Pubmed Abstract|CrossRef Full Text/Google Scholar
Yamori,W.,And Shikanai,T.(2016). 光合成と植物の成長を維持する際の光化学系Iの周りの環状電子輸送の生理機能。 アンヌ 植物生物学者。 67, 81–106. doi:10.1146/annurev-arplant-043015-112002
Pubmed Abstract|CrossRef Full Text/Google Scholar
Yamori,W.,Shikanai,T.,And Makino,A.(2015). 葉緑体NADHデヒドロゲナーゼ様複合体を介した光化学系i環状電子流は,低光での光合成のための生理学的役割を果たす。 サイ… Rep.5:13908. doi:10.1038/srep13908
PubMed Abstract|CrossRef Full Text|Google Scholar
Zhang,S.P.,And Scheller,H.V.(2004). シロイヌナズナにおける冷却温度における光化学系iの光阻害とその後の回復。 植物細胞Physiol。 45, 1595–1602. doi:10.1093/pcp/pch180
PubMed Abstract/CrossRef Full Text|Google Scholar