- Introduction
- 材料および方法
- 器械分析
- 微生物培養
- ドロスタノロンエナント酸(1)をC.aphidicola ATCC28300、およびF.lini NRRL2204
- 2α-メチル-3α,14α,17β-トリヒドロキシ-5α-アンドロスタン(2)
- 2α-メチル-3α,17β-ジヒドロキシ-5α-アンドロスタン(4)
- 2-メチルアンドロスタ-11α-ヒドロキシ-1,4-ジエン-3,17-ジオン(6)
- 2-メチルアンドロスタ-14α-ヒドロキシ-1,4-ジエン-3,17-ジオン(5)
- 2-メチルアンドロスタ-14α-ヒドロキシ-1,4-ジエン-3,17-ジオン(6)
- 2-メチルアンドロスタ-14α-ヒドロキシ-1,4-ジエン-3,17-ジオン(6)
- 2-メチルアンドロスタ-14α-ヒドロキシ-1,4-ジエン-3,17-ジオン(6)
- 2-メチルアンドロスタ-14α-ヒドロキシ-1,4-ジエン-3,17-テーブル3 テーブル3。 化合物7〜9(δ ppm)の1 3C−および1H−NMR化学シフトデータ(JおよびW1/2(H Z))。 2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
- 2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
- Experimental Protocol for Cytotoxicity
- 結果と議論
- 構造説明
- HeLa、PC3、H640、およびHCT116癌、および3T3正常細胞株に対する細胞毒性
- 構造活性の関係
- 結論
- 著者の貢献
- 利益相反に関する声明
- 謝辞
- 補足資料
Introduction
微生物形質転換は、様々なクラスの有機化合物の構造変換のための最も重要なアプローチの一つである。 この技術は、グリーン化学、すなわちで首尾よく採用されています。 創薬開発プログラムは、コア構造の周りの化合物の優れた供給源を提供し、その後、様々な生物学的活性のためのスクリーニングを提供します。 いくつかの例では、微生物形質転換は、従来の方法によって達成することが困難な有機化合物の位置選択的、化学的、および立体選択的変換のための重 ら、2 0 0 3;Mihovilovic e t a l. 2003年;Yildirim et al. ら、2 0 0 3;Bartmanska e t a l. ら、2 0 0 5;Borges e t a l. ら、2 0 0 9;Choudhary e t a l. ら、2 0 1 1;Ravindran e t a l., 2012). ステロイドの炭化水素骨格の不活性な性質のために、それらはしばしば従来の合成方法によって誘導体化されることが困難である。 従って、微生物変形はステロイドの構造変化のために頻繁に使用されます。 真菌におけるP450シトクロム酵素系の存在は、全細胞生体触媒を立体特異的および位置特異的なヒドロキシル化のための効率的なツールにする(Choudhary et al. ら、2005a;Tong and Dong,2009;Kristan and Riëner,2012;Baydoun et al., 2014).Drostanoloneのプロピオン酸塩、drostanolone pentanoateおよびdrostanolone enanthateのようなdrostanoloneおよびエステルの派生物は、(1)脂肪を得ないで彼らの筋肉を増強するのに運動選手が使用する同化androgenicステロ さらに、drostanoloneおよびエステルの派生物にエストロゲンの生産を禁じる機能があります。 Drostanoloneのプロピオン酸塩のエステルはまたmasteron(Chowdhury等の銘柄の下で乳癌の処置のために、使用されます。 ら、1 9 7 6;Clavel e t a l. ら、1 9 8 2;Marinov e t a l. ら、1 9 8 6;Vardar e t a l. ら,2 0 0 2;BahrkeおよびYesalis,2 0 0 4)。
がんは現在、主要な公衆衛生上の課題として認識されています。 癌は、米国および世界中の第二の主要な死因です。 世界保健機関(WHO)によると、がんの罹患率は年間600万人を超えています。 癌細胞は高い増殖率を有する。 それらは生きているシステムで急速に広がり、強いchemotherapeuticsおよびDNAの損傷の代理店に対して存続できます。 同様に、細胞傷害性薬物は、正常細胞に多くの悪影響を及ぼし、したがって、癌化学療法におけるそれらの使用は治療上の課題である。 このため、様々な癌に対して安全で効果的で選択的な化学療法剤の開発が緊急に必要とされている(Munoz−Pinedo e t a l. ら,2 0 1 2;Suら,2 0 1 2;Suら, ら、2 0 1 5;Swadogo e t a l. ら、2 0 1 5;Rebecca e t a l., 2016).乳がんは、世界140カ国で最も一般的ながんの一つです。
乳がんは、世界の140カ国で最も一般的ながんの一つです。
これは、世界中の女性における癌関連死の主要な原因であり、高い増殖率を有する乳房小葉または管における細胞の異常な成長を特徴とする(Hanahan and Weinberg,2 0 0 0;Ferlay e t a l., 2015).
子宮頸がんは、乳がんに次いで、世界中の女性で二番目に優勢ながんです。 子宮頸がんの主な原因は、子宮頸部の組織における悪性細胞の形成である(Wang et al. ら,2 0 1 3;Hafiza and Latifah,2 0 1 4;Pariente e t a l., 2016). ヒト子宮頸癌細胞から得られたHela癌細胞株は、試験化合物の細胞傷害性の可能性を評価するための一般的な細胞モデルである。
前立腺癌は、気管支癌に次いで世界的に男性の第二の主要な癌であり、癌死の第三の最も一般的な原因です。 それは男性の悪性腫瘍の最も一般的な理由です。 その発生率は年齢とともに増加し、50歳以上でより一般的である(Henry and Omahony,1999;De-Bono et al. ら、2 0 1 0;Wenbin e t a l., 2015). 男性前立腺癌細胞から得られたPC-3癌細胞株は、試験化合物の毒性を調査するために広く使用されているモデルである。
肺がんは、1950年代半ばから米国の男性と1980年代後半から女性の間で非常に流行しているがんであり、がん関連死の主要な原因です。 肺癌は、主に喫煙に起因する(Tavis e t a l. ら、2 0 0 2;Villanti e t a l. ら、2 0 1 3;Mishra e t a l., 2016). ヒト肺癌細胞(ヒト大細胞肺癌のリンパ性転移サブライン)から得られたH4 6 0癌細胞株は、試験化合物の細胞毒性を評価するためにしばしば使用される。乳がん、肺がん、前立腺がんの後、結腸がんは世界中で4番目に多いがんです。 それは男性および女性のおよそ等しい頻度で見つけられる癌です。 これは、西洋諸国における癌関連死亡の二番目に一般的な原因である(Levin et al. ら、2 0 0 8;Andre e t a l. ら,2 0 0 9;Ahearnら,2 0 0 9;Ahearnら,, 2012). ヒト結腸癌細胞から得られたHCT1 1 6癌細胞株は、試験化合物の細胞毒性を評価するために一般的に使用される。
生物活性ステロイドの真菌形質転換に関する我々の研究の継続で(Choudhary et al. ら,2 0 0 5b,c,2 0 0 7,2 0 1 0;Ahmad e t a l. ら、2 0 1 4;Siddiqui e t a l. 2017)では、ドロスタノロンエナント酸(1)の類似体をCephalosporium aphidicolaおよびFusarium liniとの変換によって合成した。 代謝産物2-9だけでなく、基質1は、HeLa(子宮頸癌)、PC-3(前立腺癌)、H460(肺癌)、HCT116(結腸癌)、および3T3(マウス線維芽細胞正常)細胞株に対して評価され、ハイスループットセルベースのアッセイ、最も効率的で便利な実験室法、MTTアッセイを用いて、癌細胞に対する特異性を示した悪性腫瘍における試験化合物の応答を予測した。 この調査は従ってそれ以上の調査のためのdrostanolone enanthate(1)の反癌性の代謝物質を識別しました。
材料および方法
器械分析
薄層クロマトグラフィー(TLC)(シリカゲル、20×20、厚さ0.25mm、PF254、メルク、ドイツ)は、形質転換および純度の シリカゲルカラムクロマトグラフィー(70-230mesh、E.Merck、Germany)を代謝産物の初期精製に使用した。 さらに、代謝産物の最終精製には、YMC L−8 0(4〜5μ m、2 0〜5 0mm内径)を装備した分取逆相リサイクル(JAI LC−9 0 8W、Japan)を使用した。 代謝産物の構造は、1H-(400、500、および600MHz)、および13C-NMR(100、125、および150MHz)スペクトルの助けを借りて解明され、Cd3OD、CD3COCD3またはDMSO-d6のBruker Avance-NMR分光計(フランス)に記録された。 HREI-MSおよびIRスペクトルは、それぞれJEOL JMS-600H(日本)(二重焦点磁気セクター質量分析装置)質量分析計(EI、電子衝撃イオン化)、およびBrukerベクトル22FT-IR分光光度計 代謝産物の光学回転はJASCO P-2000偏光計(日本)に記録された。 Evolution300UV可視分光光度計は、UVスペクトルを記録するために使用されました。 形質転換生成物の融点は、Buchi M−5 6 0(Switzerland)機器を使用して測定した。 単結晶X線回折データを、光子1 0 0検出器(CMOS技術)およびX線源を有する微細焦点封止管(Cu K a放射α=1. 反射強度は、SANTソフトウェアを使用して統合した。 吸収補正はマルチスキャンで行われ、構造はSHELXTLプログラムによって解決された(Gerlier and Thomasset、1986; Sheldrick,2008;Spek,2009)。
微生物培養
C.aphidicola ATCC28300およびF.lini NRRL2204の微生物培養は、それぞれAmerican Type Culture Collection(ATCC)およびNorthern Regional Research Laboratories(NRRL)から得られた。 C.aphidicola ATCC-28300の成長のための培地の四リットルは、200gのグルコース、4gのKH2PO4、8gのグリシン、4gのKCl、8gのMgso4.7H2O、および8mLの微量元素を4Lの蒸留水に混合することによって調製した。 同様に、4リットルの培地を、40gのグルコース、20gの酵母抽出物、20gのペプトン、20gのKH2PO4、20gのNaCl、および40mLのグリセロールを4Lの蒸留水に混合することによって、F.lini NRRL2204のために調製した。
ドロスタノロンエナント酸(1)をC.aphidicola ATCC28300、およびF.lini NRRL2204
C.aphidicolaおよびF.liniの成長のための培地で発酵させ、各真菌の蒸留水4Lに上記の成分を混合し、40Erlenmeyerフラスコ250mL(各フラスコ100mL)に均等に分配した。 すべてのこれらのフラスコを121℃でオートクレーブし、滅菌条件下でC.aphidicola ATCC28300およびF.lini NRRL2204のSDA傾斜を接種した。 フラスコを含むこれらの真菌培養物を回転シェーカー(121rpm)上に26±2℃で3-4日間放置して、C.aphidicolaおよびF.liniの最大増殖を得た。 化合物1(1g)を各真菌のアセトン20mLに溶解し、各フラスコに0.5mL分注し、再び回転シェーカー上に12日間置いた。 陰性対照(培地+真菌培養物)、ならびに陽性対照(培地+基質)も同様に調製して、真菌代謝産物および化合物1の分解をそれぞれ評価した。 12日間のインキュベーション後、すべてのフラスコを濾過し、20Lのジクロロメタン(DCM)で抽出し、有機相を分離し、ロータリーエバポレータ上で減圧下で蒸発させた。 これにより、1.5gの淡黄色の固体粗製物が得られた。 この粗物質をシリカゲルカラムクロマトグラフィーで勾配ヘキサンおよびアセトン溶媒系で溶出して分画した。 カラムクロマトグラフィーは、その後、リサイクルHPLCによって精製された四つの主要な画分(1-4)を得た。 代謝産物2(tR=16分、8mg、0.8%)、3(tR=19分、11mg、1.1%)、4(tR=17分、35mg、3.5%)、5(tR=23分、42mg、4.2%)、6(tR=20分、9mg、0.9%)、7(tR=21分、12mg、1.2%)、および9(tR=18分、5mg、0.5%)を精製した。溶媒系としてメタノール-水を用いた逆相リサイクルhplc(meoh:h2o;70:30)を介して、それぞれ画分1-7から。 一方、代謝産物8は、通常相リサイクルH PLCによって画分8から得られた(Tr=3 2分、Chcl3:Meoh;9 5:5、7)。5mg、0.75%)。
2α-メチル-3α,14α,17β-トリヒドロキシ-5α-アンドロスタン(2)
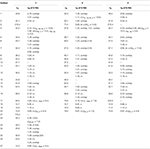
表1. 化合物1−3(δ ppm)の1 3C−および1H−NMR化学シフトデータ(JおよびW1/2(H Z))。2α-メチル-7α-ヒドロキシ-5α-アンドロスタン-3,17-ジオン(3)
2α-メチル-3α,17β-ジヒドロキシ-5α-アンドロスタン(4)
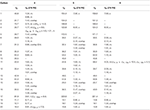
化合物4〜6(δ ppm)の1 3C−および1H−NMR化学シフトデータ(JおよびW1/2(H Z))。1,4-ジエン-3,17-ジオン(5)
2-メチルアンドロスタ-11α-ヒドロキシ-1,4-ジエン-3,17-ジオン(6)
2-メチルアンドロスタ-14α-ヒドロキシ-1,4-ジエン-3,17-ジオン(5)
2-メチルアンドロスタ-14α-ヒドロキシ-1,4-ジエン-3,17-ジオン(6)
2-メチルアンドロスタ-14α-ヒドロキシ-1,4-ジエン-3,17-ジオン(6)
2-メチルアンドロスタ-14α-ヒドロキシ-1,4-ジエン-3,17-ジオン(6)
2-メチルアンドロスタ-14α-ヒドロキシ-1,4-ジエン-3,17-テーブル3
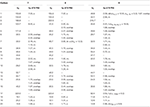
テーブル3。 化合物7〜9(δ ppm)の1 3C−および1H−NMR化学シフトデータ(JおよびW1/2(H Z))。
2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
Experimental Protocol for Cytotoxicity

テーブル3。 化合物7〜9(δ ppm)の1 3C−および1H−NMR化学シフトデータ(JおよびW1/2(H Z))。
The cytotoxicity of samples was measured against HeLa (human cervical carcinoma ATCC CCl-2), PC-3 (human prostate cancer ATCC CRL-1435), NCl-H460 (human lung carcinoma ATCC HTB-177), HCT116 (human colon cancer ATCC CCl-247), and 3T3 (control fibroblast normal ATCC CRL-1658) cell lines by using standard MTT assay. 細胞株を、1 0%FBSを補充したDMEM F1 2培地中で、インキュベーター中で3 7℃の5%CO2雰囲気下で増殖させた。
比色アッセイMTTは、細胞代謝活性の評価のために使用されました。 このアッセイでは、生きている細胞のミトコンドリアにおいて、黄色のMTTは紫色のホルマゾンに還元される(GerlierおよびThomasset、1 9 8 6)。 生細胞が多ければ多いほど、より多くの色、したがってより多くの吸光度が測色計によって観察される(Fesahat et al., 2015). この方法を用いて、癌細胞に対する細胞傷害性に対する形質転換産物の効果を分析した。 各細胞株の約10,000細胞(HeLa、PC3、H460、HCT116癌、および3T3正常)を96ウェルプレートに播種した。 8 0〜9 0%のコンフルエンスに達した後、それらを種々の濃度の化合物(2 5、5 0、7 5、1 0 0、および2 0 0μ M)で2 4時間処理した。 溶液を濾過し、連続希釈を成長培地中で行った。 600μ lの各希釈液を使用して、3つのウェル(それぞれの3倍)の96ウェル板、すなわちそれぞれ200μ lを処理した。 各実験は、3つの生物学的複製物で実施した。 MTTを除去した後、紫色のホルマゾン結晶をDMSOに溶解し、正常細胞および癌細胞についてそれぞれ540および570nmで読み取りが観察された。 Multiskan読者は、DMSO処理された3T3線維芽細胞において5 4 0nmでβ maxを与える(形態的にはより合流性である)が、癌細胞の場合、5 7 0nmでβ maxを与える(Bonmati−Carrion e t a l. ら、2 0 1 3;Danihelova e t a l., 2013). シスプラチンが選択の一般的な薬剤であったこの実験では、上皮癌細胞株の広い範囲が使用された。 それはDNAを標的とし、有糸分裂の間に細胞分裂を妨害し、アポトーシスを誘導する(Eastman、1999)。 IC5 0値を計算して、細胞の5 0%を死滅させるのに必要な最小濃度を決定した。
一方、
At=試験化合物の吸光度値
Ab=ブランクの吸光度値
Ac=コントロールの吸光度値
結果と議論
構造説明
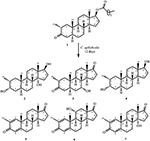
図1。 Drostanolone enanthate(1)のセファロスポリウムaphidicolaとの生体内変換。
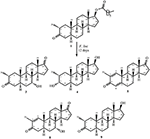
図2。 ドロスタノロンエナント酸(1)のフザリウム-リニによる生体内変換。
代謝物2は白色結晶として単離された。 分子式C20H30O3は、m/z322.2517で示されたHREI-MSに基づいていた(calcd. 322.2508,C20H34O3)、三つの水素と酸素原子の添加、C-3ケトンカルボニルの還元、および基質1におけるヘプタノエート側鎖の加水分解開裂を示唆している。 3,531、および3,423cm−1でのIR吸光度は、ヒドロキシル基の存在によるものであった。 1H-NMRスペクトルは、δ3.69で追加のメチンプロトンシグナルを示した(表1)(データシート2)。 ヘプタノエート側鎖のシグナルはまた、化合物2の1H-NMRスペクトルに欠けていることが見出された。 13C NMRスペクトルは、δ71.4で新しいメチン炭素、δ84.8で新しい四級炭素のシグナルを示した。 ヘプタノエート鎖とケトンカルボニルの炭素シグナルも13C-NMRスペクトルに欠けていることが判明した。 これは、C-3カルボニルの還元、ヘプタン酸鎖の加水分解損失、およびC-14におけるOHの添加を示唆した(表1)。 OH基は、H3-20(δ0.91,d)とC-3(δ71.4)とのHMBC相関に基づいてC-3に配置された(図3)。 これはC-3カルボニルの還元に起因する。 第二のO H群は、H3−1 8(δ0. 第三のOHは、ヘプタン酸部分の加水分解損失に起因する、C-17であった。 C-3のO-H基は、h-3のNOESY相関に基づいてα配向であると推定された(δ3.69、br。 とα配向H3-20(δ0.91,d)を有する(図4)。 OH-14は、h-9(δ1.32,m)とOH-14(δ2.66,s)(アセトン-d6)のNOESY相関に基づいて、α配向であると推定された。 単結晶X線回折分析は、さらに代謝物2の構造を支持し、椅子の立体配座(A、B、C)の三つのリングとエンベロープの立体配座(D)の一つで構成されています。 C−3、C−1 4、およびC−1 7の3つのO H基をα−、α−、およびβ−配向させた(図5)。 代謝物2の単結晶回折データを、Cambridge Crystallographic Data Collection(CCDC1 5 0 0 7 0 6)に提出した。 代謝産物2の構造は、このように2α-メチル-3α,14α,17β-トリヒドロキシ-5α-アンドロスタンとして推定された。
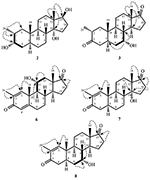
図3。 新しい代謝産物におけるキー HMBC( )、およびCOSY(
)、およびCOSY( )相関。
)相関。
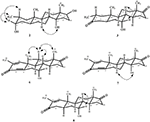
図4。 新しい代謝物のキー NOESY相関関係。図5
代謝物3は白色固体として得られた。 HREI-MSは、at m/z318.2192(calcd。 318.2195,C20H30O3)。 これは、ヘプタノエート側鎖の損失、および基板1中の酸素原子の添加を表していた。 IRスペクトルOH(3,436cm−1)とケトンカルボニル(1,711cm−1)の吸光度を示した。 1H-NMRスペクトルでは、ヘプタン酸鎖とC-17メチンプロトンのシグナルが欠落しているのに対し、新しいダウンフィールドメチンプロトンシグナルがδ3.92で観測された(表1)(データシート3)。 これはステロイド骨格のヒドロキシル化とヘプタノエート部分の酸化的開裂を示唆した。 13C NMRスペクトルはまた、上記の推論をサポートしています。 新しいケトンカルボニルとオキシ-メチン信号が13C-NMRスペクトルに現れたのに対し、ヘプタン酸部分の炭素信号が欠落していることが判明した(表1)。 これは、ヘプタノ酸鎖の酸化的切断と基質1におけるヒドロキシル化を示した。 Δ3.92(H-7)で新たに出現したメチンプロトンは、C-5およびC-8とHMBC相関を示し、C-7でOHを示唆しています(図3)。 H3-18とh2-16の炭素とδ223.8のhmbc相関は、C-17のケトン性炭素を示唆した。 C-7でのOHは、さらにH-7H2-6とH-8との居心地の良い相関によってサポートされていました。 H-7(δ3.92,s)は軸方向に配向したH-8(δ1.70,overlap)とNOESY相関を示し、C-7におけるOHのα配向を示唆した(図4)。 したがって、代謝物3の構造は、2α-メチル-7α-ヒドロキシ-5α-アンドロスタン-3,17-ジオンとして推定された。
化合物1および5についても単結晶X線回折分析を行った。 化合物1は、椅子、椅子、椅子、および包絡座を有する4つの環、すなわち、A、B、C、およびDから構成された。 メチルは赤道向きのC-2に存在していた。 ヘプタノエートエステル鎖は環DのC-17に存在していた(図6)。 一方、代謝物5は、平面配座、椅子、椅子、および包絡座に環A、B、C、およびDを含む。 ヘプタノエート側鎖は代謝産物5には存在しなかった(図7)。 代謝産物1および5の単結晶回折データを、Cambridge Crystallographic Data Collection(それぞれ、CCDC1 5 0 0 7 0 5およびCCDC1 5 0 0 7 0 7)に提出した。 化合物1、2、および5の単結晶X線回折分析データを表4に示す。
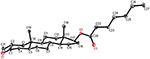
図6. 化合物1の最終X線モデルのコンピュータ生成OREP図面。 カラーコード:カーボン、黒;酸素、赤。図7
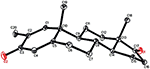
図7。 化合物5の最終X線モデルのコンピュータ生成OREP図面。 カラーコード:カーボン、黒;酸素、赤。テーブル4

テーブル4。 化合物1、2、および5の単結晶X線回折分析。
HeLa、PC3、H640、およびHCT116癌、および3T3正常細胞株に対する細胞毒性
天然産物、例えば、フラボノイド、ステロイド、テルペンなど。 それらが抗癌性、炎症抑制、反leishmanial、抗菌性の活動、等のような多くの生物学的活動のために報告されるので、多くの薬剤の生産のための優秀な源として役 したがって,安全で有効な薬物の合成に役立つ構造-活性関係を研究するためには,それらを導出する必要がある。 現在、多くの医薬品は、それらの中に一連の酵素が存在するため、微生物の生体内変換を介して効率的に合成されている。 Drostanolone(9)、drostanoloneのプロピオン酸塩およびdrostanoloneのheptanoate(1)の報告された抗癌性に基づいて、混合物1-9はHeLa、PC-3、H460およびHCT116癌細胞株に対する細胞毒性のために評価され 興味深いことに、すべての化合物は中等度から強力な抗癌活性を示した。 化合物1〜9の抗癌活性は、Hela(ヒト子宮頸癌)、PC−3(ヒト前立腺癌)、H4 6 0(ヒト肺癌)およびHCT1 1 6(ヒト結腸癌)に対するIC5 0値から推測された(表5)。 これらの結果に基づいて、これらの化合物の細胞毒性はまた、3T3(マウス線維芽細胞)正常細胞株に対して評価され、8(IC50=74.6±3.7μ m)および9(IC50=62.1±1.2μ m)を除くすべての化合物は、非細胞毒性であることが判明した。テーブル5

テーブル5。 HeLa、PC3、H460、およびHCT116癌、および3T3正常細胞株に対する化合物1-9の細胞毒性。
構造活性の関係
代謝産物の構造の変化は、それらの抗癌活性に影響を与えた。 代謝産物2エステル部分の不在、およびc-3、およびC-14で二つのaO-Hグループ、およびc-17でa β o-Hグループは、HeLa、H460、およびHCT116癌細胞株に対して低い細胞毒性を示したが、その抗癌活性は、化合物1と比較して、PC-3癌細胞株に対して高かった。 代謝産物3エステル基と二つのケト基の損失とC-3、およびC-17、およびc-7でaO-Hグループはまた、HeLa、H460、およびHCT116癌細胞株に対して低い活性を示したが、pc-3癌細胞株に対して基質1と比較して活性が増加した。 C-3カルボニルのO-Hへの還元および化合物4におけるエステル部分の加水分解開裂は、HeLaおよびPC-3癌細胞株に対する活性をある程度増加させたが、h460およびHCT116癌細胞株に対する抗癌活性は基質1と比較して減少した。 C-1/C-2とC-4/C-5の間のC=Cの存在は、c-3でC=Oと一緒に、C-17代謝産物5基質1と標準薬(シスプラチン)と比較して、HeLa癌細胞株に対して強力な抗癌剤を作 さらに、PC-3癌細胞株に対するその抗癌活性も基質1と比較して増加した。 興味深いことに、H460およびHCT116癌細胞株に対するその抗癌活性は、化合物1と比較して低かった。 C=Cの存在C-1/C-2とC-4/C-5、c=O C-3、およびc-17、c-11代謝産物6のaO-Hグループと一緒にHeLaに対する抗癌活性を増加させ、pc-3癌細胞株基質1と比較して、標準薬(シスプラチン)としてHeLa癌細胞株に対して同様の抗癌可能性を示した。 しかし、H460、およびHCT116癌細胞株に対するその抗癌活性は、化合物1と比較して減少した。 C=Cの存在C-1/C-2とC-4/C-5、c=O C-3、およびc-17、c-14代謝産物7のaO-Hグループと一緒に再びHeLa、およびPC-3癌細胞株に対する抗癌活性を増加させ、h460、およびHCT116細胞株に対する抗癌活性を基質1と比較して減少させた。 C=C c-1/C-2、C=O C-3、およびC-17、およびc-7でaOH代謝産物8基質1および標準的な薬剤(シスプラチン)と比較してHeLa癌細胞株に対して最も強力な抗癌 また、PC-3癌細胞株に対して良好な活性を示したが、基質1と比較してH460およびHCT116癌細胞株に対する抗癌活性を低下させた。 代謝産物9c-17で唯一の加水分解とHeLa、PC-3、およびHCT116癌細胞株に対する増加した抗癌活性を示したが、h460癌細胞株に対する細胞毒性を減少させた基質1と標準的な薬物(シスプラチン)と比較して。 上記の議論に基づいて、化合物5-8HeLa、およびPC-3癌細胞株に対する抗癌活性の増加は、おそらくc-1/C-2におけるC=C、およびc-3、およびC-17におけるカルボニルケトンの存在によるものであると結論付けることができる1基質と比較して。
結論
著者の貢献
提示された研究の概念は、MICによって開発され、設計されました。 MICはプロジェクトのスーパーバイザーでもありました。 すべてのデータを分析し、MIC、A-t-W、およびHCによって解釈した。 MS、SY、M A、およびNFが実験を行った。 MIC、a-t-W、MSが原稿を書いた。 すべての著者が原稿を改訂しました。 原稿の最終版は、提出前に総務省によって承認されました。
利益相反に関する声明
著者らは、この研究は、利益相反の可能性と解釈される可能性のある商業的または財政的関係がない場合に行われたと宣言している。
謝辞
A-t-W、およびMICは、”食餌療法剤による乳腺発癌の化学予防に関する研究(20-3790/NRPU/R&D/HEC/13/793)の下での財政支援を通じて、パキスタンのイスラマバード高等教育委員会の有効な役割を認めている。”SYは、OPCW(化学兵器の禁止のための組織)と題された研究プロジェクトを通じて、”生体内変換によって得られた新しい同化ステロイドの構造的および生物学的研究”の財政的支援を認めている。”HCは、科学研究のDeanship(DSR)、キングアブドゥルアズィーズ大学、教育省、サウジアラビアの財政支援を認めています。”
補足資料
Eastman,A.(1999)。 “シスプラチンの作用機序:付加体からアポトーシスへ”シスプラチン: 主要な抗癌剤の化学および生化学、ed B.Lippert(Zürich:Verlag Helvetica Chimica Acta)、111-134。 doi:10.1002/9783906390420.ch4
CrossRef全文|Google Scholar
Vardar,E.,Vardar,S.A.,And Cengiz,T.(2002). アナボリック-アンドロゲンステロイドの乱用。 アナト J.精神医学3,104-107.
div