biologische oliën verschillen qua moleculaire structuur en eigenschappen van aardolie (“gewone” dieselbrandstof).

c10h20 (dodecaan) tot en met c15h28 (pentadecaan). Biologische oliën daarentegen zijn “triglyceriden” (geclassificeerd als “esters”) zoals het glyceryltrilinoleaat dat hieronder wordt getoond:
| C12H23, dodecaan | Een triglyceride: glyceryl trilinoleate |
Vanwege hun grote omvang en de daaruit voortvloeiende grote intermoleculaire attracties, de viscositeit van de biologische oliën is over het algemeen te hoog voor toepassing in conventionele dieselmotoren. Biologische oliën verbranden ook iets minder snel, en met een roettere vlam dan petroleum diesel. Biologische oliën kunnen worden gebruikt in conventionele dieselmotoren als ze worden voorverwarmd om hun viscositeit te verminderen, maar dit vereist een extra elektrische verwarming totdat de motor opwarmt. Voor deze resons moeten bilogische oliën worden verwerkt voor gebruik als biodiesel.
een biologische olie is een ester, een soort organische verbinding met de hieronder aangegeven atoomverbinding.
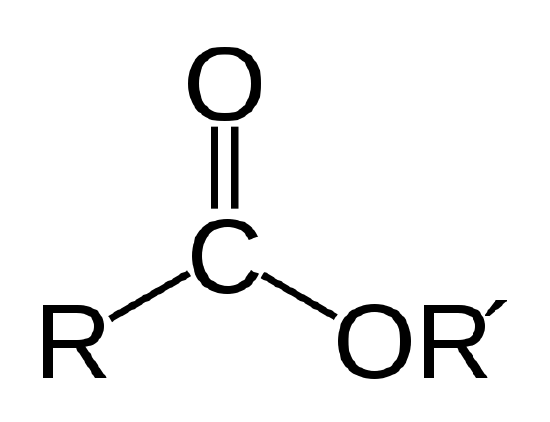 De esterverbinding. R en R’ vertegenwoordigen ketens van koolstof-en waterstofatomen. R = – CH3 en R ‘= – c18h35o2 voor het methylstearaat in Voorbeeld 1 |
glycerol |
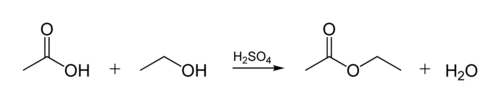
De esterverbinding in biologische oliën ontstaat wanneer een glycerolmolecuul reageert met organische zuren. Het glycerolmolecuul heeft een keten van 3 koolstofatomen, elk met een-OH (alcohol) groep erop. Onderstaande figuur laat zien hoe een organische alcohol reageert met een organisch zuur. Organische scheikundigen verkorten moleculaire structuren–de “zig-zag” lijnen in de figuur vertegenwoordigen koolstofketens met een C atoom bij elke “zig” of “zag”. Elke koolstof heeft 4 bindingen, en als er minder dan 4 worden getoond, wordt aangenomen dat ze naar H-atomen gaan. De alcohol is dus C2H5OH (ethanol), en het zuur is azijnzuur (of ethaanzuur, CH3COOH) in de figuur:
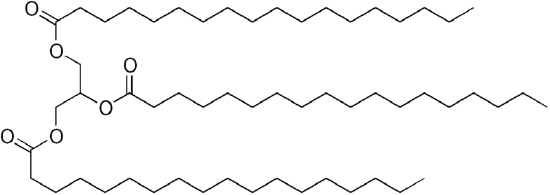
aangezien glycerol 3-OH-groepen heeft, hechten 3 lange keten organische “vetzuren” zich aan het omvangrijke “triglyceride”.
maar net zo gemakkelijk als esters kunnen worden gemaakt van alcoholen en zuren, kunnen zij van alcoholen of zuren wisselen. In de aanwezigheid van een sterke basiskatalysator, zoals NaOH, kan een triglyceride reageren met 3 kleine alcoholmoleculen, zoals methanol (CH3OH), die de glycerol “backbone” vervangen, waardoor 3 afzonderlijke esters met een lager molecuulgewicht
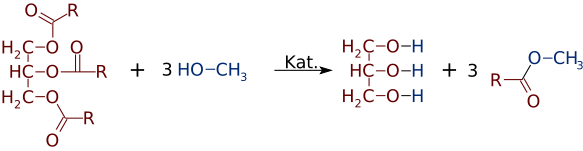
vaak wordt een mengsel van twee of meer producten gevormd. Bijvoorbeeld, wanneer een plantaardige olie reageert met methanol, slechts een of twee van de zuren kunnen worden verplaatst uit de glycerine, produceren slechts 1 of 2 Fame ‘ s.
C3H5(C18H35O2)3 + NaOH + 2 CH3OH → C3H5(C18H35O2)2(OH) + 2 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 1 CH3OH → C3H5(C18H35O2)(OH)2 + 1 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 3 CH3OH → C3H5(oh)3 + 3 C17H35COOCH3
gewoonlijk wordt een grote overmaat aan methanol en natriumhydroxide toegevoegd, zodat de reactie de maximale hoeveelheid Fame oplevert.
maar in het geval van een omestering vindt, ook al is geen van de reagentia volledig verbruikt, geen verdere toename van de hoeveelheden van de producten plaats. We zeggen dat zo ‘ n reactie niet voltooid wordt. Wanneer een mengsel van producten wordt geproduceerd of een reactie niet naar voltooiing gaat, wordt de effectiviteit van de reactie meestal geëvalueerd in termen van procent opbrengst van het gewenste product. Een theoretische opbrengst wordt berekend door aan te nemen dat alle beperkende reagens wordt omgezet in product. De experimenteel bepaalde massa van het product wordt vervolgens vergeleken met de theoretische opbrengst en uitgedrukt als een percentage:

voorbeeld 1 wanneer 100,0 g C3H5(C18H35O2)3 gas en 15,0 g CH3OH bij 55°C worden gemengd met NaOH-katalysator, reageren zij tot 90,96 g c17h35cooch3 methylstearaat biodiesel. Bereken het percentage opbrengst.
oplossing we moeten de theoretische opbrengst van NH3 berekenen, en om dit te doen, moeten we eerst ontdekken of N2 of H2 het beperkende reagens is. Voor de evenwichtige vergelijking
C3H5(C18H35O2)3 + NaOH + 3 CH3OH → C3H5(OH)3 + 3 C17H35COOCH3 stearine + natriumhydroxide + 3 CH3OH → glycerol + 3-methyl-stearaat
De stoichiometrische verhouding van de reactanten is
 Nu de initiële bedragen van de twee reagentia areand
Nu de initiële bedragen van de twee reagentia areand  de verhouding van De initiële investering is dus
de verhouding van De initiële investering is dus Sinds deze ratio is kleiner dan
Sinds deze ratio is kleiner dan  , is er een overmaat van CH3OH. Stearine is het beperkende reagens. Dienovereenkomstig moeten we 0.1122 mol stearine en 0.3366 mol CH3OH (in plaats van 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have
, is er een overmaat van CH3OH. Stearine is het beperkende reagens. Dienovereenkomstig moeten we 0.1122 mol stearine en 0.3366 mol CH3OH (in plaats van 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have so that
so that We can organize these calculations in a table:
We can organize these calculations in a table:
| C3H5(C18H35O2)3(s) | + 3 CH3OH (l) | → 1 C3H5(OH)3 (l) | + 3 C18H35O2)3CH3(s) | ||
|---|---|---|---|---|---|
| m, g | 100.0 g | 15.00 g | 90.96 g | ||
| M, g/mol | 891.5 | 32.04 | 298.5 | 92.1 | |
| n present, mol | 0.1122 mol | 0.4682 mol | |||
| n actual, mol | 0.1122 | 0.3366 | 0.1122 | 0.3366 | |
| m actual, mass | 100.0 | 10.78 | 10.33 | 100.47 |
The percent yield is then
Transesterification is a classic example of a reaction which does not go to completion.