- gastheer-specifieke interactie tussen het Rhizobium en Plantpartners
- Determinate en Indeterminate Noduleontwikkeling
- groei van symbiotische cellen impliceert amplificatie van het gastheergenoom door Endoreduplicatiecycli
- verschillend lot van stikstoffixerende bacteroïden
- Gastheerpeptiden bepalen Bacteroïddifferentiatie
- NCR247: een voorbeeld voor multi-Target Host Effector
- conclusie
- belangenconflict verklaring
gastheer-specifieke interactie tussen het Rhizobium en Plantpartners
de bacteriën die stikstof-fixerende symbiose vormen met peulvruchten die tot verschillende groepen α – En β-proteobacteriën behoren, worden gezamenlijk rhizobia genoemd (Chen et al., 2003; MacLean et al., 2007). Veel α-proteobacteriën zijn betrokken bij langdurige interacties met hogere eukaryoten. Deze interacties variëren van oppervlakte kolonisatie via facultatieve symbiotische relaties tot het verplichten van intracellulaire pathogeen of endosymbiont levensstijl. De symbiotische genen vereist voor knobbelvorming, gastheercelbesmetting en stikstoffixatie zijn verworven door laterale genoverdracht die de primaire bron van genetische diversiteit van rhizobia is. Daarom kan rhizobia nauwer verwant zijn aan pathogenen (zoals Agrobacterium of Brucella) dan aan elkaar. Rhizobia hebben meestal grote genomen (tot 10.5 Mbp) die in snel groeiende rhizobia worden verspreid op meerdere replicons (MacLean et al., 2007). Bijvoorbeeld, Sinorhizobium meliloti, de endosymbiont van Medicago species, heeft een tri-parted genoom; een 3.65 MBP chromosoom en twee megaplasmiden, pSymA en pSymB (1.35 en 1.68 Mbp) die beide onmisbaar zijn en dragen de meerderheid van symbiotische genen. Echter, veel S. meliloti stammen bevatten verdere hulp middelgrote plasmiden en dus, het S. meliloti genoom kan tot 9.000 genen bevatten (Barnett et al., 2001; Capela et al., 2001). In tegenstelling tot rhizobia, bezitten obligate endosymbionts van insecten gewoonlijk een sterk verminderd (160-450 Kbp) genoom dat hun vermenigvuldiging en codes voor een paar specifieke biosynthetische wegen verzekert met inbegrip van die die de behoefte van de gastheer (Moran et al., 2008; Price et al., 2011). Deze ongelooflijk verminderde genomen worden toch versterkt compenserend het verminderde genoom met een polyploïde DNA-inhoud.
De plantenpartners van rhizobia behoren tot de Leguminosae/Fabaceae familie. Stikstoffixatiesymbiose heeft zich in verschillende geslachten ontwikkeld, maar niet alle peulvruchten vormen symbiose. Tot nu toe zijn 12.000 nodulated peulvruchten bekend en elk heeft zijn eigen Rhizobium partner (s). De symbiose wordt veroorzaakt door stikstofgebrek van de waardplant die zijn Rhizobium partner moet kiezen uit miljarden bacteriën in de wortelzone. Dit wordt bereikt door afscheiding van flavonoïde signaalmoleculen uit de wortel die als chemo-lokstoffen maar vooral als inductoren van de Rhizobium nodulatiegenen fungeren (Oldroyd, 2013). Deze genen worden vereist voor de productie van bacteriële signaalmoleculen; de Knobbelfactoren (NFS) die het knobbelontwikkelingsprogramma in de waardplant in gang zetten (Walker en Downie, 2000). De NFS zijn lipochitooligosaccharidemoleculen die gastheerspecifieke substituties op de eindsuikerresiduen en kenmerkende lipideketens dragen, die door lysm-type gastheerreceptoren worden herkend en zowel voor noduleontwikkeling als bacteriële besmetting vereist zijn. Interessant is dat de oude symbiose van landplanten met arbusculaire mycorrhizale (AM) schimmels werkt met soortgelijke lipochitooligosaccharide signaal moleculen, de Myc factoren die worden waargenomen door soortgelijke maar verschillende lysm-type receptoren als de NFs (Abdel-Lateif et al., 2012; Oldroyd, 2013). De Myc factoren en NFs activeren een gemeenschappelijke signalerende weg maar na de betrokkenheid van de gemeenschappelijke symbiotische genen behouden in planten, wijken de wegen af; één leidend tot nodulatie, de andere voor AM symbiose.
Planteninfectie en knobbelvorming zijn ingewikkelde processen; Knobbelfactoren spelen verschillende rollen in knobbelorganogenese en wortelhaarinfectie. Bovendien, naast Nod factoren, verschillende bacteriële oppervlakte polysachariden zijn cruciaal voor een efficiënte infectie (Fraysse et al., 2003). In de meeste peulvruchten, de rhizobia in de gastheer via de wortelharen waar door invaginatie van het plasmamembraan een infectie draad (IT) wordt gevormd die de vermenigvuldigende bacteriën bevat en groeit naar de wortelschors. Een minder frequente en oude wijze van infectie treedt op via scheuren op het worteloppervlak van bepaalde peulvruchten.
Determinate en Indeterminate Noduleontwikkeling
Noduleontwikkeling vereist mitotische reactivering van corticale cellen, wat leidt tot noduleprimordiumvorming, die zich vervolgens onderscheidt in stikstof-fixerende wortelnoduli die microaerobe toestand in de centrale zone bieden voor het functioneren van het zuurstofgevoelige nitrogenase-enzym in de bacteroïden. Afhankelijk van de voorbijgaande en persistente aard van gastheercelproliferatie, kunnen de knobbeltjes of bepaald of onbepaald type zijn (Terpolilli et al., 2012; Kondorosi et al., 2013). Bepaalde knobbeltjes hebben geen meristem en bevatten homogene populatie van symbiotische cellen. Bepaalde knobbeltjes ontwikkelen zich bijvoorbeeld op Phaseolus vulgaris en Lotus japonicus wortels.
integendeel, de actieve celdeling wordt gehandhaafd in de onbepaalde knobbeltjes. Een knobbelmeristem is aanwezig in het apicale gebied (zone I) dat door constante generatie van nieuwe cellen continue groei en langwerpige knobbelvorm veroorzaakt. De cellen die de meristem verlaten delen niet meer en gaan een differentiatiefase in. De infectiedraad geeft de bacteriën vrij in de submeristematische cellen, die geleidelijk differentiëren langs de 12-15 cellagen van de infectiezone (zone II), wat leidt tot de ontwikkeling van stikstof-fixerende symbiotische cellen in nodulezone III (figuur 1; Franssen et al., 1992). Medicago sativa, M. truncatula, Vicia sativa en Pisum sativum zijn voorbeelden van planten die onbepaalde knobbeltjes vormen.
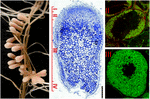
figuur 1. Structuur van stikstof-fixerende wortelknobbels gevormd in S. meliloti-M. truncatula symbiose. De verschillende knobbelzones zijn aangegeven op het longitudinale knobbelgedeelte: (I) meristem, (II) infectiezone, (III) stikstoffixatiezone, (IV) senescentiezone. De symbiotische cellen in zone II bevatten de differentiërende endosymbionts terwijl in zone III het gastheercytoplasma volledig met lange stikstof-bevestigende bacteroïden wordt ingepakt. Endosymbionts gekleurd met Syto9 hebben groene fluorescentie.
groei van symbiotische cellen impliceert amplificatie van het gastheergenoom door Endoreduplicatiecycli
Extreme uitbreiding van plantencellen kan worden waargenomen in zowel de determinate als de onbepaalde knobbeltjes. Het cytoplasma van een stikstof-bevestigende symbiotische cel gastheren ongeveer 50.000 bacteroids. Om zo ‘ n groot aantal endosymbionts tegemoet te komen, groeien de gastheercellen. In M. truncatula knobbeltjes is het volume van de stikstof-fixerende cellen 80-voudig groter dan dat van de diploïde meristematische cellen. De groei van besmette cellen komt stapsgewijs in zone II voor en is het gevolg van herhaalde endoreduplicatie (ER) van het genoom zonder mitose. In zone II is de celcyclus nog steeds actief, maar het ontbreken van mitotische cyclines remt de mitose en transformeert de mitotische cycli naar endoreduplicatie cycli (Cebolla et al., 1999). Dit wordt bereikt door de proteã ne van de schakelaar ccs52a van de celcyclus die door de vernietiging van mitotic cyclins herhaalde rondes van genoomduplicatie leidt tot de vorming van geleidelijk groeiende polyploïde cellen (Roudier et al., 2003; Kondorosi and Kondorosi, 2004). In Medicago species kunnen de ploidy niveaus 64C vertegenwoordigen 64-voudige hoger DNA-gehalte in vergelijking met de haploïde cellen (C komt overeen met het haploïde DNA-gehalte; Vinardell et al., 2003). Down-regulatie van CCS52A in M. truncatula had geen effect op de vorming van primordium, maar was schadelijk voor knobbeldifferentiatie, wat erop wijst dat de ER-cycli en de vorming van grote zeer polyploïde cellen essentieel zijn voor het functioneren van de knobbeltjes (Vinardell et al., 2003). Interessant is dat corticale cellen die AM-schimmels bevatten ook polyploïde zijn, evenals de nematode-voedende reuzenwortelcellen (Favery et al., 2002; Genre et al., 2008). Evenzo, insect symbiotische cellen, de bacteriocyten Herbergen intracellulaire endosymbionts zijn ook groot en polyploïde (Nakabachi et al., 2010). In angiosperm planten, is polyploïdie frequent en het specifieke geërfde patroon van polyploïdie in verschillende organen, weefsels en celtypes suggereren dat het een belangrijke bron van de gespecialiseerde fysiologie van gastheercellen zou kunnen zijn (Nagl, 1976; Edgar et al., 2014). Naast de celgroei, kunnen de veelvoudige genkopieën, gebrek aan chromosoomcondensatie tot hogere transcriptional en metabolische activiteiten bijdragen. Nochtans, stelt de Vereniging van polyploidy met verschillende celfuncties een effect van polyploidy ook op de architectuur van nucleosomen en op het epigenoom voor die activering of repressie van specifieke genomic gebieden controleren. Bijgevolg lijkt het polyploïde genoomgehalte van symbiotische cellen een voorwaarde voor knobbeldifferentiatie en voor de expressie van de meeste symbiotische gastheergenen (Maunoury et al., 2010).
verschillend lot van stikstoffixerende bacteroïden
de bacteriën die vrijkomen uit het IT zijn aanwezig in het gastheercytoplasma als organelachtige structuren, symbiosomen genaamd. De bacteriën hebben geen direct contact met cytoplasma aangezien zij door een peribacteroid membraan, ook als symbiosoommembraan (SM) worden omringd. De bacteroïde, de SM en de ruimte daartussen vormen het symbiosoom (Catalano et al., 2004). De SM tijdens zijn vorming weerspiegelt zijn plasmamembraan oorsprong, latere wijzigingen van zijn samenstelling openen nieuwe, gespecialiseerde rollen op de gastheer-endosymbiont interface (Limpens et al., 2009; Ivanov et al., 2012; Brear et al., 2013; Sinharoy et al., 2013). De bacteroïden vermenigvuldigen zich in de groeiende gastheerknobbelcellen tot een bepaalde celdichtheid, passen zich aan de endosymbiotische levenswijze en microaerobe voorwaarden aan en rijpen aan stikstof-bevestigende bacteroïden. De vorm en fysiologie van bacteroïden kunnen echter opvallend verschillend zijn in de verschillende peulvruchten. In bepaalde peulgastheren, hebben de stikstof-bevestigende bacteroids dezelfde morfologie als gecultiveerde cellen; dit type van bacteroids kan aan de vrij-levende vorm terugkeren. In andere associaties worden de bacteroïden irreversibel getransformeerd tot polyploïde, vergrote, niet-cultiveerbare endosymbionten. Deze terminaal gedifferentieerde bacteroïden kunnen worden verlengd en zelfs vertakt en 5-tot 10-voudig langer dan de vrij-levende cellen of sferisch van 8 tot minstens 20-voudig versterkt genoom afhankelijk van de gastheer (Mergaert et al., 2006; Nakabachi et al., 2010). De einddifferentiatie van bacteroïden wordt gecontroleerd door de gastheer, geëvolueerd in meerdere takken van de Leguminosae familie die gastheer voordeel en waarschijnlijk hogere symbiotische prestaties aangeven (Oono et al., 2010). De terminale bacteroïddifferentiatie is het best opgehelderd in de S. meliloti – M. truncatula symbiose. In M. de knobbeltjes van de truncatula, de meest zichtbare gebeurtenissen van eind bacteroid differentiatie komen in zone II voor. de vermenigvuldiging van bacteroids stopt in het midden van zone II waar de celverlenging en de eenvormige versterking van de veelvoudige replicons door endoreduplicationcycli beginnen. Langs 2-3 cellagen aan de grens van zone II en III (genoemd interzone) is de plotselinge groei van bacteroïden zichtbaar die praktisch hun uiteindelijke grootte bereiken, nochtans, vindt de stikstof-fixatie slechts in zone III plaats.
Gastheerpeptiden bepalen Bacteroïddifferentiatie
vergelijking van nodule transcriptomen van peulvruchten met reversibele en irreversibele bacteroïddifferentiatie toonde het bestaan aan van enkele honderden kleine genen die alleen aanwezig waren in het genoom van die gastplanten waar bacteroïddifferentiatie terminaal was. In M. truncatula produceren de knobbelcellen minstens 600 knobbelspecifieke symbiotische peptiden (symppeps). De symppep genen worden alleen geactiveerd in de S. meliloti geïnfecteerde polyploïde symbiotische cellen (Kevei et al., 2002; Mergaert et al., 2003), echter bepaalde sets op de eerdere, andere tijdens de latere stadia van nodule ontwikkeling. Een groot deel, meer dan 500 genen coderen nodule-specifieke cysteïne-rijke (NCR) peptiden (Mergaert et al., 2003; Alunni et al., 2007; Nallu et al., 2014). De NCR-peptiden zijn gericht op de bacteroïden en wanneer hun levering aan de endosymbionts werd geblokkeerd, werd bacteroïdedifferentiatie afgeschaft waaruit blijkt dat de peptiden verantwoordelijk zijn voor de terminale differentiatie van S. meliloti bacteroïden (van de Velde et al., 2010). De hoge sequentievariatie en de karakteristieke expressiepatronen van NCR-genen suggereren diversiteit in hun functies, werkingsmodi en bacteriële targets in verschillende stadia van bacteroïde rijping (Figuur 2). Echter, waarom produceert de gastheercel een arsenaal van NCRs? Wat kan het voordeel zijn van zo ‘ n divers peptide repertoire? Is het noodzakelijk voor interactie van de gastheer met verschillende bacteriën? De symbiotische partners van M. truncatula zijn S. meliloti en S. medicae, maar in de bodem zijn er talloze varianten van beide soorten. M. truncatula wordt ook vertegenwoordigd door vele verschillende ecotypen en toetredingen verschillend in het aantal, sequenties, en expressie profiel van NCR genen en in hun symbiotische interacties met verschillende S. meliloti en S. medicae stammen (Nallu et al., 2014; Roux et al., 2014). Terwijl een knobbeltje een enkel bacterietype bevat, kunnen de verschillende knobbeltjes op hetzelfde wortelsysteem verschillende bacteriële populaties bezitten. Het is mogelijk dat de plant die de verschillende endosymbionts herkent ze manipuleert met een stamspecifiek repertoire van peptiden. Deze verschillen kunnen een extra controleniveau voor host-symbiont specificiteit en daarmee voor nodulatie efficiëntie toevoegen.

figuur 2. Differentiële expressie van symppep genen in M. truncatula knobbeltjes. Zwart signaal: in situ hybridisatie, blauw signaal: GUS activiteit van symppep promotor-GUS fusions in transgene knobbeltjes.
hoewel symPEPs unieke peptideklassen vertegenwoordigen, lijken hun structuren op antimicrobiële peptiden (AMPs). Versterkers met breed spectrum van microbiële cel-dodende activiteit zijn meestal kationische provocerende celdood door porievorming, membraanverstoring en consequente lysis van microbiële cellen. Het feit dat het celdelingsvermogen definitief verloren gaat tijdens endosymbiont differentiatie geeft aan dat ten minste bepaalde symppeps antimicrobiële activiteiten hebben. Behandeling van bacteriën met synthetische kationische NCR ‘ s leidde inderdaad tot een snelle en efficiënte dosisafhankelijke eliminatie van verschillende gramnegatieve en grampositieve bacteriën waaronder belangrijke menselijke en plantaardige pathogenen (van de Velde et al., 2010; Tiricz et al., 2013). Dit ex – planta dodende effect gecorreleerd met permeabilisatie van microbiële membranen, echter, symppeps in hun natuurlijke omgeving – in de knobbelcellen-niet permeabilize de bacteriële membranen en doden niet de endosymbionts. Hoogstwaarschijnlijk zijn de peptide concentraties in de knobbeltjes beduidend lager dan die toegepast in de analyses in vitro. Bovendien worden kationische peptides geproduceerd samen met anionische en neutrale peptides in dezelfde cel, en de mogelijke combinatie van enkele tientallen of honderden peptides met diverse last en hydrophobicity zou het directe bactericidal effect van kationische peptides kunnen neutraliseren.
de betrokkenheid van AMPs of amp-achtige peptiden is niet uniek voor Rhizobium-peulvruchten symbiose. In de weevil Sitophilus, de symbiotische cellen produceren de antimicrobiële peptide coleoptericine – a (ColA) die de ontwikkeling van gigantische filamenteuze endosymbionts veroorzaakt door het remmen van de celdeling en beschermt de naburige insect weefsels van bacteriële invasie (Login et al., 2011). In dit systeem is één peptide voldoende voor differentiatie van verplicht verticaal overgedragen endosymbiont in tegenstelling tot knobbeltjes die met honderden symppeps werken en ontelbare stamvarianten als hun endosymbionts kunnen hosten. In de aphid-Buchnera symbiose produceren de gastheercellen ook bacteriocyt-specifieke peptiden, waaronder cysteïne rijke peptiden (BCR ‘ s) die lijken op de Medicago NCR peptiden, maar de functies van deze symbiotische peptiden zijn nog niet gemeld (Shigenobu en Stern, 2013).
NCR247: een voorbeeld voor multi-Target Host Effector
Transcriptoom analyse van M. truncatula knobbeltjes in verschillende stadia van hun ontwikkeling, laser microdissection van knobbelgebieden, in situ hybridisatie, immunolocalization van geselecteerde peptides, en symppep promotor-reporter gen fusions in transgene knobbeltjes staan het in kaart brengen van de actie van individuele peptides in de symbiotische cellen van de vroege besmetting tot de late staat van de stikstoffixatie toe. NCR247 wordt uitgedrukt in de oudere cellagen van zone II en in de interzone waar bacteriële celdeling stopt en opmerkelijke verlenging van de endosymbionten optreedt (Farkas et al., 2014). Dit kleine kationische peptide doodde effectief diverse microben in vitro en de analyse in silico wees op zijn extreme eiwitbindingscapaciteiten. FITC-geëtiketteerd NCR247 ging bacteriële cytosol in waar zijn interactie met talrijke bacteriële proteã nen mogelijk waren. Bindingspartners werden geïdentificeerd door behandeling van S. meliloti bacteriën of bacteroïden met StrepII/FLAG-tagged peptiden gevolgd door affiniteitchromatografie en identificatie van interagerende partners met LC-MS / MS en westerse analyse (Farkas et al., 2014).
een van de interactors was het FtsZ-celdelingseiwit dat een cruciale primaire rol speelde bij de celdeling. Van een aantal antibiotische peptiden is bekend dat ze bactericide of bacteriostatisch effect uitoefenen door de interactie met FtsZ, waardoor de polymerisatie ervan wordt geremd waardoor de juiste Z-ring en septumvorming wordt belemmerd (Handler et al., 2008). NCR247 werd Co-gezuiverd met FtsZ uit het bacteriële cytoplasma en bleek de septumvorming te verstoren. NCR035 vertoont in vitro ook een bactericide werking en wordt geproduceerd in dezelfde symbiotische cellen als NCR247 accumuleert op het delings septum, wat wijst op gelijktijdige of opeenvolgende werking van deze peptiden en evolutie van meerdere gastheerstrategieën om endosymbiont proliferatie te remmen. Een andere studie toonde aan dat expressie van belangrijke celdelingsgenen, inclusief genen die nodig zijn voor de Z-ringfunctie, sterk verzwakt waren in cellen die behandeld werden met NCR247 (Penterman et al., 2014). Voorbehandeling van bacteriën met subletale ncr247 concentraties afgeschaft lokalisatie van FITC-NCR035 aan het septum en uitgelokt cel verlenging (Farkas et al., 2014).
ribosomale eiwitten waren de meest voorkomende ncr247-interagerende partners. Ncr247 bleek de bacteriële eiwitsynthese sterk te remmen op een dosisafhankelijke manier, zowel in vivo als in vitro (Farkas et al., 2014). Deze resultaten stelden voor dat één wijze van de ncr247 peptide actie aan de ribosomen zowel in bacteriële cellen als bacteroïden bindt. Interessant, werden een veranderd patroon en verminderde complexiteit van de op elkaar inwerkende proteã nen waargenomen in de bacteroids. Dienovereenkomstig was het algemene uitdrukkingsniveau van ribosomal proteã nen in gemiddelde 20 voudig lager in de bacteroids dan in de vrij-levende cellen met verschillende relatieve overvloed van transcripten van individuele ribosomal proteã nen. De diversificatie van het ribosoom in bacteroids kan een significante rol hebben door tot de geavanceerde vertaling van specifieke proteã nen bij te dragen die daardoor de gespecialiseerde, energie-veeleisende fysiologie van hoogst overvloedige stikstofbevestigingsfunctie steunen.de groel chaperon was ook een directe interactie partner van NCR247 (Farkas et al., 2014). Van de 5 Groeleiwitten is GroEL1 of GroEL2 voldoende om te overleven, terwijl GroEL1 op hoog niveau in de knobbeltje is essentieel voor symbiose (Bittner et al., 2007). Het is nodig voor volledige activering van de nodulatiegenen en assemblage van het nitrogenasecomplex. GroEL bezit extreme functionele veelzijdigheid door met honderden proteã nen in wisselwerking te staan. De ncr247-GroEL1 interactie kan direct gevolgen hebben op GroEL, maar indirect ook op de GroEL substraten en de bijbehorende biologische processen. De afwezigheid van GroEL1 beïnvloedde de bacteriële infectie ernstig en het onderhoud en de differentiatie van bacteroïden die een algemene behoefte aan GroEL1 in alle stadia van stikstoffixatie nodule ontwikkeling aantonen.
de betrokkenheid van GroEL en gastheerpeptiden bij interacties tussen microbe en gastheer is niet uniek voor Rhizobium-peulvruchten symbiose. In de symbiotische weevilcellen interageert coleoptericine-a (ColA) ook met GroEL (Login et al., 2011). GroEL speelt ook een belangrijke rol in het onderhoud van endosymbionts (Moran, 1996; Kupper et al., 2014). Aangezien de meeste symbiotische systemen nog onontgonnen zijn en de high-throughput genomische en proteomische hulpmiddelen pas recent beschikbaar zijn, kunnen we alleen maar voorspellen dat gastheerpeptiden-gemedieerde endosymbiont differentiatie, eveneens genoomversterking van gastheercellen en terminaal gedifferentieerde endosymbionts algemene strategieën van symbiose zijn.
conclusie
symbiotische en pathogene bacteriën gebruiken vergelijkbare benaderingen voor interactie met hun gastheren en overleven in gastheren, zelfs als de resultaten van deze interacties opvallend verschillend zijn. Planten en dieren kunnen aangeboren immuunreacties op micro-organismen genereren op de waarneming van MAMPs (micro-organisme-geassocieerde moleculaire patronen). Deze waarneming resulteert in de activering van signalerende cascades, en de productie van antimicrobiële effectoren. AMP-als gastheerpeptides zoals M. truncatula NCR peptides of de weevil ColA antimicrobial peptide spelen centrale en veelzijdige rollen in het controleren van de vermenigvuldiging en differentiatie van endosymbionts, waardoor de aanwezigheid van bacteriën aan de symbiotische cellen wordt beperkt. Aldus, gebruiken gastheerorganismen deze effectorpeptides om geselecteerde microbiële indringers voor de dienst te temmen en zelfs te huren.
belangenconflict verklaring
De auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.het werk in onze laboratoria wordt ondersteund door de” SYM-BIOTICS ” Advanced Grant van de European Research Council aan Éva Kondorosi (grant number 269067) en door TÁMOP-4.2.2.A-11/1 / KONV-2012-0035 ondersteund door de Europese Unie en medegefinancierd door het Europees Sociaal Fonds.
Abdel-Lateif, K., Bogusz, D., and Hocher, V. (2012). De rol van flavonoïden in de oprichting van plantenwortels endosymbiosen met arbusculaire mycorrhiza schimmels, rhizobia en Frankia bacteriën. Plant Signaal. Behav. 7, 636–641. doi: 10.4161 / psb.20039
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Alunni, B., Kevei, Z., Redondo-Nieto, M., Kondorosi, A., Mergaert, P., and Kondorosi, E. (2007). Genomic organization and evolutionary insights on GRP and NCR genes, two large nodule-specific gene families in Medicago truncatula. Mol. Plant Microbe Interact. 20, 1138–1148. doi: 10.1094/MPMI-20-9-1138
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Barnett, M. J., Fisher, R. F., Jones, T., Komp, C., Abola, A. P., Barloy-Hubler, F., et al. (2001). Nucleotidesequentie en voorspelde functies van het gehele Sinorhizobium meliloti pSymA megaplasmide. Proc. Natl. Acad. Sci. U. S. A. 98, 9883-9888. doi: 10.1073 / pnas.161294798
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Bittner, A. N., Foltz, A., and Oke, V. (2007). Slechts één van de vijf groEL-genen is nodig voor levensvatbaarheid en succesvolle symbiose in Sinorhizobium meliloti. J. Bacteriol. 189, 1884–1889. doi: 10.1128 / JB.01542-06
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Brear, E. M., Day, D. A., and Smith, P. M. (2013). Iron: an essential micronutrient for the legume-Rhizobium symbiosis. Front. Plant Sci. 4:359. doi: 10.3389/fpls.2013.00359
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Catalano, C. M., Lane, W. S., and Sherrier, D. J. (2004). Biochemical characterization of symbiosome membrane proteins from Medicago truncatula root nodules. Electrophoresis 25, 519–531. doi: 10.1002/elps.200305711
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Capela, D., Barloy-Hubler, F., Gouzy, J., Bothe, G., Ampe, F., Batut,J., et al. (2001). Analyse van de chromosoomsequentie van de peulvruchten symbiont Sinorhizobium meliloti stam 1021. Proc. Natl. Acad. Sci. U. S. A. 98, 9877-9882. doi: 10.1073 / pnas.161294398
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Cebolla, A., Vinardell, J. M., Kiss, E., Oláh, B., Roudier, F., Kondorosi, A., et al. (1999). De mitotic inhibitor ccs52 wordt vereist voor endoreduplicatie en ploidy-afhankelijke celuitbreiding in installaties. EMBO J. 18, 4476-4484. doi: 10.1093/emboj/18.16.4476
CrossRef Full Text
Chen, W. M., Moulin, L., Bontemps, C., Vandamme, P., Béna, G., and Boivin-Masson, C. (2003). Peulvruchten symbiotische stikstof fixatie door β-proteobacteriën is wijdverspreid in de natuur. J. Bacteriol. 185, 7266–7272. doi: 10.1128 / JB.185.24.7266-7272.2003
CrossRef Full Text
Edgar, B. A., Zielke, N., and Gutierrez, C. (2014). Endocycles: een terugkerende evolutionaire innovatie voor post-mitotische celgroei. Nat. Rev. Mol. Cel. Biol. 15, 197–210. doi: 10.1038 / nrm3756
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Farkas, A., Maróti, G., Dürgõ, H., Györgypál, Z., Lima, R. M., Medzihradszky, K. F., et al. (2014). De Medicago truncatula symbiotische peptide NCR247 draagt bij tot bacteroïde differentiatie door middel van meerdere mechanismen. Proc. Natl. Acad. Sci. U. S. A. 111, 5183-5188. doi: 10.1073 / pnas.1404169111
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Favery, B., Complainville, A., Vinardell, J. M., Lecomte, P., Vaubert, D., Mergaert, P.,et al. (2002). The endosymbiosis-induced genes ENOD40 and CCS52a are involved in endoparasitic-nematode interactions in Medicago truncatula. Mol. Plant-Microbe Interact. 15, 1008–1013. doi: 10.1094/MPMI.2002.15.10.1008
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franssen, H. J., Vijn, I., Yang, W. C., and Bisseling, T. (1992). Developmental aspects of the Rhizobium-legume symbiosis. Plant Mol. Biol. 19, 89–107. doi: 10.1007
CrossRef Full Text
Fraysse, N., Couderc, F., and Poinsot, V. (2003). Surface polysaccharide involvement in establishing the Rhizobium–legume symbiosis. Eur. J. Biochem. 270, 1365–1380. doi: 10.1046/j.1432-1033.2003.03492.x
CrossRef Full Text
Genre, A., Chabaud, M., Faccio, A., Barker, D. G., and Bonfante, P. (2008). Prepenetratie apparaat assemblage voorafgaat en voorspelt de kolonisatie patronen van arbusculaire mycorrhizal schimmels in de wortelschors van zowel Medicago truncatula en Daucus carota. Plant Cell 20, 1407-1420. doi: 10.1105 / tpc.108.059014
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Handler, A. A., Lim, J. E., and Losick, R. (2008). Peptide remmer van cytokinese tijdens sporulatie in Bacillus subtilis. Mol. Microbiol. 68, 588–599. doi: 10.1111 / j. 1365-2958. 2008. 06173.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ivanov, S., Fedorova, E. E., Limpens, E., De Mita, S., Genre, A., Bonfante, P.,et al. (2012). Rhizobium–legume symbiosis shares an exocytotic pathway required for arbuscule formation. Proc. Natl. Acad. Sci. U.S.A. 109, 8316–8321. doi: 10.1073/pnas.1200407109
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kevei, Z., Vinardell, J. M., Kiss, G. B., Kondorosi, A., and Kondorosi, E. (2002). Glycine-rijke eiwitten gecodeerd door een nodule-specifieke genfamilie zijn betrokken bij verschillende stadia van symbiotische nodule ontwikkeling bij Medicago spp. Mol. Plant Microbe Interactie. 15, 922–931. doi: 10.1094 / MPMI.2002.15.9.922
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Kondorosi, E., and Kondorosi, A. (2004). Endoreduplicatie en activering van het anaphase-bevorderende complex tijdens symbiotische celontwikkeling. FEBS Lett. 567, 152–157. doi: 10.1016 / j.febslet.2004.04.075
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Kondorosi, E., Mergaert, P., and Kereszt, A. (2013). Een paradigma voor endosymbiotisch leven: celdifferentiatie van Rhizobiumbacteriën veroorzaakt door factoren van de waardplant. Annu. Rev. Microbiol. 67, 611–628. doi: 10.1146/annurev-micro-092412-155630
CrossRef Full Text
Kupper, M., Gupta, S. K., Feldhaar, H., and Gross, R. (2014). Veelzijdige rollen van de chaperonine GroEL in micro-organisme-insect interacties. FEMS Microbiol. Lett. 353, 1–10. doi: 10.1111 / 1574-6968. 12390
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Limpens, E., Ivanov, S., van Esse, W., Voets, G., Fedorova, E., and Bisseling, T. (2009). Medicago N2-fixing symbiosomen verwerven de endocytische identiteit marker Rab7 maar vertragen de verwerving van vacuolaire identiteit. Plant Cell 21, 2811-2828. doi: 10.1105 / tpc.108.064410
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Login, F. H., Balmand, S., Vallier, A., Vincent-Monégat, C., Vigneron, A., Weiss-Gayet, M., et al. (2011). Antimicrobiële peptiden houden insecten endosymbionts onder controle. Wetenschap 334, 362-365. doi: 10.1126 / wetenschap.1209728
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
MacLean, A. M., Finan, T. M., and Sadowsky, M. J. (2007). Genomen van de symbiotische stikstofbacteriën van peulvruchten. Plantenfysiol. 144, 615–622. doi: 10.1104 / PP. 107. 101634
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Maunoury, N., Redondo-Nieto, M., Bourcy, M., van de Velde, W., Alunni, B., Laporte, P., et al. (2010). Differentiatie van symbiotische cellen en endosymbionten zijn gekoppeld aan twee transcriptome-schakelaars in Medicago truncatula knobbeltjes. PLoS ONE 5: e9519. doi: 10.1371 / journal.pone.0009519
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Mergaert, P., Nikovics, K., Kelemen, Z., Maunoury, N., Vaubert, D., Kondorosi, A., et al. (2003). Een nieuwe familie in Medicago truncatula bestaande uit meer dan 300 nodule-specifieke genen coderen voor kleine, afgescheiden polypeptiden met geconserveerde cysteïne motieven. Plantenfysiol. 132, 161–173. doi: 10.1104/pp.102.018192
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mergaert, P., Uchiumi, T., Alunni, B., Evanno, G., Cheron, A., Catrice, O.,et al. (2006). Eukaryotic control on bacterial cell cycle and differentiation in the Rhizobium-legume symbiosis. Proc. Natl. Acad. Sci. U.S.A. 103, 5230–5235. doi: 10.1073/pnas.0600912103
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Moran, N. A. (1996). Versnelde evolutie en Muller ‘ s ratel in endosymbiotische bacteriën. Proc. Natl. Acad. Sci. U. S. A. 93, 2873-2878. doi: 10.1073 / pnas.93.7.2873
CrossRef Full Text
Moran, N. A., McCutcheon, J. P., and Nakabachi, A. (2008). Genomica en evolutie van erfelijke bacteriële symbionten. Annu. Eerwaarde Genet. 42, 165–690. doi: 10.1146 / annurev.genet.41.110306.130119
CrossRef Full Text
Nakabachi, A., Koshikawa, S., Miura, T., and Miyagishima, S. (2010). Genoomgrootte van Pachypsylla venusta (Hemiptera): Psyllidae) en de ploidy van zijn bacteriocyt, de symbiotische gastheercel die intracellulaire mutualistische bacteriën met het kleinste cellulaire genoom herbergt. Stier. Entomol. Res. 100, 27-33. doi: 10.1017 / S0007485309006737
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Nagl, W. (1976). DNA endoreduplicatie en polyteny begrepen als evolutionaire strategieën. Natuur 261, 614-615. doi: 10.1038 / 261614a0
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Nallu, S., Silverstein, K. A., Zhou, P., Young, N. D., and Vandenbosch, K. A. (2014). Patronen van divergentie van een grote familie van knobbelige cysteïne-rijke peptiden in toetredingen van Medicago truncatula. Plant J. 78, 697-705. doi: 10.1111 / tpj.12506
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Oldroyd, G. E. (2013). Speak, friend, and enter: signaleringssystemen die nuttige symbiotische associaties in planten bevorderen. Nat. Rev. Microbiol. 11, 252–263. doi: 10.1038/nrmicro2990
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Oono, R., Schmitt, I., Sprent, J. I., and Denison, R. F. (2010). Multiple evolutionary origins of legume traits leading to extreme rhizobial differentiation. New Phytol. 187, 508–520. doi: 10.1111/j.1469-8137.2010.03261.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Penterman, J., Abo, R. P., De Nisco, N. J., Arnold, M. F., Longhi, R., Zanda, M.,et al. (2014). De peptiden van de waardplant wekken een transcriptionele reactie op om de celcyclus van Sinorhizobium meliloti tijdens symbiose te controleren. Proc. Natl. Acad. Sci. U. S. A. 111, 3561-3566. doi: 10.1073 / pnas.1400450111
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Price, D. R., Duncan, R. P., Shigenobu, S., and Wilson, A. C. (2011). Genoomuitbreiding en differentiële expressie van aminozuurtransporters op de symbiotische interface tussen bladluis en buchnera. Mol. Biol. Evol. 28, 3113–3126. doi: 10.1093/molbev/msr140
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Roudier, F., Fedorova, E., Lebris, M., Lecomte, P., Györgyey, J., Abad, P.,et al. (2003). The Medicago species A2-type cyclin is auxin regulated and involved in meristem formation but dispensable for endoreduplication-associated developmental programs. Plant Physiol. 131, 1091–1103. doi: 10.1104/pp.102.011122
CrossRef Full Text
Roux, B., Rodde, N., Jardinaud, M. F., Timmers, T., Sauviac, L., Cottret, L.,et al. (2014). Een geïntegreerde analyse van installatie en bacteriële genuitdrukking in symbiotische wortelknobbels gebruikend laser-capture microdissection gekoppeld aan het rangschikken van RNA. Plant J. 77, 817-837. doi: 10.1111 / tpj.12442
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Shigenobu, S., and Stern, D. L. (2013). Bladluizen ontwikkelden nieuwe afgescheiden eiwitten voor symbiose met bacteriële endosymbiont. Proc. Biol. Sci. 280, 20121952. doi: 10.1098 / rspb.2012.1952
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Sinharoy, S., Torres-Jerez, I., Bandyopadhyay, K., Kereszt, A., Pislariu, C. I., Nakashima, J., et al. (2013). De C2H2-Regelgever van de transcriptiefactor van symbiosoomdifferentiatie onderdrukt de transcriptie van het secretoire Weggen VAMP721a en bevordert symbiosoomontwikkeling in Medicago truncatula. Plant Cell 25, 3584-3601. doi: 10.1105 / tpc.113.114017
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Terpolilli, J. J., Hood, G. A., and Poole, P. S. (2012). What determines the efficiency of N(2)-fixing Rhizobium-legume symbioses? Adv. Microb. Physiol. 60, 325–389. doi: 10.1016/B978-0-12-398264-3.00005-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tiricz, H., Szûcs, A., Farkas, A., Pap, B., Lima, R. M., Maróti, G.,et al. (2013). Antimicrobial nodule-specific cysteine-rich peptides induce membrane depolarization associated changes in Sinorhizobium meliloti. Appl. Env. Microbiol. 79, 6737–6746. doi: 10.1128/AEM.01791-13
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Van de Velde, W., Zehirov, G., Szatmari, A., Debreczeny, M., Ishihara, H., Kevei, Z.,et al. (2010). Plant peptides govern terminal differentiation of bacteria in symbiosis. Science 327, 1122–1126. doi: 10.1126/science.1184057
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vinardell, J. M., Fedorova, E., Cebolla, A., Kevei, Z., Horvath, G., Kelemen, Z.,et al. (2003). Endoreduplicatie bemiddeld door de anaphase-bevorderende complexe activator CCS52A is vereist voor symbiotische celdifferentiatie in Medicago truncatula knobbeltjes. Plant Cell 15, 2093-2105. doi: 10.1105 / tpc.014373
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Walker, S. A., and Downie, J. A. (2000). Binnenkomst van Rhizobium leguminosarum bv. viciae in wortelharen vereist minimale nod-factor specificiteit, maar de verdere groei van de infectiedraad vereist nodO of knoop. Mol. Plant-Microbe Interactie.13, 54–62. doi: 10.1094 / MPMI.2000.13.7.754
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text