doseringsvorm: injectie
medisch beoordeeld door Drugs.com. laatst bijgewerkt op 22 mei 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Interactions
- More
FOR USE IN NERVE AGENT POISONING ONLY
A Sterile Solution For Intramuscular Use Only
Rx Only
- Pralidoxime Chloride Description
- Pralidoximchloride – Klinische Farmacologie
- indicaties en gebruik voor Pralidoxime Chloride
- contra-indicaties
- waarschuwingen
- voorzorgsmaatregelen
- Algemeen:
- informatie voor patiënten:
- laboratoriumtests:
- geneesmiddelinteracties:
- carcinogenese, mutagene werking, verminderde vruchtbaarheid:
- zwangerschap
- zogende moeder:
- gebruik bij kinderen
- bijwerkingen
- drugsmisbruik en-afhankelijkheid
- overdosering
- manifestaties van overdosering:
- behandeling van overdosering:
- Acute Toxicity:
- Pralidoximchloride dosering en toediening
- gebruiksaanwijzing:
- Hoe wordt Pralidoxime Chloride geleverd
- Principal Display-Paneel – Pralidoxime Chloride Injectie, 300mg Label
- meer over pralidoxime
- Consument hulpbronnen
- Professionele hulpbronnen
- behandeling in Verband met gidsen
Pralidoxime Chloride Description
Pralidoxime Chloride Injection (auto-injector) provides Pralidoxime Chloride in a sterile solution for intramuscular injection.
Elke voorgevulde auto-injector levert een dosis van het antidotum, Pralidoxime Chloride in een op zichzelf staande eenheid, speciaal ontworpen voor automatische zelf-of buddy – toediening door militair personeel. Pralidoxime in de auto-injector kan ook worden toegediend door gekwalificeerde civiele hulpverleners die een adequate training hebben gehad in de herkenning en behandeling ter plaatse van zenuwgasintoxicatie in het geval van een accidentele afgifte van zenuwgas. De aanbevolen procedure (zie dosering en toediening) is het injecteren van de inhoud van de auto-injector in de spieren van de buitenste dij.
nadat een auto-injector is geactiveerd, dient de lege container op de juiste manier te worden weggegooid (zie dosering en toediening), deze kan niet opnieuw worden gevuld en de uitstekende naald kan niet worden teruggetrokken.
wanneer geactiveerd, geeft elke auto-injector 600 mg Pralidoxime Chloride af in 2 mL van een steriele oplossing met 20 mg / mL benzylalcohol, 11,26 mg / mL glycine in Water voor injectie, USP. De pH wordt aangepast met zoutzuur. Het pH-bereik is 2,0-3,0. Het product is pyrogenvrij.
Pralidoximchloride is een cholinesterase-reactivator.
Chemische naam: 2-formyl-1 methylpyridiniumchloride oxime (pyridine-2-aldoximmethochloride). Ook wel aangeduid als 2-PAM Chloride.
structuurformule:
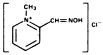
Pralidoximchloride komt voor als een reukloos, wit, niet-hygroscopisch kristallijn poeder dat oplosbaar is in water tot 1 g in minder dan 1 mL. Stabiel in lucht, smelt het tussen 215°C en 225°C, met ontbinding.
de specifieke activiteit van het geneesmiddel ligt in het 2-formyl-1 methylpyridiniumion en is onafhankelijk van het gebruikte zout. Het chloride heeft de voorkeur vanwege de fysiologische compatibiliteit, uitstekende wateroplosbaarheid bij alle temperaturen, en hoge potentie per gram, vanwege zijn lage (173) molecuulgewicht.
Pralidoximchloride – Klinische Farmacologie
Pralidoximchloride is een cholinesterasereactivator.
de belangrijkste werking van pralidoxime is het reactiveren van cholinesterase (voornamelijk buiten het centrale zenuwstelsel) dat geïnactiveerd is door fosforylering veroorzaakt door een organofosfaatbestrijdingsmiddel of verwante verbinding. De vernietiging van geaccumuleerde acetylcholine kan dan doorgaan en neuromusculaire verbindingen zullen weer normaal functioneren. Pralidoxime vertraagt ook het proces van “veroudering” van gefosforyleerde cholinesterase tot een niet-reactiveerbare vorm, en ontgift bepaalde organofosfaten door directe chemische reactie. Het medicijn heeft zijn meest kritische effect bij het verlichten van verlamming van de ademhalingsspieren. Omdat pralidoxime minder effectief is in het verlichten van depressie van het ademhalingscentrum, is atropine altijd gelijktijdig nodig om het effect van geaccumuleerde acetylcholine op deze plaats te blokkeren. Pralidoxime verlicht muscarine tekenen en symptomen, speekselvloed, bronchospasme, enz., maar deze actie is relatief onbelangrijk omdat atropine geschikt is voor dit doel.
Pralidoxime wordt gedistribueerd door het extracellulaire water, het wordt niet gebonden aan plasma-eiwitten. Het geneesmiddel wordt snel uitgescheiden in de urine deels onveranderd, en deels als metaboliet geproduceerd door de lever. Als gevolg daarvan is pralidoxim relatief kortwerkend en kunnen herhaalde doses nodig zijn, vooral wanneer er aanwijzingen zijn dat het GIF nog steeds wordt geabsorbeerd.
De minimale therapeutische concentratie van pralidoxime in plasma is 4 µg / mL; dit niveau wordt bereikt in ongeveer 16 minuten na een enkele injectie van 600 mg Pralidoxime Chloride. De schijnbare halfwaardetijd van Pralidoximchloride is 74-77 minuten.
Er is gerapporteerd dat het aanvullende gebruik van oxime cholinesterase-reactivatoren (zoals pralidoxime) de incidentie en ernst van ontwikkelingsstoornissen vermindert bij kippenembryo ‘ s die zijn blootgesteld aan bekende teratogenen als parathion, bidrin, carbachol en neostigmine. Dit beschermende effect van de oximes bleek dosisafhankelijk te zijn.
indicaties en gebruik voor Pralidoxime Chloride
deze auto-injector voor Pralidoxime Chloride is specifiek geïndiceerd voor intramusculair gebruik als aanvulling op atropine bij de behandeling van vergiftiging door zenuwmiddelen met anticholinesterase-activiteit.
contra-indicaties
De Pralidoxime Chloride auto-injector is gecontra-indiceerd bij patiënten die overgevoelig zijn voor een bestanddeel van het product.
waarschuwingen
Pralidoxime is niet effectief bij de behandeling van vergiftiging als gevolg van fosfor, anorganische fosfaten of organofosfaten die geen anticholinesterase-activiteit hebben.
voorzorgsmaatregelen
Algemeen:
Pralidoxime wordt in de meeste gevallen zeer goed verdragen, maar men moet niet vergeten dat de wanhopige toestand van de met organofosfaat vergiftigde patiënt in het algemeen kleine tekenen en symptomen maskeert die bij normale proefpersonen zijn waargenomen.
omdat pralidoxime wordt uitgescheiden in de urine, zal een afname van de nierfunctie resulteren in verhoogde bloedspiegels van het geneesmiddel. Daarom moet de dosering van pralidoxime worden verlaagd in geval van nierinsufficiëntie.
informatie voor patiënten:
De Pralidoxime Chloride auto-injector mag alleen zelf of met vrienden worden toegediend door militair personeel of door gekwalificeerde civiele hulpverleners nadat de volgende gebeurtenissen zich hebben voorgedaan:
– de persoon heeft zijn masker aangetrokken nadat hij het bestaan van een gevaar voor een chemisch agens in zijn omgeving heeft erkend-sommige of alle hieronder genoemde symptomen van zenuwagens vergiftiging zijn aanwezig: onverklaarbare benauwdheid van de loopneus op de borst met ademhalingsmoeilijkheden vastgestelde pupillen van het oog, resulterend in wazig zien kwijlen, overmatig zweten misselijkheid, braken en buikkrampen onvrijwillig plassen en ontlasting schokken, trekkingen, en onthutsende hoofdpijn, sufheid, coma, convulsies onderbreking van de ademhaling
Er moeten passende maatregelen worden genomen om ervoor te zorgen dat personeel dat is uitgerust met auto-injectoren de indicaties en het gebruik ervan begrijpt, inclusief het beoordelen van vergiftigingssymptomen en het bedienen van de auto-injector.
laboratoriumtests:
behandeling van organofosfaatvergiftiging dient te worden ingesteld zonder de resultaten van laboratoriumtests af te wachten. Metingen van rode bloedcellen, plasmacholinesterase en paranitrofenol in de urine (in het geval van blootstelling aan parathion) kunnen nuttig zijn bij het bevestigen van de diagnose en het volgen van het verloop van de ziekte. Alleen bij organofosfaat-estervergiftiging is een daling van de cholinesteraseconcentratie in de rode bloedcellen tot minder dan 50% van de normale waarde waargenomen.
geneesmiddelinteracties:
wanneer atropine en pralidoxime samen worden gebruikt, kunnen de tekenen van atropinisatie (blozen, mydriasis, tachycardie, droge mond en neus) eerder optreden dan verwacht wanneer atropine alleen wordt gebruikt. Dit geldt vooral als de totale dosis atropine hoog is geweest en de toediening van pralidoxime is uitgesteld.2, 3, 4
bij de behandeling van anticholesterinase-vergiftiging moeten de volgende voorzorgsmaatregelen in gedachten worden gehouden, hoewel ze niet direct van invloed zijn op het gebruik van pralidoxim; aangezien barbituraten worden versterkt door de anticholinesterasen, moeten ze met voorzichtigheid worden gebruikt bij de behandeling van convulsies; morfine, theofylline, aminofylline, succinylcholine, reser-pine en fenothiazine-achtige kalmeringsmiddelen moeten worden vermeden bij patiënten met organofosfaatvergiftiging.
carcinogenese, mutagene werking, verminderde vruchtbaarheid:
aangezien de pralidoxime Chloride auto-injector alleen geïndiceerd is voor kortdurend gebruik in noodgevallen, zijn er geen onderzoeken uitgevoerd door de fabrikant naar de mogelijkheid van carcinogenese, mutagenese of aantasting van de vruchtbaarheid of zijn er geen meldingen in de literatuur.
zwangerschap
reproductiestudies bij dieren zijn niet uitgevoerd met pralidoxim. Het is ook niet bekend of pralidoxime foetale schade kan veroorzaken bij toediening aan een zwangere vrouw of de voortplantingscapaciteit kan beïnvloeden. Pralidoxime mag alleen aan een zwangere vrouw worden gegeven als dit duidelijk noodzakelijk is.
zogende moeder:
Het is niet bekend of dit geneesmiddel wordt uitgescheiden in de moedermelk. Omdat veel geneesmiddelen in de moedermelk worden uitgescheiden, moet voorzichtigheid worden betracht wanneer pralidoxime wordt toegediend aan een vrouw die borstvoeding geeft.
gebruik bij kinderen
veiligheid en werkzaamheid bij kinderen zijn niet vastgesteld.
bijwerkingen
veertig tot 60 minuten na intramusculaire injectie kan lichte tot matige pijn op de injectieplaats optreden.Pralidoxime kan wazig zien, diplopie en verminderde accommodatie, duizeligheid, hoofdpijn, slaperigheid, misselijkheid, tachycardie, verhoogde systolische en diastolische bloeddruk, hyperventilatie en spierzwakte veroorzaken wanneer het parenteraal wordt toegediend aan normale vrijwilligers die niet zijn blootgesteld aan anticholinesterase-vergiften. Bij patiënten is het zeer moeilijk om de toxische effecten van atropine of de organofosfaatverbindingen te onderscheiden van die van het geneesmiddel.
verhogingen van SGOT-en / of SGPT-enzymspiegels werden waargenomen bij 1 van de 6 normale vrijwilligers die 1200 mg Pralidoxime-Chloride intramusculair kregen en bij 4 van de 6 vrijwilligers die 1800 mg intramusculair kregen. Na ongeveer 2 weken zijn de waarden weer normaal. Voorbijgaande verhogingen van creatinefosfokinase werden waargenomen bij alle normale vrijwilligers die het geneesmiddel kregen. Een eenmalige intramusculaire injectie van 330 mg in 1 mL bij konijnen veroorzaakte myonecrose, ontsteking en bloeding.
wanneer atropine en pralidoxime samen worden gebruikt, kunnen de tekenen van atropinisatie eerder optreden dan zou kunnen worden verwacht wanneer atropine alleen wordt gebruikt. Dit geldt vooral als de totale dosis atropine hoog is geweest en de toediening van pralidoxime is uitgesteld.2, 3, 4 opwinding en manisch gedrag onmiddellijk na herstel van het bewustzijn zijn in verschillende gevallen gemeld. Echter, vergelijkbaar gedrag is opgetreden in gevallen van organofosfaat vergiftiging die niet werden behandeld met pralidoxim.3, 5, 6
drugsmisbruik en-afhankelijkheid
Pralidoximchloride is niet onderhevig aan misbruik en bezit geen bekende mogelijkheid tot afhankelijkheid.
overdosering
manifestaties van overdosering:
alleen waargenomen bij normale personen: duizeligheid, wazig zien, diplopie, hoofdpijn, verminderde accommodatie, misselijkheid, lichte tachycardie. In therapie is het moeilijk geweest om bijwerkingen als gevolg van de drug te onderscheiden van die als gevolg van de effecten van het GIF.
behandeling van overdosering:
kunstmatige ademhaling en andere ondersteunende therapie dienen indien nodig te worden toegediend.
Acute Toxicity:
i.v.—man TDLo: 14 mg/kg (toxic effects: CNS) i.v.— rat LD50: 96 mg/kg i.m.—rat LD50: 150 mg/kg oral—mouse LD50: 4100 mg/kg i.p.—mouse LD50: 155 mg/kg i.v.—mouse LD50: 90 mg/kg i.m.—mouse LD50: 180 mg/kg i.v.—rabbit LD50: 95 mg/kg i.m.—guinea pig LD50: 168 mg/kg
Pralidoximchloride dosering en toediening
blootstelling aan zenuwmiddelen met anticholinesterase—activiteit (organofosfaattype)
licht geval—hoofdpijn, wazig zien, lichte muscarineverschijnselen
matig ernstig geval-overmatig zweten, traanvorming, speekselvloed, diarree, beklemming op de borst
voor optimale reactivering van organofosfaat-geïnhibeerde cholinesterase, atropine en pralidoxime dient zo snel mogelijk na blootstelling te worden toegediend. Dien, afhankelijk van de ernst van de symptomen, onmiddellijk één atropine-bevattende auto-injector toe, gevolgd door één pralidoxime-bevattende auto-injector. Atropine moet eerst worden toegediend totdat de effecten ervan duidelijk worden en pas daarna dient pralidoxime te worden toegediend. Als de symptomen van het zenuwgas na 15 minuten nog steeds aanwezig zijn, herhaal dan de injecties. Als er na nog eens 15 minuten symptomen zijn, herhaal dan de injecties voor een derde keer. Als na de derde reeks injecties de symptomen blijven bestaan, geef dan geen antidota meer, maar zoek medische hulp.
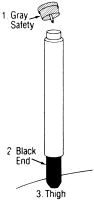
gebruiksaanwijzing:
wanneer, zoals hierboven beschreven, gebruik van een auto-injector is geïndiceerd, ga dan als volgt te werk:
|
 |
zeer ernstig geval — cyanose, respiratoire gêne, Coma
de eerste maatregelen omvatten het verwijderen van afscheidingen, het behoud van een open luchtweg en, indien nodig, kunstmatige ventilatie. Atropine mag niet worden gebruikt totdat cyanose is overwonnen, aangezien atropine ventriculaire fibrillaties veroorzaakt in aanwezigheid van hypoxie. Morfine, theofylline, aminofylline of succincylcholine zijn gecontra-indiceerd. Tranquillizers van het reserpine-of fenothiazine-type moeten worden vermeden.
“Pralidoxime is het meest effectief als het onmiddellijk na vergiftiging wordt toegediend. Over het algemeen wordt weinig bereikt als het medicijn meer dan 36 uur na beëindiging van de blootstelling wordt gegeven. Wanneer het GIF is ingenomen, kan de blootstelling echter enige tijd aanhouden als gevolg van langzame absorptie vanuit de onderbuik, en fatale recidieven zijn gemeld na initiële verbetering. Voortgezette toediening gedurende meerdere dagen kan bij deze patiënten nuttig zijn. Zorgvuldige controle van de patiënt is geïndiceerd gedurende ten minste 48 tot 72 uur. Als huidblootstelling heeft plaatsgevonden, moet de kleding worden verwijderd en moeten het haar en de huid zo snel mogelijk grondig worden gewassen met natriumbicarbonaat of alcohol. Diazepam kan met voorzichtigheid worden toegediend als convulsies niet onder controle worden gehouden door atropine.”7
belangrijk: artsen en / of ander medisch personeel dat geëvacueerde slachtoffers van ZENUWMIDDELEN helpt, moeten voorkomen dat zij worden blootgesteld aan besmetting door de kleding van de slachtoffers.
Hoe wordt Pralidoxime Chloride geleverd
Pralidoxime Chloride wordt geleverd in waterige oplossing die vooraf is gevuld in de auto-injector (600 mg, 2 mL) voor militair gebruik en voor gebruik door gekwalificeerde civiele hulpverleners. Auto-injectoren worden geleverd door het directoraat van medisch materiaal, Defense Supply Center Philadelphia of Andere analoge lokale, staats-of federale agentschap.
wanneer geactiveerd, geeft elke auto-injector 600 mg Pralidoxime Chloride af in 2 mL van een steriele oplossing met 20 mg / mL benzylalcohol, 11,26 mg / mL glycine in Water voor injectie, USP. De pH wordt aangepast met zoutzuur. De pH is 2,0-3,0 het product is pyrogenvrij.
Bewaren bij 25°C; excursies toegestaan tot 15-30°C (59-86°F).niet invriezen.
Meridian Medical Technologies, Inc.
Columbia, MD 21046
A Pfizer Company
00001976
08/16
Printed in U. S. A.
- Landauer, W.: Cholinomimetic tetrogens. V. het effect van oximen en verwante cholinesterase reactivatoren, Teratologie 15: 33 (Feb.) 1977.
- Moller, K. O., Jenson-Holm, J., and Lausen, H. H.: Ugeskr. Laeg.123:501, 1961.
- Namba, T., Nolte, C. T., Jackrel, Jr., en Grob, D.: vergiftiging als gevolg van organofosfaat insecticiden. Acute en chronische manifestaties, Amer. J. Med. 50: 475 (Apr.) 1971.Arena, J. M.: Poisoning. Toxicologie. Symptoom. Behandelingen, ed. 4, Springfield, Ziek., Charles C. Thomas, 1979, blz. 133.
- Brachfeld, J., and Zavon, M. R.: Organic phosphate (Phosdrin®) intoxication. Verslag van de zaak en de resultaten van de behandeling met 2-PAM, Arch. Environ. Gezondheid 11: 859,1965.
- Hayes, W. J., Jr.: Toxicology of Pesticides, Baltimore, The Williams & Wilkins Company, 1975, p. 416.
- Ama Department of Drugs: Ama Drug Evaluations, ed. 4, Chicago, American Medical Association, 1980, blz. 1455.
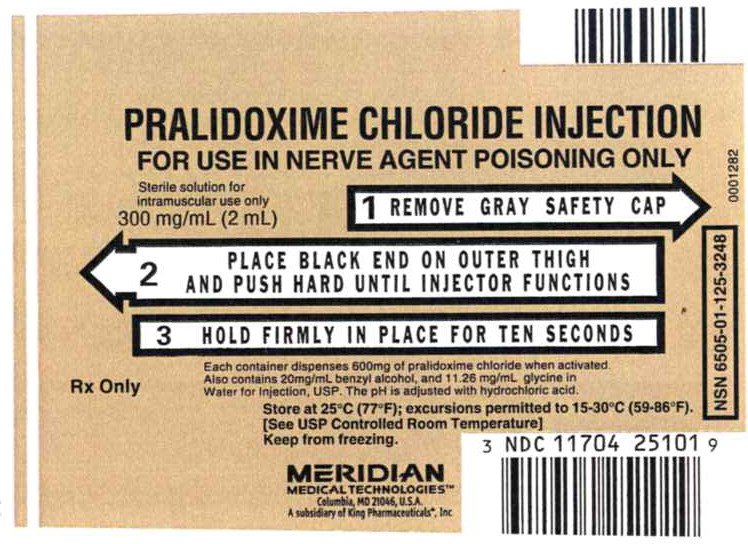
Principal Display-Paneel – Pralidoxime Chloride Injectie, 300mg Label
NDC 11704-107-01
Pralidoxime Chloride INJECTIE
VOOR GEBRUIK IN zenuwgas VERGIFTIGING ALLEEN
Steriele oplossing voor intramusculair gebruik alleen
300 mg/mL (2 mL)
1 VERWIJDER GRIJS SAFETY CAP
2 PLAATS de ZWARTE UITEINDE AAN de BUITENKANT van de DIJ EN DUW HARD TOT INJECTOR FUNCTIES
3 HOUD het STEVIG OP zijn PLAATS GEDURENDE TIEN SECONDEN
Elke container verdeelt 600mg van Pralidoxime Chloride, wanneer actief.
bevat ook 20 mg/mL benzylalcohol en 11.26 mg / mL glycine in
Water voor injectie, USP. De pH wordt aangepast met zoutzuur.
Rx alleen
Bewaren bij 25°C; excursies toegestaan tot 15-30°C (59-86°F).
niet invriezen.
MERIDIAN MEDICAL TECHNOLIGIESTM
Columbia, MD 21046, USA
A subsidiary of King Pharmaceuticals®, Inc
NDC 11704-251-01
NSN 6505-01-125-3248
| Pralidoxime Chloride Pralidoxime Chloride injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Meridian Medical Technologies, Inc. (167671341)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Meridian Medical Technologies, Inc. | 038889234 | MANUFACTURE(11704-251), ANALYSIS(11704-251) | |
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Meridian Medical Technologies, Inc. | 078808315 | MANUFACTURE(11704-251), LABEL(11704-251), PACK(11704-251) | |
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Meridian Medical Technologies, Inc. | 167671341 | MANUFACTURE(11704-251), LABEL(11704-251), PACK(11704-251), ANALYSIS(11704-251) | |
meer over pralidoxime
- bijwerkingen
- Tijdens de zwangerschap
- doseringsinformatie
- geneesmiddelinteracties
- : antidota
- FDA Waarschuwingen (1)
Consument hulpbronnen
- Patiënt Informatie
- Pralidoxime Injectie (Advanced Lezen)
Professionele hulpbronnen
- Prescribing Information
- Pralidoxime (Professionele Patiënt Advies)
Overige merken Protopam Chloride
behandeling in Verband met gidsen
- Anticholinesterase Overdosis
- Organofosfaat-Vergiftiging
- zenuwgas Vergiftiging
Medische Disclaimer