
Sau (Larry) Lee, Ph.D., Adjunct-directeur van het Office of Testing and Research, en voorzitter van het Emerging Technology Team, Office of Pharmaceutical Quality, Cder
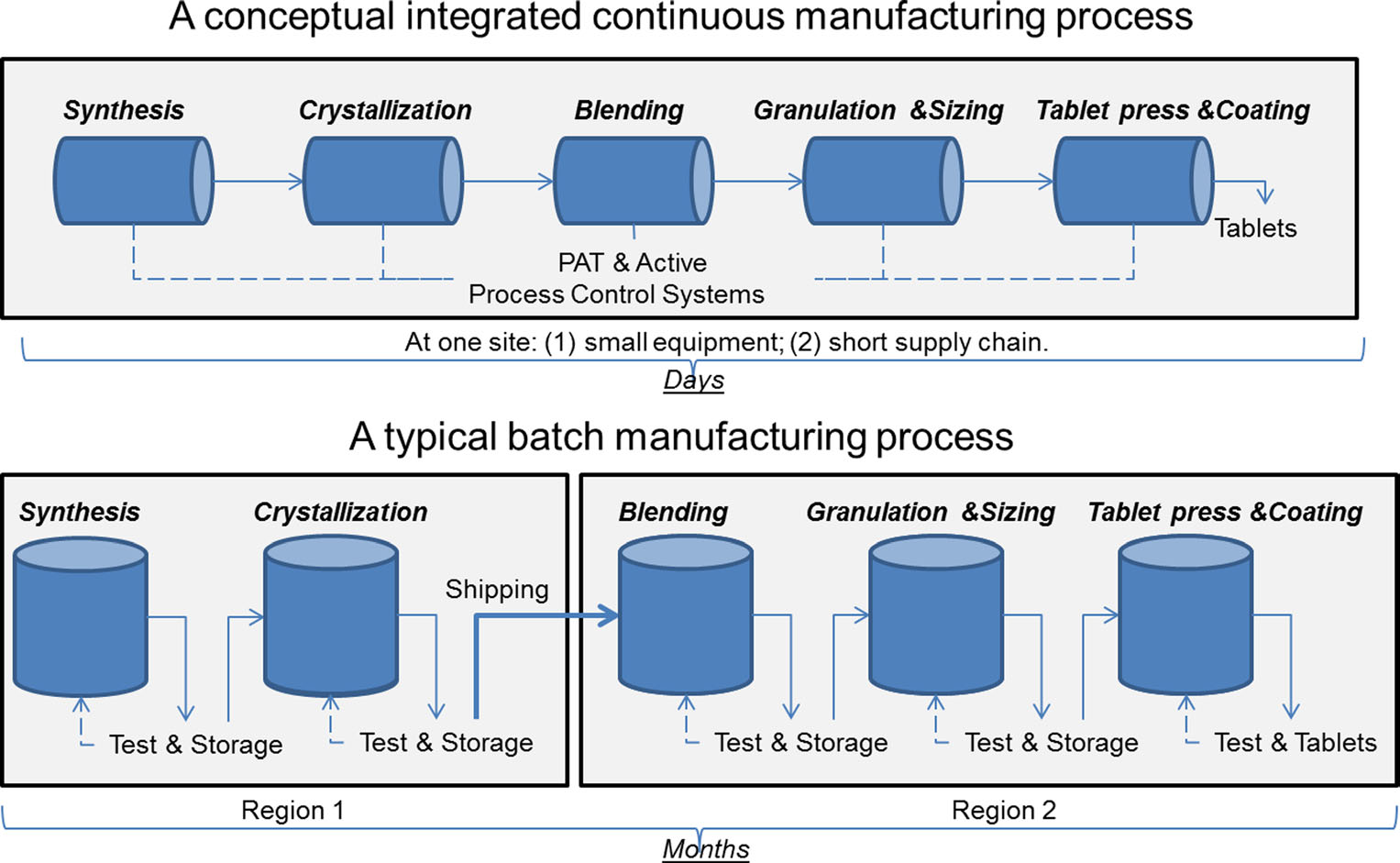 a comparison of continuous manufacturing and batch manufacturing. Figuur met dank aan sau Lee. J. Pharm Innov (2015) 10: 191-199.
a comparison of continuous manufacturing and batch manufacturing. Figuur met dank aan sau Lee. J. Pharm Innov (2015) 10: 191-199.al meer dan 50 jaar worden geneesmiddelen vervaardigd met behulp van een methode die bekend staat als “batch manufacturing”, een meerstaps, langdurig proces waarbij gebruik wordt gemaakt van onhandige, grootschalige apparatuur. Recente ontwikkelingen in de productietechnologie hebben de farmaceutische industrie echter ertoe aangezet om te overwegen om van batchproductie over te stappen op een sneller, efficiënter proces dat continuproductie wordt genoemd. De FDA onderneemt proactieve stappen om de implementatie van opkomende technologieën door de drugindustrie te vergemakkelijken, waaronder continue productie, om de productkwaliteit te verbeteren en veel van de onderliggende oorzaken van drugstekorten en terugroepacties aan te pakken.
Batch Versus continue productie
batchproductie omvat meerdere afzonderlijke stappen. Na elke stap in het proces stopt de productie meestal, zodat monsters offline op kwaliteit kunnen worden getest. Soms tijdens deze” hold times ” tussen stappen, het materiaal kan worden opgeslagen in containers of verscheept naar andere faciliteiten over de hele wereld om het productieproces te voltooien. Dit kan weken of maanden toevoegen aan de verwerkingstijd. Voor sommige actieve ingrediënten die gevoelig zijn voor het milieu, kan het ook leiden tot het risico van afbraak. Bovendien, als de vraag naar een bepaalde drug pieken, verhoogde productie kan grotere apparatuur nodig. Deze schaalvergroting van apparatuur vereist meer fysieke ruimte, een grotere voetafdruk, en meer tijd en geld.
daarentegen worden geneesmiddelen die worden gemaakt met behulp van continue productie non-stop binnen dezelfde faciliteit verplaatst, waardoor de wachttijden tussen de stappen worden geëlimineerd. Materiaal wordt gevoed door een assemblagelijn van volledig geïntegreerde componenten. Deze methode bespaart tijd, vermindert de kans op menselijke fouten, en kan beter reageren op veranderingen in de markt. Om rekening te houden met de hogere vraag, kan continue productie langer duren, wat de kans op drugstekorten kan verkleinen.
beide soorten productie zijn onderworpen aan dezelfde kwaliteitscontrolenormen, maar de controle wordt geautomatiseerd in continue productiefaciliteiten en komt meestal vaker voor dan in batchproductie. Zoals alle technologie kunnen continue productieapparatuur slijtage ervaren, maar geautomatiseerde monitoring kan problemen detecteren lang voordat er een storing optreedt. Een dergelijke monitoring kan ook helpen om de levensverwachting van een apparaat te voorspellen, wat leidt tot beter proactief onderhoud.
ten slotte kan continue productie een flexibelere tracking en tracing mogelijk maken, wat een voordeel zou zijn in het geval van een productfout. Bijvoorbeeld, in batch productie, een specifieke hoeveelheid (of batch) van een geneesmiddel wordt gedefinieerd door de grootte van de apparatuur die het geproduceerd. In continue productie, kan een hoeveelheid (of partij) worden afgebakend door een tijdstempel, hoeveelheid geproduceerde drug, of de hoeveelheid ruw inputmateriaal. Deze tracking-methoden stellen de fabrikant in staat om een kleinere hoeveelheid defecte materiaal te isoleren in het geval van een processtoring, wat leidt tot minder afval en minder kans op een tekort.
een uitdagende maar waardevolle overgang
verschillende industrieën—zoals de chemische en petrochemische industrie—hebben reeds een productie-evolutie ondergaan en gebruiken efficiënte continue technologieën om veilig producten te vervaardigen. Maar voor de farmaceutische industrie staat de overgang naar continue productie om verschillende redenen nog in de kinderschoenen. Ten eerste kunnen de opstartkosten voor een dergelijke transitie hoog zijn. Met pensioen gaan oude batch apparatuur, de aankoop van nieuwe technologie en het opleiden van personeel over hoe het te gebruiken, en het vernieuwen van de industrie infrastructuur is duur, waarvoor een serieuze inzet van een drug maker. Uit economische analyses is echter gebleken dat er op lange termijn aanzienlijke besparingen kunnen worden gerealiseerd. Bovendien moeten sommige technologieën nog rijpen voordat ze commercieel levensvatbaar zijn. Voor bepaalde soorten geneesmiddelen, zoals biologische producten, bestaat de technologie voor de productie ervan door continue productie mogelijk nog niet. Er wordt onderzoek gedaan om deze en andere uitdagingen aan te pakken. Bovendien, drug makers nog steeds waarnemen van regelgevende onzekerheid die de goedkeuring van het product kan vertragen wanneer een nieuwe productietechnologie wordt gebruikt.
terwijl de industrie nagaat hoe de overstap kan worden gemaakt, verschaft de FDA middelen en informatie om de overstap te vergemakkelijken. Het agentschap werkt bijvoorbeeld samen met de Biomedical Advanced Research and Development Authority, een programma binnen het Amerikaanse Ministerie van gezondheid en Menselijke Diensten, om onderzoek op dit gebied te financieren en te ondersteunen. We trainen ook onze beoordelingspersoneel en doen intern onderzoek naar risicogebieden die samenhangen met continue productie, zodat we gerelateerde technologieën beter kunnen beoordelen.
Ik leid een multidisciplinair team in het kader van het Emerging Technology Program in Cder ‘ s Office of Pharmaceutical Quality. Het programma werd opgezet om de industrie te helpen innovatieve technologieën te implementeren om de productkwaliteit te verbeteren en de industrie te moderniseren, in een poging om de onderliggende oorzaken van drugstekorten of terugroepacties aan te pakken. Het opkomende technologieprogramma richt zich niet alleen op continue productietechnologieën, maar ook op andere ontwikkelingen zoals 3D-printen, nieuwe doseringsvormen en nieuwe containersystemen. In het kader van dit programma gaan we al vroeg in het proces van het ontwikkelen van nieuwe technologie in contact met de industrie en bespreken we eventuele verwachte regelgevende of wetenschappelijke kwesties die deel kunnen uitmaken van een toekomstige toepassing.
veel bedrijven hebben zich aangemeld voor het Emerging Technology Program met betrekking tot hun interesse in continue productie. Het document van de FDA getiteld, Advancement of Emerging Technology Applications to Modernize the Pharmaceutical Manufacturing base Guidance for Industry biedt informatie en advies over hoe te werken met het agentschap vroeg in het ontwikkelingsproces.
Lees meer over de inspanningen van de FDA om de productie van geneesmiddelen te moderniseren in de Voice Blog van de FDA.