oleje biologiczne różnią się od olejów naftowych („zwykłego” oleju napędowego) w strukturze molekularnej i właściwościach.

wspólny olej napędowy z ropy naftowej jest mieszanką prostych węglowodorów o średnim wzorze chemicznym C12H23 (pokazanym poniżej), ale składniki mogą wahać się w przybliżeniu od C10H20 (Dodekan) do c15h28(pentadekan). Natomiast oleje biologiczne są „trójglicerydami” (klasyfikowanymi jako „estry”), takimi jak trylinoleinian glicerylu pokazany poniżej:
| C12H23, Dodekan | trójgliceryd: trilinoleinian glicerylu |
ze względu na ich duże rozmiary i wynikające z tego Duże atrakcje międzymolekularne, lepkość olejów biologicznych jest na ogół zbyt wysoka, aby można było je stosować w konwencjonalnych silnikach Diesla. Oleje biologiczne również spalają się nieco mniej łatwo i z bardziej soczystym płomieniem niż olej napędowy z ropy naftowej. Oleje biologiczne mogą być stosowane w konwencjonalnych silnikach wysokoprężnych, jeśli są wstępnie podgrzewane w celu zmniejszenia ich lepkości, ale wymaga to dodatkowego ogrzewania elektrycznego, dopóki silnik się nie nagrzeje. W przypadku tych resonów oleje bilogiczne wymagają przetwarzania w celu wykorzystania jako biodiesel.
olej biologiczny jest estrem, który jest rodzajem związku organicznego o wiązaniu atomowym pokazanym poniżej.
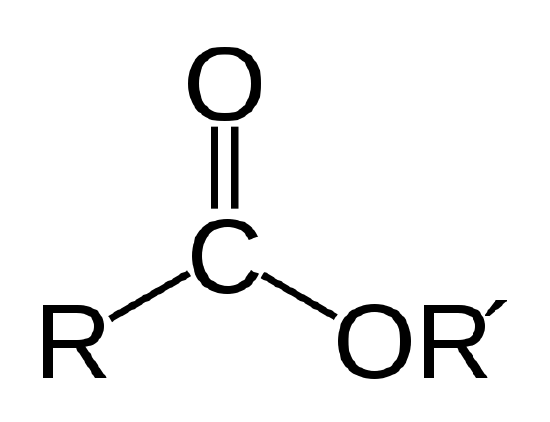 połączenie estrowe. R i R’ reprezentują łańcuchy atomów węgla i wodoru. R = -CH3 i R’ = -c18h35o2 dla stearynianu metylu w przykładzie 1 |
glicerolu |
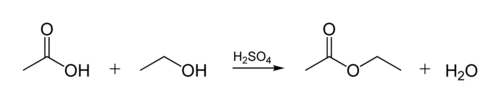
połączenie estrowe w olejach biologicznych powstaje, gdy cząsteczka glicerolu reaguje z kwasami organicznymi. Cząsteczka glicerolu ma łańcuch 3 atomów węgla, z których każdy zawiera grupę-OH (alkohol). Poniższy rysunek pokazuje, jak alkohol organiczny reaguje z kwasem organicznym. Chemicy organiczni skracają struktury molekularne-linie ” zig-zag „na rysunku przedstawiają łańcuchy węgla z atomem C przy każdym” zig „lub”zag”. Każdy węgiel ma 4 wiązania, a jeśli jest ich mniej niż 4, zakłada się, że przechodzą one do atomów H. Tak więc alkohol to C2H5OH (Etanol), a kwas to kwas octowy (lub kwas etanowy, CH3COOH) na rysunku:
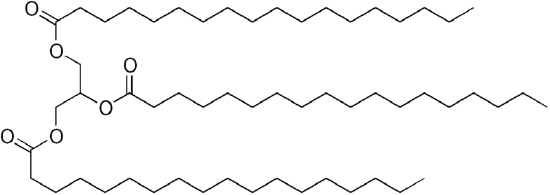
ponieważ glicerol ma grupy 3-OH, 3 długołańcuchowe organiczne „kwasy tłuszczowe” przyłączają się, aby uzyskać nieporęczny „trójgliceryd”.
ale tak łatwo, jak estry mogą być wytwarzane z alkoholi i kwasów, mogą zmieniać alkohole lub kwasy. W obecności silnego katalizatora zasadowego, takiego jak NaOH, trójgliceryd może reagować z 3 małymi cząsteczkami alkoholu, takimi jak metanol (CH3OH), które zastępują „szkielet” glicerolu, tworząc 3 oddzielne estry o niższej masie cząsteczkowej
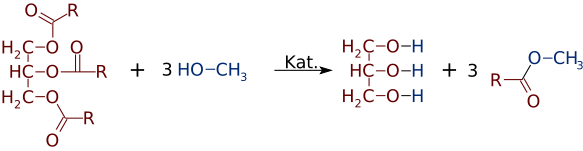
dość często powstaje mieszanina dwóch lub więcej produktów. Na przykład, gdy olej roślinny reaguje z metanolem, tylko jeden lub dwa kwasy mogą zostać wyparte z gliceryny, produkując tylko 1 lub 2 FAMEs.
C3H5(C18H35O2)3 + NaOH + 2 CH3OH → C3H5(C18H35O2)2(OH) + 2 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 1 CH3OH → C3H5(C18H35O2)(OH)2 + 1 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 3 CH3OH → C3H5(OH)3 + 3 C17h35cooch3
zwykle dodaje się duży nadmiar metanolu i wodorotlenku sodu, tak że reakcja wytwarza maksymalną ilość Fame.
ale w przypadku transestryfikacji, mimo że żaden z reagentów nie jest całkowicie zużyty, nie następuje dalszy wzrost ilości produktów. Mówimy, że taka reakcja nie dochodzi do końca. Gdy powstaje mieszanina produktów lub reakcja nie dochodzi do zakończenia, skuteczność reakcji jest zwykle oceniana pod względem procentowej wydajności pożądanego produktu. Teoretyczna wydajność jest obliczana przy założeniu, że cały odczynnik ograniczający jest przekształcany w produkt. Oznaczoną doświadczalnie masę produktu porównuje się następnie z wydajnością teoretyczną i wyraża w procentach:

przykład 1 gdy 100,0 g gazu C3H5(C18H35O2)3 i 15,0 G CH3OH miesza się w temperaturze 55°C z katalizatorem NaOH, reagują z wytworzeniem stearynianu metylu 90,96 g c17h35cooch3. Oblicz procent wydajności.
rozwiązanie musimy obliczyć teoretyczną wydajność NH3, a aby to zrobić, musimy najpierw odkryć, czy N2 lub H2 jest odczynnikiem ograniczającym. Dla równania zrównoważonego
C3H5(C18H35O2)3 + NaOH + 3 CH3OH → C3H5(OH)3 + 3 c17h35cooch3 stearyna + wodorotlenek sodu + 3 CH3OH → glicerol + 3 stearynian metylu
stosunek stechiometryczny reagentów wynosi
 obecnie początkowe ilości obu reagentów wynoszą
obecnie początkowe ilości obu reagentów wynoszą 

stosunek kwot początkowych wynosi zatem ponieważ stosunek ten jest mniejszy niż
ponieważ stosunek ten jest mniejszy niż , występuje nadmiar CH3OH. Stearyna jest odczynnikiem ograniczającym. W związku z tym musimy użyć 0,1122 mol stearyny i 0,3366 mol CH3OH (zamiast 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have
, występuje nadmiar CH3OH. Stearyna jest odczynnikiem ograniczającym. W związku z tym musimy użyć 0,1122 mol stearyny i 0,3366 mol CH3OH (zamiast 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have so that
so that We can organize these calculations in a table:
We can organize these calculations in a table:
| C3H5(C18H35O2)3(s) | + 3 CH3OH (l) | → 1 C3H5(OH)3 (l) | + 3 C18H35O2)3CH3(s) | ||
|---|---|---|---|---|---|
| m, g | 100.0 g | 15.00 g | 90.96 g | ||
| M, g/mol | 891.5 | 32.04 | 298.5 | 92.1 | |
| n present, mol | 0.1122 mol | 0.4682 mol | |||
| n actual, mol | 0.1122 | 0.3366 | 0.1122 | 0.3366 | |
| m actual, mass | 100.0 | 10.78 | 10.33 | 100.47 |
The percent yield is then
Transesterification is a classic example of a reaction which does not go to completion.