pierwszy lek biologiczny, insulina humanizowana (5,8 kDa), stał się dostępny w 1982 roku po pojawieniu się biotechnologii i zapoczątkował nową erę w przemyśle farmaceutycznym. Nowoczesne postępy w biotechnologii pozwalają na wielkoskalowe syntezy biologiczne w mniej lub bardziej opłacalny sposób. Po rozpoczęciu z dużymi peptydami i rekombinowanymi białkami, obecnie leki biologiczne obejmują szeroki zakres innych jednostek, takich jak przeciwciała, przeciwciała monoklonalne, a ostatnio nanobody i pokrewne obiekty, rozpuszczalne receptory, rekombinowane DNA, koniugaty przeciwciało-lek (ADC), białka fuzyjne, immunoterapeutyki i szczepionki syntetyczne.
„wschodząca gwiazda” leków biologicznych przyciąga coraz większą uwagę specjalistów farmaceutycznych i analityków branżowych, ponieważ ten alternatywny paradygmat odkrywania leków stanowi poważne wyzwanie biznesowe dla bardziej tradycyjnego paradygmatu odkrywania leków o małych cząsteczkach, definiującego przemysł farmaceutyczny od ponad wieku.
powstaje więc pytanie: czy małe cząsteczki tracą „atrakcyjność” jako obiekty badawcze do odkrywania leków we współczesnym świecie postępu biologicznego? Niektórzy eksperci są optymistami co do potencjału małych cząsteczek do przewodzenia wyścigowi w przyszłych rurociągach farmaceutycznych, inni dostrzegają, że „pieniądze zmieniają kieszenie”, a badania małych cząsteczek będą coraz bardziej zaniedbywane przez akcjonariuszy i inwestorów na rzecz biologów.
aby dowiedzieć się, gdzie zmierza branża, zacznijmy od kilku statystyk. W okresie 7 lat (2010-2017) USA Food and Drug Administration (FDA) zatwierdziła łącznie 262 nowe jednostki molekularne (Nme), z wyłączeniem kilku środków diagnostycznych i 1 analogu insuliny (ref). Wydaje się, że 76% z nich to małe cząsteczki (199), a tylko jedna czwarta to substancje biologiczne. Co ciekawe, nie ma widocznego wzrostu aprobat biologicznych NMEs w stosunku do małych cząsteczek, ponieważ obie kategorie terapeutyczne są trendy w dość podobny sposób, jak pokazano na poniższym diagramie. Jednak ponieważ biologiczne ceny są bardzo różne od małych cząsteczek (są one znacznie droższe), obraz jest inny, gdy patrzymy na całkowity wzrost sprzedaży i przychodów: w okresie od 2011 do 2017 przychody ze sprzedaży biologicznych wzrosły o 70%, osiągając 232 miliardy dolarów. Udział całego rynku farmaceutycznego, który posiada firma biologics, wzrósł z 16% w 2006 r.do 25% w 2016 r., bez wyraźnych oznak spowolnienia (ref).
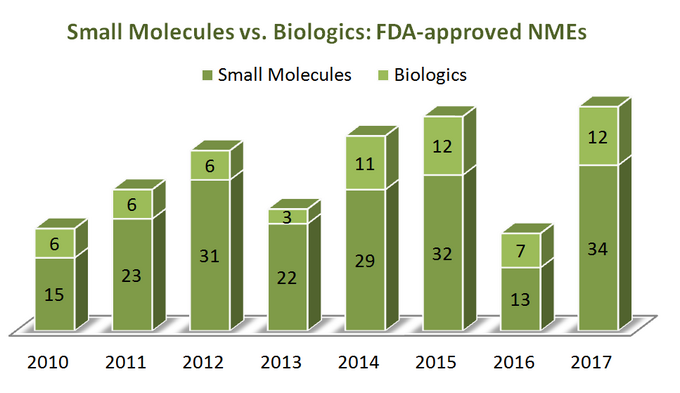
chociaż istnieją wyraźne zalety leków biologicznych nad małymi cząsteczkami na kilka sposobów (na przykład ich głęboka selektywność), rzeczy nie są „czarno-białe” przy porównywaniu tych dwóch kategorii terapeutycznych według ich atrybutów, ponieważ obie z nich mają istotne plusy i minusy do rozważenia podczas podejmowania decyzji strategicznych. Więc wydaje się trochę żałować, aby zobaczyć, jak wiele raportów z boku SMs w porównaniu do biologicznych w pogoni za „świeżością” swoich punktów widzenia.
poniższa tabela podsumowuje kilka mocnych i słabych aspektów obu kategorii (ref, ref) ilustrujących wyzwania i możliwości dostępne w obu „obozach” (uwaga kolory: szary – brak widocznej przewagi w żadnym obozie; zielony – korzystna sytuacja; żółty – niekorzystna sytuacja):
małe cząsteczki |
biologiczne |
|---|---|
|
Właściwości ogólne |
|
|
niskie masy cząsteczkowe (0,1 – 1 kDa); zwykle stabilne chemicznie i termicznie, szeroki zakres polaryzacji. |
bardzo duże masy cząsteczkowe >1 kDa; zazwyczaj polarne, wrażliwe na ciepło, łatwo ulegające degradacji (z wyjątkiem niektórych długowiecznych typów, takich jak przeciwciała monoklonalne) |
|
selektywność, bezpieczeństwo |
|
|
raczej rozwiązłe, Zwykle Wiązanie do różnych miejsc poza celem, renderowanie skutków ubocznych lub toksyczności. wreszcie, deweloperzy biologiczni mieli łatwiejszy czas uzyskania patentów, ponieważ nie było niewiele lub nie było najnowocześniejszych w tej dziedzinie, kiedy odkryto obecne blockbustery. |
wysoce specyficzne dla celów, na ogół o niższej toksyczności (z jednym poważnym wyjątkiem jest immunogenność, która może poważnie wpłynąć na skuteczność, bezpieczeństwo i dyspozycję leków biologicznych). |
|
przepuszczalność komórek |
|
|
SMs wiąże się z celami, takimi jak receptory sprzężone z białkiem G (GPCRs), kanały jonowe bramkowane ligandem i kinazy tyrozynowe receptorów na domeny pozakomórkowe lub wewnątrzkomórkowe. Mogą uzyskać dostęp do celów w regionach wewnątrzkomórkowych, cytozolach, jądrach, a nawet celach OUN, oddzielonych ciasną barierą krew-mózg (BBB). |
duża część celów farmakologicznych jest osadzona i dlatego niedostępna dla leków biologicznych. Zwłaszcza, jeśli chodzi o ośrodkowy układ nerwowy (OUN), obecność bariery krew-mózg jest główną przeszkodą na drodze jakichkolwiek cząsteczek większych niż 600 Da ograniczających do 98% SMs i praktycznie wszystkich leków biologicznych. |
|
poród |
|
|
Dalsza przepuszczalność przez nabłonek jelitowy jest głównie zależna od połączenia dyfuzji biernej i transportu parakomórkowego. |
wewnętrzna niestabilność i duże masy cząsteczkowe sprawiają, że prawie wszystkie leki biologiczne są doustnie nieaktywne. Głównie inwazyjne dostawy lub alternatywne nieinwazyjne technologie w toku. |
|
Dystrybucja |
|
|
SMs są rozprowadzane poprzez krążenie krwi, co pozwala na szybkie osiągnięcie stężenia pick. |
dla większych cząsteczek (np.>10 kDa) w procesie dystrybucji dominuje wolniejszy (o 100-500 razy) układ limfatyczny. Większe leki biologiczne rozprowadzają się zarówno przez krew, jak i układ limfatyczny, przemieszczając transport konwekcyjny, pośrednicząc w endocytozie, fagocytozie i pinocytozie. Wynikiem tej sytuacji jest to, że większe biologiczne mają dłuższy okres półtrwania, ograniczoną objętość dystrybucji i potrzebują więcej czasu, aby osiągnąć maksymalne stężenie, w porównaniu z SMs. |
|
dyspozycja (metabolizm) |
|
|
Większość SMs jest usuwana przez narządy niecelowane-poprzez metabolizm cytochromu lub nie-cytochromu, filtrację nerkową lub wydalanie z kałem. |
leki biologiczne mają ściślejsze interakcje z celami, więc ich dyspozycje są bezpośrednio zależne od ich wiązania (dyspozycja leku zależna od receptora), w tym klirens leków biologicznych przez proteazy i peptydazy. |
|
interakcje lek-lek |
|
|
SMS są podatne na interakcje lek–lek, które mogą wystąpić z powodu obecności jednocześnie stosowanych leków, które wpływają na ich transport, metabolizm, transport lub drogi eliminacji. |
leki biologiczne są mniej podatne na tradycyjne interakcje między lekami, ponieważ podlegają metabolizmowi i eliminacji jako substraty endogenne. Istnieją jednak udokumentowane zmiany za pośrednictwem cytokin w enzymach metabolizujących leki, dlatego interakcje lek-biologiczne muszą być oceniane W przypadku, gdy lek może wpływać na ekspresję enzymów metabolicznych. |
|
aspekty biznesowe |
|
|
niskie ceny leków SM. |
zazwyczaj bardzo wysokie ceny zabiegów biologicznych. Jest to uważane za jeden z powodów, dla których wydaje się, że produkty biologiczne zapewniają lepsze ogólne zyski ekonomiczne w porównaniu z produktami SMs. |
|
wysoki wskaźnik ścierania (badanie KMR Group z 2009 r.wykazało, że tylko 7,1% SMs wchodzących do badań przedklinicznych ostatecznie trafiło na rynek). |
stosunkowo niski wskaźnik ścierania (to samo badanie grupy KMR wykazało, że 24,4% przedklinicznych leków biologicznych przetrwało do etapu rynkowego). |
|
Severe competition from chemical generics after patents expiration. |
Biologics developers face less severe competition from biosimilars, after patents expiration. |
|
Simpler drug discovery/development process. |
More expensive and complex drug discovery and development process, compared to biologics. |
biorąc pod uwagę powyższe porównanie, staje się oczywiste, że biologiczne nie są „magiczną kulą” i przemysł nie będzie zdominowany przez biologiczne w dającej się przewidzieć przyszłości, raczej zachowana zostanie konkurencyjna równowaga między małymi cząsteczkami, biologicznymi i hybrydowymi formami terapeutycznymi, takimi jak ADC-z lokalnymi dominacja każdej formy w bardziej odpowiednich obszarach terapeutycznych, przypadkach użycia itp.
ponadto poniżej znajduje się lista kilku czynników przemysłu, które grają po stronie małych cząsteczek i mogą wpływać na równowagę sił na całym rynku farmaceutycznym na rzecz chemicznych punktów wyjścia:
wzrost sztucznej inteligencji (AI) w odkrywaniu leków
Po przełomach w algorytmach uczenia głębokiego (2012), a ostatnio stworzenie generatywnych sieci kontradyktoryjnych (Gan), zdolnych do doskonalenia się w wielu zadaniach badawczych, zainteresowanie różnymi technologiami sztucznej inteligencji wzrosło w 2012 r.prawie każda branża. Wiele narzędzi opartych na sztucznej inteligencji szybko stało się głównym nurtem komercyjnym, takim jak chatboty, asystenci osobisti, autopiloty itp.–co jest prawdziwym dowodem na wykonalność sztucznej inteligencji.
odkrywanie leków nie jest wyjątkiem od tego „trendu opartego na sztucznej inteligencji”, a liczba startupów próbujących zastosować sztuczną inteligencję w celu zwiększenia odkrywania leków na różne sposoby znacznie wzrosła w ciągu zaledwie kilku lat, osiągając ponad sto aktywnych firm do tej pory (oto lista niektórych z nich).
Co ciekawe, większość startupów opartych na sztucznej inteligencji koncentruje się na odkrywaniu małych cząsteczek, a nie na biologiach, co prawdopodobnie nie jest zaskakujące. Historycznie, nawet nie-AI metody obliczeniowe (cheminformatyka) były używane głównie dla małych cząsteczek terapeutycznych ze względu na ich znacznie prostsze struktury molekularne i wzorce interakcji.
poniższy diagram pokazuje szacunkowe statystyki dla 61 aktywnie promowanych startupów odkrywających leki, które opracowują lub stosują specjalistyczne narzędzia sztucznej inteligencji w swoich badaniach. Jak widać, połowa wszystkich firm (51%, 31 startupów) koncentruje się na małych cząsteczkach, podczas gdy tylko 23% (14 startupów) jest zaangażowanych w odkrywanie/opracowywanie leków biologicznych (przeciwciała, szczepionki itp.). Dysproporcja w stosunku do małych cząsteczek jest również dobrze zilustrowana przez kwotę finansowania VC zebraną wspólnie przez 61 zrecenzowanych startupów opartych na sztucznej inteligencji ( tylko publicznie ujawnione rundy) – gdzie 770 milionów zainwestowano w firmy zaangażowane w małe cząsteczki, a tylko nieco ponad 200 milionów zostało przeznaczonych na startupy skoncentrowane na biologii-jak pokazano poniżej.
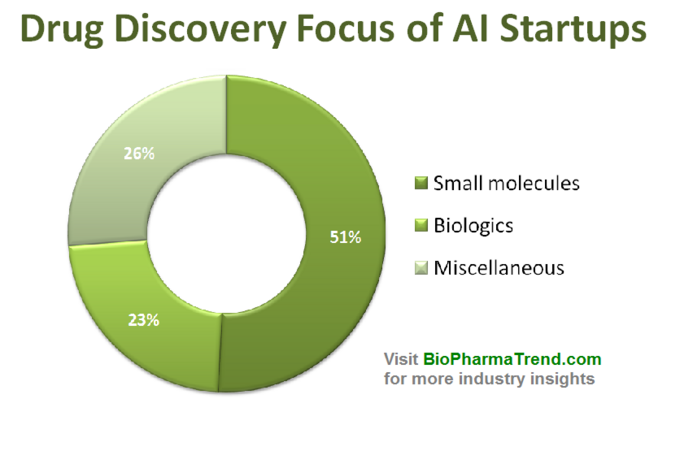
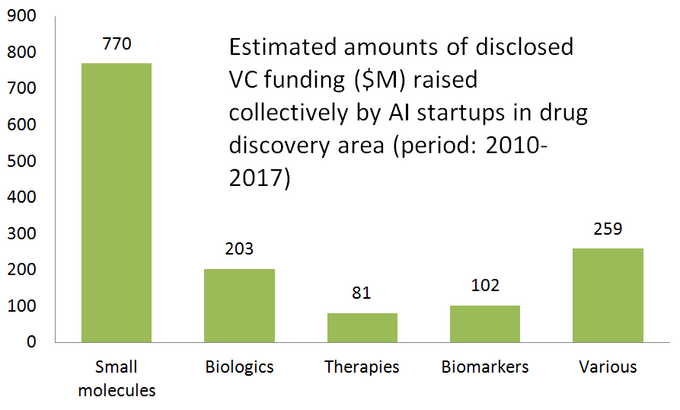
ta sytuacja sugeruje, że ostatnie postępy w algorytmach sztucznej inteligencji i tendencja do stosowania uczenia maszynowego na wczesnym etapie badań farmaceutycznych wydają się napędzać większy wzrost w odkrywaniu leków o małych cząsteczkach w porównaniu z odkryciem biologicznym-przynajmniej na razie. Może to prowadzić do większej liczby przyszłych inwestycji w projekty skupiające się na małych cząsteczkach wspierane przez technologie oparte na sztucznej inteligencji.
osiąganie celów „niezagrożalnych”
takie ważne cele, jak na przykład interakcje białko-białko (PPIS), są tradycyjnie zdominowane przez biologiczne (MAB) jako potencjalne podmioty, podczas gdy małe cząsteczki były długo uważane za nieodpowiednie w tym przypadku ze względu na ich małe rozmiary.
wraz z postępem w farmakogenomice sytuacja ta może się dość szybko zmienić po zatwierdzeniu marawiroku (514 Da) i tyrofibanu (441 Da). Okazało się obliczeniowo, że SMs mogą rzeczywiście mieć stosunkowo wysokie powinowactwo do specyficznych interfejsów białek i, co ważne, mogą modulować „wewnętrznie nieuporządkowane regiony białkowe” związane z zestawem chorób złożonych systemów. Oto jedna z ciekawych okładek tego tematu podsumowująca niektóre z ważnych spostrzeżeń na temat maszyn PPI uzyskanych w ostatnich dziesięcioleciach.
innym szybko rozwijającym się obszarem odkrycia leków o małej cząsteczce jest celowanie w kwas rybonukleinowy (RNA). Ten temat został wymieniony w „Top 7 Trends In Pharmaceutical Research In 2018”, a także był szczegółowy przegląd tematu w biologii chemicznej komórki i ładne pokrycie przemysłu w C&EN.
kolejny świeży pomysł na uwolnienie mocy małych cząsteczek został omówiony w ostatnim artykule”Targeted protein degraders are redefining how small molecules look and act”opublikowanym w C&EN w 2018 roku. Strategia tutaj jest rozwijać bifunctional małe molekuły zdolni kierujący celujący proteina całkowicie proteasome, komórka maszyna usuwający śmieci, zamiast po prostu hamujący proteina akcja jak w 'tradycyjnym’ podejściu.
pokonywanie ograniczeń technologii przesiewowych
wiele możliwości badawczych małych cząsteczek nie zostało jeszcze zrealizowanych ze względu na różne ograniczenia technologiczne metod przesiewowych stosowanych do identyfikacji punktów wyjściowych w programach odkrywania leków.
jednym z takich przykładów jest fenotypowe podejście do badań przesiewowych, które przeżywa renesans w dzisiejszych czasach ze względu na kilka postępów technologicznych, w tym rosnącą zdolność do opracowywania fizjologicznie istotnych modeli komórek, odczytów i zaawansowanych technologii wykrywania, pomagających skuteczniej ujawniać mechanizmy działania (MoA), minimalizując niepewność. Z drugiej strony, wdrożenie wielkoskalowych technik profilowania i metod obliczeniowych oferuje nowy poziom analizy systemowej i zrozumienia fenotypów drobnocząsteczkowych.
kolejnym obiecującym paradygmatem badań przesiewowych jest wykorzystanie bibliotek kodowanych DNA (DELs). Ze względu na swój unikalny układ, technologia DEL zapewnia odpowiedni sposób testowania setek milionów, a nawet miliardów nowych cząsteczek w programach wykrywania leków opartych na celach. Podczas gdy technologia ta nie jest pozbawiona wyzwań (np. ograniczenia chemii kompatybilnej z DNA, niepewność z trafieniami przesiewowymi itp.), obszar ten szybko się rozwija i jest nawet uważany za „rewolucyjny” dla odkrywania małych cząsteczek leku.
pokonanie bariery syntetyzowalności
jednym z kamieni węgielnych wczesnego etapu odkrycia leku o małych cząsteczkach jest ograniczenie syntetycznie dostępnej przestrzeni chemicznej-podczas gdy wiele obiecujących pomysłów chemicznych może być generowanych obliczeniowo lub w inny sposób, zawsze istnieje ryzyko, że synteza całego zestawu związków w celu potwierdzenia takich pomysłów byłaby kosztowna, a nawet niewykonalna.
ostatnie postępy w tej dziedzinie zostały ponownie dokonane przy użyciu oprogramowania opartego na sztucznej inteligencji oferującego wydajność planowania syntezy na poziomie człowieka. Na przykład, BenevolentAI opublikował niedawno artykuł w Nature, opisując, w jaki sposób wykorzystali Głębokie sieci neuronowe w połączeniu z nowoczesnymi algorytmami wyszukiwania drzew do planowania syntezy nowych cząsteczek z niezwykłym wskaźnikiem sukcesu i szybkością.
kilka ciekawych okładek z bogatymi komentarzami zostało opublikowanych tutaj i tutaj przez Dereka Lowe, zapewniając nieco więcej wglądu w ten fascynujący obszar chemii organicznej i medycznej.
bardziej empiryczna strategia została opracowana przez producenta chemicznego Enamine, który jest znany jako prawdziwa przestrzeń chemiczna i obecnie obejmuje ponad 3.8 miliardów syntetycznie dostępnych i możliwych do przeszukiwania cząsteczek do eksploracji uderzeń i innych zadań Chemii Medycznej. Koncepcja sprowadza się do zastosowania zestawu zwalidowanych szlaków chemicznych (ponad 100 reakcji) do dużej puli chemicznych bloków konstrukcyjnych dostępnych we własnym magazynie (ponad 100 tysięcy związków)-w celu połączenia ich w sposób kombinatoryczny w celu wytworzenia kaskady większych cząsteczek „podobnych do ołowiu” lub „podobnych do leków”. Gdy pewien stopień odtwarzalności i wydajności jest osiągnięty w wystarczająco dużym zestawie eksperymentów (co najmniej 80%), następuje dalsze wyliczenie obliczeniowe w celu zbudowania szerszej przestrzeni chemicznej w oparciu o doświadczalnie zatwierdzone przypadki.
New R&d rynki i role małych cząsteczek
W sumie można przeoczyć lub źle zrozumieć wielkość i potencjał wzrostu rurociągów małych cząsteczek, o czym wspomniano podczas dyskusji panelowej w Interphex. Obecnie około 8000 małych cząsteczek jest aktywnych w R&D, co stanowi wzrost o 25% w ciągu ostatnich kilku lat. Wymienione powyżej czynniki napędzające wzrost mogą prowadzić do dalszego przyspieszonego wzrostu w tym sektorze.
należy również zauważyć, że leki małocząsteczkowe mogą odgrywać ważną rolę w niektórych lekach nowej generacji, dzięki czemu są zależne od rurociągów małocząsteczkowych. Na przykład, w przypadku terapii komórkami macierzystymi, małe cząsteczki mogą wywołać reakcje terapeutyczne.
jak podkreślono podczas CPHI North America przez Jeffreya Shumwaya z MilliporeSigma, produkty małocząsteczkowe stają się bardziej złożone, zmieniając ich rolę w (bio)przemyśle farmaceutycznym.
wreszcie, przyszłym obszarem dla małych cząsteczek są koniugaty przeciwciało-lek i powiązane obiekty, które pojawiły się jako obiecująca Klasa terapeutyczna ze względu na naturalną konwergencję dwóch paradygmatów odkrywania leków i wielu trendów technologicznych.
Zastrzeżenie: informacje są tylko dla ogólnej świadomości i nie są prawnym/finansowym/giełdowym/medycznym doradztwem jakiegokolwiek rodzaju. Użytkownik czyta je na własną wolę, a wszelkie korzystanie z tych informacji odbywa się na własne ryzyko. Twoim obowiązkiem jest ocena przydatności i bezpieczeństwa informacji zawartych w tym poście i ogólnie w Internecie oraz tego, w jaki sposób odnosi się to do twojej sytuacji, a następnie skonsultowanie się z odpowiednimi ekspertami w celu uzyskania profesjonalnej porady, jeśli jest to wymagane.
tematyka: trendy w branży