- specyficzne dla gospodarza interakcje między Rhizobium i partnerami roślin
- zdeterminowany i nieokreślony rozwój guzków
- wzrost komórek symbiotycznych wiąże się z amplifikacją genomu gospodarza przez Endoreduplikację cykli
- różne losy Bacteroidów wiążących azot
- peptydy gospodarza regulują różnicowanie bakterii
- NCR247: przykład dla multi-Target host Effector
- wniosek
- Oświadczenie o konflikcie interesów
- podziękowania
specyficzne dla gospodarza interakcje między Rhizobium i partnerami roślin
bakterie, które tworzą symbiozę wiążącą azot z roślinami strączkowymi należącymi do różnych grup α-i β-proteobakterii, są zbiorczo nazywane rhizobia (Chen et al., 2003; MacLean et al., 2007). Wiele α-proteobakterii bierze udział w długotrwałych interakcjach z wyższymi eukariotami. Interakcje te wahają się od kolonizacji powierzchniowej poprzez fakultatywne relacje symbiotyczne, aby zobowiązać wewnątrzkomórkowy patogen lub styl życia endosymbiontów. Symbiotyczne geny niezbędne do tworzenia guzków, infekcji komórek gospodarza i wiązania azotu zostały nabyte przez boczny transfer genów, który jest głównym źródłem genetycznej różnorodności kłącza. W związku z tym rhizobia może być bliżej spokrewniona z patogenami (takimi jak Agrobacterium lub Brucella) niż ze sobą nawzajem. Kłącza mają zwykle duże genomy (do 10.5 Mbp), które w szybko rosnących kłączach są rozproszone na wielu replikonach (MacLean et al., 2007). Na przykład, Sinorhizobium meliloti, endosymbiont z gatunku Medicago, ma trójdzielny Genom; chromosom 3,65 MBP i dwa megaplasmidy, pSymA i pSymB (1,35 i 1,68 MBP), z których oba są niezbędne i zawierają większość genów symbiotycznych. Jednak wiele szczepów S. meliloti zawiera dalsze pomocnicze plazmidy średniej wielkości, a zatem Genom S. meliloti może zawierać do 9000 genów (Barnett et al., 2001; Capela et al., 2001). W przeciwieństwie do kłączobii, endosymbionty obligatoryjne owadów posiadają zwykle silnie zredukowany (160-450 Kbp) Genom, który zapewnia ich namnażanie i kodowanie dla kilku specyficznych szlaków biosyntetycznych, w tym tych zaspokajających potrzeby gospodarza (Moran et al., 2008; Price et al., 2011). Te niesamowicie zredukowane genomy są jednak wzmacniane kompensując zmniejszony Genom zawartością POLIPLOIDU DNA.
partnerzy roślin rhizobia należą do rodziny Leguminosae/Fabaceae. Symbioza wiązania azotu rozwinęła się w kilku liniach, ale nie wszystkie rośliny strączkowe tworzą symbiozę. Do tej pory znanych jest 12 000 nodowanych gatunków roślin strączkowych, a każdy z nich ma własnego partnera (- ów) Rhizobium. Symbioza jest wywoływana przez głód azotu rośliny żywicielskiej, która musi wybrać swojego partnera Rhizobium z miliardów bakterii w rhizosferze. Osiąga się to poprzez wydzielanie z korzenia flawonoidowych cząsteczek sygnałowych, które działają jako chemioatraktanty, ale przede wszystkim jako induktory genów nodulacyjnych Rhizobium (Oldroyd, 2013). Geny te są niezbędne do produkcji cząsteczek sygnałowych bakterii; czynniki Nod (NFS), które wyzwalają program rozwoju guzków w roślinie żywicielskiej (Walker and Downie, 2000). NFs są cząsteczkami lipochitooligosacharydów, które przenoszą specyficzne substytucje gospodarza na końcowych resztach cukrowych i charakterystycznych łańcuchach lipidowych, które są rozpoznawane przez receptory gospodarza typu LysM i są wymagane zarówno do rozwoju guzków, jak i infekcji bakteryjnej. Co ciekawe, starożytna symbioza roślin lądowych z grzybami arbuskular mycorrhizal (AM) działa z podobnymi cząsteczkami sygnałowymi lipochitooligosacharydów, czynnikami Myc, które są postrzegane przez podobne, ale różne receptory typu LysM, jak NFS (Abdel-Lateif et al., 2012; Oldroyd, 2013). Czynniki Myc i NFs aktywują wspólny szlak sygnałowy, ale po zaangażowaniu wspólnych genów symbiotycznych zachowanych w roślinach szlaki te odbiegają; jeden prowadzi do nodulacji, drugi do symbiozy AM.
infekcja roślin i powstawanie guzków to skomplikowane procesy; Czynniki Nod odgrywają odrębną rolę w organogenezie guzków i infekcji włosów korzeniowych. Ponadto, oprócz czynników Nod, różne polisacharydy powierzchniowe bakterii są kluczowe dla skutecznej infekcji (Fraysse et al., 2003). U większości roślin strączkowych kłącze przedostaje się do gospodarza przez włos korzeniowy, gdzie w wyniku inwaginacji błony plazmatycznej powstaje nić infekcyjna (IT), która zawiera rozmnażające się bakterie i rośnie w kierunku kory korzeniowej. Rzadszy i Starożytny tryb infekcji występuje poprzez pęknięcia na powierzchni korzenia niektórych roślin strączkowych.
zdeterminowany i nieokreślony rozwój guzków
rozwój guzków wymaga mitotycznej reaktywacji komórek korowych, co prowadzi do powstania guzka zawiązka, który następnie różnicuje się w guzki korzeniowe ustalające azot, zapewniając stan mikroaerobowy w strefie centralnej dla funkcjonowania wrażliwego na tlen enzymu nitrogenazy w bakterioidach. W zależności od przejściowego i trwałego charakteru proliferacji komórek gospodarza, guzki mogą być typu determinującego lub nieokreślonego (Terpolilli et al., 2012; Kondorosi et al., 2013). Guzki determinowane nie mają merystemu i zawierają jednorodną populację komórek symbiotycznych. Guzki determinujące rozwijają się np. na korzeniach Phaseolus vulgaris i Lotus japonicus.
przeciwnie, aktywny podział komórek utrzymuje się w nieokreślonych guzkach. Merystem guzkowy występuje w okolicy wierzchołkowej (strefa I), która poprzez ciągłe wytwarzanie nowych komórek wywołuje ciągły wzrost i wydłużony kształt guzka. Komórki wychodzące z merystemu nie dzielą się już i wchodzą w fazę różnicowania. Nić infekcyjna uwalnia bakterie do komórek submeristematycznych, które różnicują się stopniowo wzdłuż 12-15 warstw komórkowych strefy infekcji (strefa II), prowadząc do rozwoju symbiotycznych komórek wiążących azot w strefie guzkowej III (Fig., 1992). Medicago sativa, M. truncatula, Vicia sativa i Pisum sativum są przykładami roślin tworzących nieokreślone guzki.
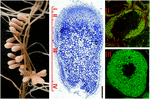
rysunek 1. Struktura guzków korzeniowych wiążących azot uformowana w symbiozie S. meliloti – M. truncatula. Różne strefy guzków są wskazane na podłużnym odcinku guzka: (i) meristem, (II) Strefa infekcji, (III) strefa wiązania azotu, (IV) Strefa starzenia. Komórki symbiotyczne w strefie II zawierają endosymbionty różnicujące, podczas gdy w strefie III cytoplazma gospodarza jest w pełni wypełniona długimi bakteriami wiążącymi azot. Endosymbionty barwione Syto9 mają zieloną fluorescencję.
wzrost komórek symbiotycznych wiąże się z amplifikacją genomu gospodarza przez Endoreduplikację cykli
Ekstremalne powiększenie komórek roślinnych można zaobserwować zarówno w guzkach determinowanych, jak i nieokreślonych. W cytoplazmie symbiotycznej komórki wiążącej azot znajduje się około 50 000 bacteroidów. Aby pomieścić tak dużą liczbę endosymbiontów, rosną komórki gospodarza. U guzków M. truncatula objętość komórek wiążących azot jest 80-krotnie większa niż u diploidalnych komórek merystematycznych. Wzrost zakażonych komórek następuje stopniowo w strefie II i jest konsekwencją powtarzającej się endoreduplikacji (ER) genomu bez mitozy. W strefie II mechanizm cyklu komórkowego jest nadal aktywny, ale brak cyklin mitotycznych hamuje mitozę i przekształca cykle mitotyczne w cykle endoreduplikacji (Cebolla et al., 1999). Osiąga się to przez przełącznik cyklu komórkowego białka CCS52A, które poprzez zniszczenie mitotycznych cyklin indukuje powtarzające się rundy duplikacji genomu, prowadząc do tworzenia stopniowo rosnących komórek poliploidowych (Roudier et al., 2003; Kondorosi i Kondorosi, 2004). U gatunków Medicago poziomy ploidy mogą osiągnąć 64C, co oznacza 64-krotnie wyższą zawartość DNA w porównaniu z komórkami haploidalnymi (C odpowiada zawartości haploidalnego DNA; Vinardell et al., 2003). Obniżenie CCS52A u M. truncatula nie miało wpływu na tworzenie zawiązku, ale było szkodliwe dla różnicowania guzków, co wskazuje, że cykle ER i tworzenie dużych, silnie poliploidalnych komórek są niezbędne do funkcjonowania guzka(Vinardell et al., 2003). Co ciekawe, komórki korowe zawierające grzyby AM są również poliploidami, a także gigantycznymi komórkami korzeniowymi karmiącymi nicienie(Favery et al., 2002; Gatunek i in., 2008). Podobnie, komórki symbiotyczne owadów, bakteriocyty zawierające wewnątrzkomórkowe endosymbionty są również duże i poliploidalne (Nakabachi et al., 2010). U roślin okrytonasiennych poliploidalność jest częsta, a specyficzny dziedziczny wzór poliploidalności w różnych narządach, tkankach i typach komórek sugeruje, że może być głównym źródłem wyspecjalizowanej fizjologii komórek gospodarza (Nagl, 1976; Edgar et al., 2014). Oprócz wzrostu komórek, wielokrotne kopie genów, brak kondensacji chromosomów może przyczynić się do wyższej aktywności transkrypcyjnej i metabolicznej. Jednak związek poliploidii z różnymi funkcjami komórek sugeruje wpływ poliploidii również na architekturę nukleosomów i na epigenom kontrolujący aktywację lub represji określonych regionów genomowych. W związku z tym zawartość genomu poliploidu w komórkach symbiotycznych wydaje się być warunkiem koniecznym do różnicowania guzków i ekspresji większości symbiotycznych genów gospodarza (Maunoury et al., 2010).
różne losy Bacteroidów wiążących azot
bakterie uwolnione z IT są obecne w cytoplazmie gospodarza jako struktury organelle, zwane symbiosomami. Bakterie nie mają bezpośredniego kontaktu z cytoplazmą, ponieważ są otoczone błoną peribakteroidalną, znaną również jako błona symbiosomowa (SM). Bacteroid, SM i przestrzeń między nimi tworzą symbiosom (Catalano et al., 2004). SM podczas jego powstawania odzwierciedla pochodzenie błony plazmatycznej, późniejsze modyfikacje jego składu otwierają nowe, wyspecjalizowane role w interfejsie gospodarz-endosymbiont (Limpens et al., 2009; Ivanov et al., 2012; Brear et al., 2013; Sinharoy et al., 2013). Bacteroidy namnażają się w rosnących komórkach guzkowych gospodarza do określonej gęstości komórek, dostosowują się do endosymbiotycznego stylu życia i warunków mikroaerobowych oraz dojrzewają do bacteroidów wiążących azot. Forma i fizjologia bacteroidów mogą być jednak uderzająco różne w różnych roślinach strączkowych. U niektórych gospodarzy roślin strączkowych, bacteroidy zawierające azot mają taką samą morfologię jak hodowane komórki; ten typ bacteroidów może powrócić do postaci wolnożyjącej. W innych związkach bacteroidy są nieodwracalnie przekształcane w poliploidy, powiększone, nieuleczalne endosymbionty. Te terminalnie zróżnicowane bacteroidy mogą być wydłużone, a nawet rozgałęzione i 5-do 10-krotnie dłuższe niż wolne żywe komórki lub mogą być kuliste od 8 do co najmniej 20-krotnie amplifikowany Genom w zależności od gospodarza(Mergaert et al., 2006; Nakabachi et al., 2010). Końcowe różnicowanie bacteroidów jest kontrolowane przez gospodarza, wyewoluowało w wielu gałęziach rodziny Leguminosae, wskazując na przewagę gospodarza i prawdopodobnie wyższą wydajność symbiotyczną (Oono et al., 2010). Końcowe różnicowanie bakterii jest najlepiej wyjaśnione w symbiozie S. meliloti – M. truncatula. W M. guzki truncatula, najbardziej widoczne zdarzenia końcowego różnicowania bakterioidów występują w strefie II. namnażanie bacteroidów zatrzymuje się w środku strefy II, gdzie rozpoczyna się wydłużanie komórek i równomierne amplifikowanie wielu replikonów przez cykle endoreduplikacji. Wzdłuż 2-3 warstw komórkowych na granicy strefy II i III (tzw. międzyzwrotnikowej) widoczny jest gwałtowny wzrost bakterii osiągający praktycznie ich ostateczny rozmiar, jednak wiązanie azotu zachodzi tylko w strefie III.
peptydy gospodarza regulują różnicowanie bakterii
porównanie transkryptomów guzkowych roślin strączkowych z odwracalnym i nieodwracalnym różnicowaniem bakterii bakteryjnych wykazało istnienie kilkuset małych genów, które były obecne tylko w genomie tych roślin żywicielskich, w których różnicowanie bakterii było terminalne. W M. truncatula komórki guzkowe wytwarzają co najmniej 600 swoistych peptydów symbiotycznych (symPEPs). Geny Symp są aktywowane tylko w komórkach symbiotycznych zakażonych poliploidami S. meliloti (Kevei et al., 2002; Mergaert et al., 2003), jednak niektóre zestawy na wcześniejszych, inne na późniejszych etapach rozwoju guzków. Duża część, ponad 500 genów koduje specyficzne dla guzków peptydy bogate w cysteinę (NCR) (Mergaert et al., 2003; Alunni et al., 2007; Nallu et al., 2014). Peptydy NCR są ukierunkowane na bacteroidy ,a gdy ich dostarczanie do endosymbiontów zostało zablokowane, różnicowanie bacteroidów zostało zniesione, wykazując, że peptydy są odpowiedzialne za końcowe różnicowanie bacteroidów S. meliloti(Van De Velde et al., 2010). Różnorodność wysokiej sekwencji i charakterystyczne wzorce ekspresji genów NCR sugerują różnorodność w ich funkcjach, sposobach działania i celach bakteryjnych na różnych etapach dojrzewania bakterii (ryc. 2). Dlaczego jednak komórka gospodarza wytwarza arsenał NCRs? Jaka może być zaleta tak zróżnicowanego repertuaru peptydowego? Czy jest to konieczne do interakcji gospodarza z różnymi bakteriami? Symbiotycznymi partnerami M. truncatula są S. meliloti i S. medicae, jednak w glebie występują niezliczone warianty szczepów obu gatunków. M. truncatula jest również reprezentowana przez wiele różnych ekotypów i akcesji różniących się liczbą, sekwencjami i profilem ekspresji genów NCR oraz ich symbiotycznymi interakcjami z różnymi szczepami S. meliloti i S. medicae(Nallu et al., 2014; Roux et al., 2014). Podczas gdy guzek zawiera jeden typ bakterii, różne guzki na tym samym systemie korzeniowym mogą posiadać różne populacje bakterii. Możliwe, że roślina rozpoznająca różne endosymbionty manipuluje nimi za pomocą specyficznego dla szczepu repertuaru peptydów. Różnice te mogą dodać dodatkowy poziom kontroli swoistości gospodarza-symbionta, a tym samym wydajności nodulacji.

rysunek 2. Ekspresja różnicowa genów symPEP w guzkach M. truncatula. Sygnał czarny: hybrydyzacja in situ, sygnał niebieski: aktywność GUS fuzji promotor-GUS w guzkach transgenicznych.
chociaż symPEPs reprezentują unikalne klasy peptydów, ich struktury przypominają peptydy przeciwbakteryjne (AMPs). Ampy o szerokim spektrum aktywności zabijania komórek drobnoustrojów są najczęściej kationowymi prowokującymi śmierć komórek przez tworzenie porów, zakłócenie błony i w konsekwencji lizę komórek drobnoustrojów. Fakt, że zdolność podziału komórek zostaje ostatecznie utracona podczas różnicowania endosymbiontów, wskazuje na to, że przynajmniej niektóre Symp-y wykazują aktywność przeciwdrobnoustrojową. Leczenie bakterii za pomocą syntetycznych kationowych NCRs rzeczywiście wywołało szybką i skuteczną zależną od dawki eliminację różnych bakterii Gram-ujemnych i Gram-dodatnich, w tym ważnych patogenów ludzkich i roślinnych (Van De Velde et al., 2010; Tiricz i in., 2013). Ten efekt zabijania ex-planta koreluje z przenikaniem błon drobnoustrojów, jednak symppy w ich naturalnym środowisku – w komórkach guzkowych-nie przenikają do błon bakteryjnych i nie zabijają endosymbiontów. Najprawdopodobniej stężenia peptydów w guzkach są znacznie niższe niż te stosowane w testach in vitro. Ponadto peptydy kationowe są wytwarzane razem z anionowymi i neutralnymi peptydami w tej samej komórce, a możliwe połączenie kilkudziesięciu lub setek peptydów o różnym ładunku i hydrofobowości może neutralizować bezpośrednie działanie bakteriobójcze peptydów kationowych.
udział AMPs lub peptydów podobnych do AMP nie jest wyjątkowy w symbiozie Rhizobium-legume. W sitofilu Wołka komórki symbiotyczne wytwarzają przeciwdrobnoustrojowy peptyd coleopterycyna-a (ColA), który prowokuje rozwój gigantycznych endosymbiontów nitkowatych poprzez hamowanie podziału komórek i chroni sąsiednie tkanki owadów przed inwazją bakterii (Login et al., 2011). W systemie tym pojedynczy peptyd jest wystarczający do różnicowania endosymbiontów przenoszonych pionowo, w przeciwieństwie do guzków, które działają z setkami Symp i mogą przyjmować niezliczone warianty szczepów jako ich endosymbionty. W symbiozie mszyca-Buchnera komórki gospodarza wytwarzają również peptydy specyficzne dla bakterii, w tym peptydy bogate w cysteinę (bcrs), które przypominają peptydy Medicago NCR, jednak funkcje tych symbiotycznych peptydów nie zostały jeszcze zgłoszone (Shigenobu and Stern, 2013).
NCR247: przykład dla multi-Target host Effector
Analiza transkryptomu M. guzki truncatula na różnych etapach ich rozwoju, mikrodissekcja laserowa regionów guzkowych, hybrydyzacja in situ, immunolokalizacja wybranych peptydów oraz fuzje genu promotor-reporterowego w guzkach transgenicznych pozwalają mapować działanie poszczególnych peptydów w komórkach symbiotycznych od wczesnego zakażenia do późnego stanu wiązania azotu. NCR247 ulega ekspresji w starszych warstwach komórkowych strefy II oraz w strefie międzyzwrotnikowej, gdzie zatrzymuje się podział komórek bakteryjnych i następuje niezwykłe wydłużenie endosymbiontów (Farkas i in., 2014). Ten mały kationowy peptyd skutecznie zabijał różne drobnoustroje in vitro, a analiza in silico wykazała jego ekstremalne zdolności wiązania białek. Znakowany FITC NCR247 wszedł do cytozolu bakteryjnego, gdzie możliwe były jego interakcje z licznymi białkami bakteryjnymi. Partnerów wiążących zidentyfikowano przez leczenie bakterii S. meliloti lub bacteroidów peptydami StrepII / FLAG, a następnie chromatografię powinowactwa i identyfikację partnerów interakcji z LC-MS/MS i analizą zachodnią (Farkas et al., 2014).
jednym z interakcji było białko podziału komórek ftsz, odgrywające kluczową rolę w podziale komórek. Wiadomo, że wiele antybiotykowych peptydów wywiera działanie bakteriobójcze lub bakteriostatyczne poprzez interakcję z FtsZ, hamując jego polimeryzację, utrudniając w ten sposób prawidłowe tworzenie pierścienia Z i przegrody (Handler et al., 2008). NCR247 oczyszczono razem z FtsZ z cytoplazmy bakteryjnej i wykazano, że zaburza tworzenie się przegrody. NCR035 wykazujący in vitro również działanie bakteriobójcze i wytwarzany w tych samych komórkach symbiotycznych, co NCR247, gromadzi się w przegrodzie podziału, co wskazuje na jednoczesne lub kolejne działanie tych peptydów i ewolucję wielu strategii gospodarza w celu zahamowania proliferacji endosymbiontów. Inne badanie wykazało, że ekspresja ważnych genów podziału komórek, w tym genów wymaganych do funkcji pierścienia Z, była silnie atenuowana w komórkach leczonych NCR247 (Penterman et al., 2014). Wstępne leczenie bakterii o sub-letalnych stężeniach NCR247 zniosło lokalizację FITC-NCR035 do przegrody i wywołało wydłużenie komórek (Farkas et al., 2014).
białka rybosomalne były najliczniejszymi partnerami interakcji NCR247. Zaobserwowano, że NCR247 silnie hamuje syntezę białek bakteryjnych w sposób zależny od dawki, zarówno In vivo, jak i in vitro (Farkas i in., 2014). Wyniki te sugerują, że jednym z trybów działania peptydu NCR247 jest wiązanie z rybosomami zarówno w komórkach bakteryjnych, jak i bacteroidach. Co ciekawe, w bacteroidach zaobserwowano zmieniony wzór i zmniejszoną złożoność oddziałujących ze sobą białek. W związku z tym ogólny poziom ekspresji białek rybosomalnych był średnio 20-krotnie niższy w bakteriach niż w wolnożyjących komórkach z różną względną obfitością transkryptów poszczególnych białek rybosomalnych. Dywersyfikacja rybosomów w bakterioidach może odgrywać istotną rolę, przyczyniając się do zaawansowanej translacji określonych białek, wspierając tym samym wyspecjalizowaną, wymagającą energii fizjologię bardzo obfitej funkcji wiązania azotu.
groel chaperon był również bezpośrednim partnerem interakcji NCR247 (Farkas et al., 2014). Spośród 5 białek GroEL, GroEL1 lub GroEL2 wystarcza do przeżycia, podczas gdy GroEL1 wyrażony na wysokim poziomie w guzku jest niezbędny do symbiozy (Bittner i wsp., 2007). Jest potrzebny do pełnej aktywacji genów nodulacyjnych i montażu kompleksu nitrogenazy. GroEL posiada niezwykłą funkcjonalną wszechstronność poprzez interakcję z setkami białek. Interakcja NCR247-GroEL1 może mieć wpływ bezpośrednio na GroEL, ale pośrednio również na jego podłoża i związane z nimi procesy biologiczne. Brak GroEL1 poważnie wpłynął na zakażenie bakteryjne oraz utrzymanie i różnicowanie bacteroidów wykazujących ogólną potrzebę stosowania GroEL1 we wszystkich stadiach rozwoju guzków wiążących azot.
udział peptydów Groela i gospodarza w interakcjach mikrob-gospodarz nie jest wyjątkowy w symbiozie Rhizobium-strączkowe. W komórkach symbiotycznych weevil coleopterycyna – a (ColA) współdziała również z GroEL (Login et al., 2011). GroEL odgrywa również ważną rolę w utrzymaniu endosymbiontów (Moran, 1996; Kupper et al., 2014). Ponieważ większość systemów symbiotycznych jest jeszcze niezbadana, a narzędzia genomowe i proteomiczne o wysokiej przepustowości są dopiero niedawno dostępne, możemy jedynie przewidzieć, że różnicowanie endosymbiontów za pośrednictwem peptydów gospodarza, podobnie amplifikacja genomu komórek gospodarza i terminalnie zróżnicowane endosymbionty są ogólnymi strategiami symbiozy.
wniosek
symbiotyczne i patogenne bakterie stosują podobne podejścia do interakcji z gospodarzami i przetrwania w komórkach gospodarza, nawet jeśli wyniki tych interakcji są uderzająco różne. Rośliny i zwierzęta mogą generować wrodzone odpowiedzi immunologiczne na mikroorganizmy na podstawie percepcji MAMPs (wzorców molekularnych związanych z mikroorganizmami). Ta percepcja powoduje aktywację kaskad sygnalizacyjnych i produkcję efektorów przeciwdrobnoustrojowych. Amp-podobne peptydy gospodarza, takie jak M. peptydy truncatula NCR lub peptyd przeciwdrobnoustrojowy weevil ColA odgrywają kluczową i wieloaspektową rolę w kontrolowaniu namnażania i różnicowania endosymbiontów, ograniczając w ten sposób obecność bakterii w komórkach symbiotycznych. Tak więc organizmy gospodarza wykorzystują te peptydy efektorowe, aby oswoić, a nawet wynająć wybranych najeźdźców drobnoustrojów do służby.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
Praca w naszych laboratoriach jest wspierana przez”SYM-BIOTICS” Advanced Grant Europejskiej Rady ds. badań dla Évy Kondorosi (grant numer 269067) oraz przez TÁMOP-4.2.2.A-11/1 / KONV-2012-0035 dofinansowany ze środków Unii Europejskiej i współfinansowany ze środków Europejskiego Funduszu Społecznego.
Rola flawonoidów w tworzeniu endosymbiozy korzeni roślin z grzybami arbuskularnymi, bakteriami rhizobia i Frankia. Sygnał Roślinny. Zachowuj się. 7, 636–641. doi: 10.4161 / psb.20039
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Alunni, B., Kevei, Z., Redondo-Nieto, M., Kondorosi, A., Mergaert, P., and Kondorosi, E. (2007). Genomic organization and evolutionary insights on GRP and NCR genes, two large nodule-specific gene families in Medicago truncatula. Mol. Plant Microbe Interact. 20, 1138–1148. doi: 10.1094/MPMI-20-9-1138
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Barnett, M. J., Fisher, R. F., Jones, T., Komp, C., Abola, A. P., Barloy-Hubler, F., et al. (2001). Sekwencja nukleotydów i przewidywane funkcje całego Megaplasmidu Sinorhizobium meliloti pSymA. Proc. Natl. Acad. Sci. U. S. A. 98, 9883-9888. doi: 10.1073 / pnas.161294798
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Bittner, A. N., Foltz, A., and Oke, V. (2007). Do przetrwania i udanej symbiozy w Sinorhizobium meliloti potrzebny jest tylko jeden z pięciu genów groela. J. Bakteriol. 189, 1884–1889. doi: 10.1128 / JB.01542-06
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Brear, E. M., Day, D. A., and Smith, P. M. (2013). Iron: an essential micronutrient for the legume-Rhizobium symbiosis. Front. Plant Sci. 4:359. doi: 10.3389/fpls.2013.00359
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Catalano, C. M., Lane, W. S., and Sherrier, D. J. (2004). Biochemical characterization of symbiosome membrane proteins from Medicago truncatula root nodules. Electrophoresis 25, 519–531. doi: 10.1002/elps.200305711
PubMed Streszczenie | PubMed Pełny tekst/CrossRef Pełny tekst
Capela, D., Barloy-Hubler, F., Gouzy, J., Bothe, G., Ampe, F., Batut, J.,et al. (2001). Analiza sekwencji chromosomów symbionta strączkowego Sinorhizobium meliloti szczep 1021. Proc. Natl. Acad. Sci. U. S. A. 98, 9877-9882. doi: 10.1073 / pnas.161294398
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Cebolla, A., Vinardell, J. M., Kiss, E., Oláh, B., Roudier, F., Kondorosi, A.,et al. (1999). Inhibitor mitotyczny ccs52 jest wymagany do endoreduplikacji i zależnego od ploidy powiększania komórek u roślin. EMBO J. 18, 4476-4484. doi: 10.1093/emboj/18.16.4476
CrossRef Pełny tekst
Chen, W. M., Moulin, L., Bontemps, C., Vandamme, P., Béna, G., and Boivin-Masson, C. (2003). Symbiotyczne wiązanie azotu roślin strączkowych przez β-proteobakterie jest powszechne w przyrodzie. J. Bakteriol. 185, 7266–7272. doi: 10.1128 / JB.185.24.7266-7272.2003
CrossRef Pełny tekst
Edgar, B. A., Zielke, N., and Gutierrez, C. (2014). Endocycles: a recurrent evolutionary innovation for post-mitotic cell growth. Nat. Ks. Mol. Cell. Biol. 15, 197–210. doi: 10.1038/Nrm3756
PubMed Streszczenie | PubMed Pełny tekst/CrossRef Pełny tekst
Farkas, A., Maróti, G., Dürgõ, H., Györgypál, Z., Lima, R. M., Medzihradszky, K. F.,et al. (2014). Medicago truncatula symbiotyczny peptyd NCR247 przyczynia się do różnicowania bakterii poprzez wiele mechanizmów. Proc. Natl. Acad. Sci. U. S. A. 111, 5183-5188. doi: 10.1073 / pnas.1404169111
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Favery, B., Complainville, A., Vinardell, J. M., Lecomte, P., Vaubert, D., Mergaert, P.,et al. (2002). The endosymbiosis-induced genes ENOD40 and CCS52a are involved in endoparasitic-nematode interactions in Medicago truncatula. Mol. Plant-Microbe Interact. 15, 1008–1013. doi: 10.1094/MPMI.2002.15.10.1008
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franssen, H. J., Vijn, I., Yang, W. C., and Bisseling, T. (1992). Developmental aspects of the Rhizobium-legume symbiosis. Plant Mol. Biol. 19, 89–107. doi: 10.1007
CrossRef Full Text
Fraysse, N., Couderc, F., and Poinsot, V. (2003). Surface polysaccharide involvement in establishing the Rhizobium–legume symbiosis. Eur. J. Biochem. 270, 1365–1380. doi: 10.1046/j.1432-1033.2003.03492.x
CrossRef Full Text
Genre, A., Chabaud, M., Faccio, A., Barker, D. G., and Bonfante, P. (2008). Zespół aparatu prepenetracyjnego poprzedza i przewiduje wzorce kolonizacji arbuskularnych grzybów mikoryzowych w korze korzeniowej zarówno Medicago truncatula, jak i Daucus carota. Komora Roślinna 20, 1407-1420. doi: 10.1105 / tpc.108.059014
PubMed Abstract | PubMed Full Text | CrossRef Full Text
Peptydowy inhibitor cytokinezy podczas sporulacji w Bacillus subtilis. Mol. Mikrobiol. 68, 588–599. doi: 10.1111 / j.1365-2958.2008.06173.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ivanov, S., Fedorova, E. E., Limpens, E., De Mita, S., Genre, A., Bonfante, P.,et al. (2012). Rhizobium–legume symbiosis shares an exocytotic pathway required for arbuscule formation. Proc. Natl. Acad. Sci. U.S.A. 109, 8316–8321. doi: 10.1073/pnas.1200407109
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kevei, Z., Vinardell, J. M., Kiss, G. B., Kondorosi, A., and Kondorosi, E. (2002). Białka bogate w glicynę kodowane przez rodzinę genów specyficznych dla guzków są zaangażowane w różne etapy symbiotycznego rozwoju guzków u Medicago spp. Mol. Mikroorganizmy Roślinne Oddziałują. 15, 922–931. doi: 10.1094 / MPMI.2002.15.9.922
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Kondorosi, E., and Kondorosi, A. (2004). Endoreduplikacja i aktywacja kompleksu promującego anafazę podczas rozwoju komórki symbiotycznej. FEBS Lett. 567, 152–157. doi: 10.1016 / j.febslet.2004.04.075
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Kondorosi, E., Mergaert, P., and Kereszt, A. (2013). Paradygmat życia endosymbiotycznego: różnicowanie komórek bakterii Rhizobium wywołane czynnikami roślin żywicielskich. Annu. Ks. Mikrobiol. 67, 611–628. doi: 10.1146/annurev-micro-092412-155630
CrossRef Pełny tekst
Kupper, M., Gupta, S. K., Feldhaar, H., and Gross, R. (2014). Wszechstronne role opiekuna w interakcjach mikroorganizm-owad. FEMS Microbiol. Lett. 353, 1–10. doi: 10.1111/1574-6968.12390
PubMed Streszczenie | PubMed Pełny tekst/CrossRef Pełny tekst
Limpens, E., Ivanov, S., van Esse, W., Voets, G., Fedorova, E., and Bisseling, T. (2009). Medicago N2-fixing symbiosomes nabywają endocytic identity marker Rab7 ale opóźniają nabywanie wakuolar identity. Plant Cell 21, 2811-2828. doi: 10.1105 / tpc.108.064410
PubMed Streszczenie | PubMed Pełny tekst/CrossRef Pełny tekst
Login, F. H., Balmand, S., Vallier, A., Vincent-Monégat, C., Vigneron, A., Weiss-Gayet, M., et al. (2011). Peptydy przeciwdrobnoustrojowe utrzymują endosymbionty owadów pod kontrolą. Nauka 334, 362-365. 10.1126 / nauka1209728
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
MacLean, A. M., Finan, T. M., and Sadowsky, M. J. (2007). Genomy symbiotycznych bakterii wiążących azot roślin strączkowych. Plant Physiol. 144, 615–622. doi: 10.1104/PP.107. 101634
PubMed Streszczenie | PubMed Pełny tekst/CrossRef Pełny tekst
Maunoury, N., Redondo-Nieto, M., Bourcy, M., Van de Velde, W., Alunni, B., Laporte, P., et al. (2010). Różnicowanie komórek symbiotycznych i endosymbiontów jest sprzężone z dwoma transcriptome-przełącznikami w Medicago truncatula nodulation. PLoS ONE 5: e9519. doi: 10.1371 / dziennik.pone.0009519
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Mergaert, P., Nikovics, K., Kelemen, Z., Maunoury, N., Vaubert, D., Kondorosi, A.,et al. (2003). Nowa rodzina w Medicago truncatula składająca się z ponad 300 genów specyficznych dla guzków kodujących małe, wydzielane polipeptydy z zachowanymi motywami cysteiny. Plant Physiol. 132, 161–173. doi: 10.1104/pp.102.018192
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mergaert, P., Uchiumi, T., Alunni, B., Evanno, G., Cheron, A., Catrice, O.,et al. (2006). Eukaryotic control on bacterial cell cycle and differentiation in the Rhizobium-legume symbiosis. Proc. Natl. Acad. Sci. U.S.A. 103, 5230–5235. doi: 10.1073/pnas.0600912103
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Moran, N. A. (1996). Przyspieszona ewolucja i zapadka Mullera w bakteriach endosymbiotycznych. Proc. Natl. Acad. Sci. U. S. A. 93, 2873-2878. doi: 10.1073 / pnas.93.7.2873
CrossRef Pełny tekst
Moran, N. A., McCutcheon, J. P., and Nakabachi, A. (2008). Genomika i ewolucja dziedzicznych symbiontów bakteryjnych. Annu. Wielebny Genet. 42, 165–690. doi: 10.1146 / annurev.genet.41.110306.130119
CrossRef Pełny tekst
Nakabachi, A., Koshikawa, S., Miura, T., and Miyagishima, S. (2010). Wielkość genomu Pachypsylla venusta (Hemiptera: Psyllidae) i ploidy jego bakteriocytów, symbiotycznej komórki gospodarza, która zawiera wewnątrzkomórkowe mutualistyczne bakterie z najmniejszym genomem komórkowym. Bzdura. Entomol. Res. 100, 27-33. doi: 10.1017/S0007485309006737
PubMed Abstract | PubMed Full Text/CrossRef Full Text
Nagl, W. (1976). Endoreduplikacja i politenja DNA rozumiana jako strategie ewolucyjne. Nature 261, 614-615. doi: 10.1038/261614a0
PubMed Abstract | PubMed Full Text/CrossRef Full Text
Nallu, S., Silverstein, K. A., Zhou, P., Young, N. D., and Vandenbosch, K. A. (2014). Patterns of divergence of a large family of nodule cysteine-rich peptides in accessions of Medicago truncatula. Zakład J. 78, 697-705. 10.1111 / tpj12506
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Oldroyd, G. E. (2013). Speak, friend, and enter: systemy sygnalizacji, które promują korzystne skojarzenia symbiotyczne w roślinach. Nat. Ks. Mikrobiol. 11, 252–263. doi: 10.1038/nrmicro2990
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Oono, R., Schmitt, I., Sprent, J. I., and Denison, R. F. (2010). Multiple evolutionary origins of legume traits leading to extreme rhizobial differentiation. New Phytol. 187, 508–520. doi: 10.1111/j.1469-8137.2010.03261.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Penterman, J., Abo, R. P., De Nisco, N. J., Arnold, M. F., Longhi, R., Zanda, M.,et al. (2014). Peptydy roślin żywicielskich wywołują transkrypcyjną odpowiedź w celu kontrolowania cyklu komórkowego Sinorhizobium meliloti podczas symbiozy. Proc. Natl. Acad. Sci. U. S. A. 111, 3561-3566. doi: 10.1073 / pnas.1400450111
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Cena, D. R., Duncan, R. P., Shigenobu, S., and Wilson, A. C. (2011). Ekspansja genomu i ekspresja różnicowa transporterów aminokwasów w symbiotycznym interfejsie mszyca / buchnera. Mol. Biol. Evol. 28, 3113–3126. doi: 10.1093/molbev/msr140
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Roudier, F., Fedorova, E., Lebris, M., Lecomte, P., Györgyey, J., Abad, P.,et al. (2003). The Medicago species A2-type cyclin is auxin regulated and involved in meristem formation but dispensable for endoreduplication-associated developmental programs. Plant Physiol. 131, 1091–1103. doi: 10.1104/pp.102.011122
CrossRef Full Text
Roux, B., Rodde, N., Jardinaud, M. F., Timmers, T., Sauviac, L., Cottret, L.,et al. (2014). Zintegrowana analiza ekspresji genów roślinnych i bakteryjnych w symbiotycznych guzkach korzeniowych za pomocą mikrodysekcji laserowej połączonej z sekwencjonowaniem RNA. Zakład J. 77, 817-837. 10.1111 / tpj12442
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Shigenobu, S., and Stern, D. L. (2013). Mszyce wyewoluowały nowe wydzielane białka w symbiozie z endosymbiontem bakteryjnym. Proc. Biol. Sci. 280, 20121952. 10.1098/2012.1952
PubMed Streszczenie | PubMed Pełny tekst | CrossRef Pełny tekst
Sinharoy, S., Torres-Jerez, I., Bandyopadhyay, K., Kereszt, A., Pislariu, C. I., Nakashima, J.,et al. (2013). Regulator czynnika transkrypcyjnego C2H2 różnicowania symbiosomu hamuje transkrypcję genu wydzielniczego Szlaku VAMP721a i wspomaga rozwój symbiosomu w Medicago truncatula. Plant Cell 25, 3584-3601. doi: 10.1105 / tpc.113.114017
PubMed Abstract | PubMed Full Text | CrossRef Full Text
Terpolilli, J. J., Hood, G. A., and Poole, P. S. (2012). What determines the efficiency of N(2)-fixing Rhizobium-legume symbioses? Adv. Microb. Physiol. 60, 325–389. doi: 10.1016/B978-0-12-398264-3.00005-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tiricz, H., Szûcs, A., Farkas, A., Pap, B., Lima, R. M., Maróti, G.,et al. (2013). Antimicrobial nodule-specific cysteine-rich peptides induce membrane depolarization associated changes in Sinorhizobium meliloti. Appl. Env. Microbiol. 79, 6737–6746. doi: 10.1128/AEM.01791-13
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Van de Velde, W., Zehirov, G., Szatmari, A., Debreczeny, M., Ishihara, H., Kevei, Z.,et al. (2010). Plant peptides govern terminal differentiation of bacteria in symbiosis. Science 327, 1122–1126. doi: 10.1126/science.1184057
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vinardell, J. M., Fedorova, E., Cebolla, A., Kevei, Z., Horvath, G., Kelemen, Z.,et al. (2003). Endoreduplikacja za pośrednictwem aktywatora kompleksu promującego ANAFAZĘ CCS52A jest wymagana do symbiotycznego różnicowania komórek w guzkach Truncatula Medicago. Plant Cell 15, 2093-2105. doi: 10.1105 / tpc.014373
PubMed Abstract | PubMed Full Text | CrossRef Full Text
Pozycja Rhizobium leguminosarum bv. viciae do włosków korzeniowych wymaga minimalnej specyficzności czynnika Nod, ale późniejszy wzrost nici infekcyjnych wymaga nodO lub węzła. Mol. Roślina-Mikroby Współdziałają.13, 54–62. doi: 10.1094 / MPMI.2000.13.7.754
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text