wprowadzenie
neuralgia trójdzielna (TN), zwana również „tic douloureux”, jest nagłym, Zwykle jednostronnym, ciężkim, krótkim, przeszywającym i nawracającym bólem w rozkładzie nerwu trójdzielnego z częstością występowania 4 na 100 000 w populacji ogólnej (1). Do tej pory opracowano wiele opcji leczenia, aby zapewnić ulgę w bólu u pacjentów z TN. Do tej pory terapia lekowa, przezskórna termokoagulacja o częstotliwości radiowej (PRT) zwoju trójdzielnego (2), wstrzyknięcie glicerolu, kompresja balonowa, radiochirurgia stereotaktyczna i dekompresja mikronaczyniowa (MVD) były stosowane w leczeniu TN. Wśród nich terapia pierwszego rzutu jest terapią farmakologiczną, ponieważ jest natychmiast dostępna i zwykle skuteczna w większości przypadków. Gdy terapia farmakologiczna nie powiedzie się z powodu złej kontroli bólu lub nieznośnych skutków ubocznych, często rozważa się inne techniki, takie jak PRT i MVD.
przeprowadzono szereg badań w celu porównania skuteczności i bezpieczeństwa różnych technik (3-6). Według najnowszych publikacji MVD oferuje najlepsze wyniki w zakresie poprawy jakości życia i łagodzenia bólu w dłuższej perspektywie (7). PRT oferuje dobrą skuteczność (ponad 90%), ale z wysokim wskaźnikiem nawrotów (15-20%) (8-10). Należy jednak zauważyć, że PRT jest zwykle lepszym wyborem dla pacjentów w podeszłym wieku ze względu na mniejszą zachorowalność i śmiertelność w porównaniu z MVD (11). Ponadto PRT oferuje najwyższy wskaźnik całkowitego uśmierzenia bólu (12).
PRT można poddać u tego samego pacjenta w przypadku nawrotów TN, szczególnie u pacjentów w starszym wieku (13). W niektórych wcześniejszych badaniach oceniano, czy powtarzające się PRT można stosować u pacjentów z nawracającym TN (13-16), ale większość z nich nie porównywała skuteczności i bezpieczeństwa powtarzanego PRT z grupą kontrolną, tj. pacjentów leczonych początkowym PRT. Taka wiedza jest bardzo potrzebna, ponieważ nawracająca TN jest dużym wyzwaniem dla lekarzy klinicznych i nadal nie jest jasne, czy powtarzana PRT może być skuteczna u pacjentów z nawracającą TN, zwłaszcza u tych, którzy nie mogą poddać się terapii MVD z powodu związanej z nią zachorowalności lub śmiertelności. Ponadto częstość i nasilenie działań niepożądanych powtarzających się PRT były w dużej mierze niejasne, co chcieliśmy zbadać w tym badaniu.
metody
pacjenci
to badanie zostało zatwierdzone przez Komitet etyczny drugiego szpitala Uniwersytetu Medycznego w Hebei, a pisemną świadomą zgodę (w tym obraz do publikacji) uzyskano od wszystkich pacjentów przed zaangażowaniem w badanie. Wszystkie metody zostały wykonane zgodnie z odpowiednimi wytycznymi i przepisami szpitala. Od stycznia 2013 r. do maja 2013 r. łącznie 72 pacjentów z TN poddano 3-D ct-guided PRT w szpitalu i włączono do naszego badania. Wśród nich 31 pacjentów, którzy wcześniej otrzymywali PRT, leczono powtarzaną PRT (Grupa A), A 41 pacjentów z TN, którzy nigdy nie otrzymali żadnej operacji, leczono początkowym PRT (grupa B). Wszystkich tych pacjentów obserwowano przez 2 lata.
wszyscy pacjenci zostali wybrani na podstawie następujących kryteriów: (1) pierwotna TN podziałów szczękowych i/lub żuchwowych w ciągu jednego roku w oparciu o objawy opisane przez klasyfikację International Headache Society, (2) niepowodzenie leczenia farmakologicznego wieloma lekami przeciwpadaczkowymi lub nawrót po PRT, (3) wynik wizualnej skali analogowej bólu (vas) powyżej 7/10 i słaba jakość życia z powodu bólu, (4) jedna lub więcej z następujących cech: słaba kandydatura do znieczulenia ogólnego, kraniotomia pod potyliczna, preferencje pacjenta w celu uniknięcia kraniotomii w przypadku MVD i (5) prawidłowa ocena mózgu rezonans magnetyczny.
pacjenci, którzy przeszli inne inwazyjne lub nieinwazyjne leczenie (kompresja balonowa, rhizotomia glicerolu, gamma knife, MVD) oraz pacjenci z bólem twarzy innym niż TN zostali wykluczeni z badania.
operacja PRT
uzyskano szczegółowy wywiad lekarski i przeprowadzono rutynowe badania krwi przedoperacyjne u wszystkich pacjentów. Zbadano również obrazowanie CT / MRI głowy.
operacja została wykonana w sali operacyjnej CT ze sterylizacją. Procedura operacyjna została wyjaśniona pacjentom przed operacją i została przeprowadzona zgodnie z wytycznymi 3-D CT. Pacjenci byli na czczo przez co najmniej 6 godzin przed operacją, a profilaktycznie podawano antybiotyk 1 godzinę przed operacją. Podczas operacji monitorowano elektrokardiogram, ciśnienie krwi i pulsoksymetrię. Fentanyl i midazolam podawano zwykle w małych dawkach dożylnie w celu znieczulenia i uspokojenia. Pacjenci byli obudzeni podczas operacji.
wszyscy pacjenci przeszli PRT (wstępną lub powtarzaną) przez jednego chirurga, aby uniknąć niejednorodności błędu operacyjnego. Zgodnie ze słodką techniką pacjent leżał w pozycji leżącej na stole, a głowa i szyja znajdowały się w normalnej pozycji. Znaki hartela były rysowane na twarzy ołówkiem znakującym, a punkt wejścia igły był zwykle 3 cm do kąta ust. Dwa inne punkty to (1) przyśrodkowy Brzeg źrenicy i (2) punkt 2,5 cm przed tragusem na łuku jarzmowym służący jako płaszczyzna do przekierowania igły do otworu owalnego (17).
po miejscowym nacieku 0,5% lidokainy (10 ml) wzdłuż trajektorii kaniulacji nad skórą i tkanką podskórną zastosowano kaniulę o częstotliwości radiowej 22 mm i długości 10 cm z aktywną końcówką 5 mm. Kaniula podążała po linii prostej skierowanej w kierunku źrenicy, gdy widziana jest z przodu, i przeszła 3 cm przedni do zewnętrznego słuchowego miatus, gdy widziana jest z boku, a następnie ustawiona płynnie wokół otworu owalnego bez dyskomfortu pacjenta. Po dotarciu igły do podstawy czaszki przeprowadzono badanie przesiewowe podstawy czaszki (w odstępach 2 mm, 120 kV, 500 mAs, Philips Brilliance CT, Holland) w celu uzyskania obrazu 3D i potwierdzenia zależności między lokalizacją końcówki igły a otworem owalnym. Na podstawie obrazu 3D, igła została dostosowana do wejścia do otworu owalnego. W większości przypadków wejście T do otworu owalnego było łatwe, ale niektóre przypadki były trudne do osiągnięcia i wymagały kilku prób. Wykonano tomografię komputerową w celu potwierdzenia prawidłowej lokalizacji i głębokości końcówki kaniuli w otworze owalnym (ryc. 1).
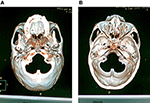
Rysunek 1. Wykonano tomografię komputerową w celu potwierdzenia prawidłowej lokalizacji i głębokości końcówki kaniuli w otworze owalnym. (A) obraz 3-D scaphion view pokazał lokalizację kaniuli w otworze owalnym. (B) trójwymiarowy obraz przyśrodkowego widoku podstawy czaszki pokazywał głębokość końcówki kaniuli w otworze jajowym.
dla różnych korzeni nerwu trójdzielnego aferentnych do zwoju trójdzielnego, każda z korzeni otrzymała dane sensoryczne z różnych regionów twarzy. Stymulacja 50 Hz, 0,1–0.2 V użyto do identyfikacji podziału nerwu, aby upewnić się, że końcówka elektrody dociera do pozycji, jednocześnie pozyskując subiektywny raport pacjenta o odczuciu w odpowiedzi na stymulację. Następnie stylet usunięto z kaniuli i przeprowadzono aspirację, aby upewnić się, że nie ma płynu mózgowo-rdzeniowego (CSF) lub krwi. W przypadku odsysania płynu mózgowo-rdzeniowego lokalizacja końcówki kaniuli byłaby dostosowana. Wstrzyknięcie 2% lidokainy (0,2 ml) do zwoju trójdzielnego pomogło złagodzić ból związany z termokoagulacją. Zmianę PRT w temperaturze 75°C przeprowadzono przez 90 s. Aby uzyskać skuteczne złagodzenie bólu, końcówka kaniuli zwykle była przestawiana i wykonywano dodatkowe zmiany termiczne. Następnie usunięto kaniulę, a pacjentów przeniesiono na oddział i wypisano po 48 godzinach. operację powtórzono, jeśli nie uzyskano zadowalającej ulgi w bólu po 48 godzinach.
skuteczność
do oceny intensywności bólu wykorzystano wizualną skalę analogową (vas), składającą się z linii 10 cm z dwoma punktami końcowymi oznaczonymi jako „bez bólu” i „najbardziej intensywny ból możliwy do wyobrażenia”. Wyniki VAS uzyskano przedoperacyjnie i 48 h pooperacyjnie poprzez wywiady twarzą w twarz. Wynik końcowy został podzielony na trzy kategorie: doskonały, dobry i słaby. „Excellent” był używany dla tych pacjentów, którzy byli bezbolesni; „good” używane dla tych, którzy byli w bólu, ale z wynikiem VAS ≦2 bez leków w 48 h; „poor” używane dla tych, którzy byli w bólu, z wynikiem vas ≧3 z lub bez leków.
częstość nawrotów
została zdefiniowana jako powrót bólu trójdzielnego, który miał takie same cechy jak przed operacją, z wynikiem VAS ≧3 i częstością bólu ≧3 razy dziennie bez stosowania leków. Wszyscy pacjenci byli obserwowani i badani po 6 miesiącach, 1 i 2 latach. Wyniki VAS po 2 latach obserwacji uzyskano w drodze rozmów telefonicznych przez niezależnego lekarza, który nie brał udziału w badaniu, a także zarejestrowano czas nawrotu.
powikłania podczas operacji
nudności, wymioty, zmiana częstości akcji serca (bradykardia lub tachyarytmia), zmiana ciśnienia krwi (nadciśnienie lub niedociśnienie) i inne powikłania (inne niedowłady nerwów czaszkowych, przetoka płynu mózgowo-rdzeniowego i krwotok wewnątrzczaszkowy) podczas operacji. Jeśli chodzi o długoterminowe wyniki, wszyscy pacjenci zostali przesłuchani na temat osłabienia żucia, dysestezji i drętwienia rogówki po PRT.
statystyki
SPSS Wersja 13 (SPSS Inc. Chicago, IL, USA) wykorzystano do analizy statystycznej. Dane analizowano pod kątem skuteczności działania, nawrotu bólu i powikłań. Dane nieparametryczne analizowano za pomocą testu Manna Whitneya. Inne dane analizowano za pomocą testu t ucznia między dwiema grupami. Dane kategoryczne zostały przeanalizowane za pomocą dokładnego testu Fishera. Wyniki przedstawiono jako średnią (SD). Różnice uznano za istotne statystycznie, gdy P < 0,05.
wyniki
od stycznia 2013 do maja 2013, w sumie 72 pacjentów z TN poddano 3-D ct-guided PRT w drugim szpitalu Hebei Medical University i zostały włączone do naszego badania. Wśród nich 31 pacjentów z nawracającą TN było leczonych powtarzaną PRT (Grupa A), a 41 pacjentów z TN było leczonych początkową PRT (grupa B).Wyjściową charakterystykę pacjentów podsumowano w tabeli 1. W obu grupach przeważały samice. Średni ± SD wiek wynosił odpowiednio 68, 52 ± 11, 61 lat w grupie A i 67, 15 ± 11, 57 lat w grupie B. Większość z tych pacjentów była po prawej stronie z 61,3% w grupie A i 61,0% w grupie B. nerw żuchwowy był zaangażowany w 58,1% w grupie A i 48,8% w grupie B, podczas gdy nerwy szczękowe i żuchwowe były zaangażowane w 41,9% w grupie A i 51,2% w grupie B. średni ± SD czas trwania neuralgii wynosił 9,94 ± 5,69 lat i 10,12 ± 5,73 lat w grupie A i grupie B. odpowiednio. Niedoczulica twarzy występowała u 10 (32,3%) pacjentów w grupie A, A żadnego z nich nie odnotowano w grupie B przedoperacyjnie. Wszyscy 10 pacjenci czuli łagodną niedoczulica twarzy.
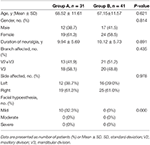
Tabela 1. Porównanie cech demograficznych i klinicznych na początku badania pomiędzy grupą A i grupą B.
skuteczność
w naszym badaniu nie stwierdzono niepowodzenia technicznego i we wszystkich przypadkach uzyskano udane wejście do otworu owalnego. Po powtórzeniu PRT wskaźnik całkowitego złagodzenia bólu (doskonały) wynosił 96,8% (30/31) w grupie A, podczas gdy wynosił 97,6% (40/41) wśród pacjentów otrzymujących początkową PRT w grupie B. jeden pacjent w grupie A i jeden w grupie B wymagał powtórzenia operacji.
powikłania podczas operacji
powikłania podczas operacji były rejestrowane (Tabela 2) i nie było różnicy między obiema grupami. Niedoczulica twarzy wystąpiła u wszystkich pacjentów (100% w grupie A i 100% w grupie B) bezpośrednio po operacji. Wszyscy odczuwali umiarkowaną hipoestezję twarzy pooperacyjnie. Nudności i wymioty wystąpiły u 4 (12,9%) pacjentów z grupy A i U 5 (12,2%) pacjentów z grupy B podczas operacji. Zmiana częstości akcji serca (bradykardia lub tachyarytmia) wystąpiła u 22 (71,0%) pacjentów z grupy A i u 30 (73.2%) w grupie B podczas operacji. Nadciśnienie wystąpiło u 20 (64,5%) pacjentów z grupy A i u 29 (70,7%) pacjentów z grupy B. nie stwierdzono niedociśnienia tętniczego.

Tabela 2. Porównanie powikłań podczas operacji pomiędzy grupą A i grupą B.
osłabienie mięśni żucia wystąpiło u 3 (9,7%) pacjentów z grupy A i U 4 (9,8%) pacjentów z grupy B. Nie stwierdzono drętwienia rogówki, zapalenia rogówki, innych niedowładów nerwów czaszkowych, przetoki płynu mózgowo-rdzeniowego, znieczulenia dolorosa i krwotoku wewnątrzczaszkowego podczas i po operacjach PRT i nie odnotowano zgonu.
nawrót TN
odsetek nawrotów TN po 6, 12 i 24 miesiącach wynosił 3, 2, 9, 7 i 19, 4% w grupie A, podczas gdy w grupie B wynosił 2, 4, 9, 8 i 17% (Tabela 3). Nie było znaczącej różnicy.

Tabela 3. Porównanie nawrotów bólu pomiędzy grupą A i grupą B.
dyskusja
TN jest zaburzeniem nerwu trójdzielnego, które powoduje intensywny epizodyczny ból, który pogarsza jakość życia. Dostępny jest szeroki zakres strategii leczenia i wykazano, że PRT jest ugruntowaną modalnością leczenia (18, 19). Przezskórne zmiany nerwu trójdzielnego w leczeniu neuralgii nerwu trójdzielnego zostały po raz pierwszy opisane w 1914 roku przez Hartela (20). Biały i słodki udoskonalił procedurę przy użyciu krótko działającego środka znieczulającego, stymulacji elektrycznej (21, 22). Za pomocą obrazowej kaniulacji otworu owalnego, takiej jak CT i fluoroskopia, procedura staje się znacznie łatwiejsza i bezpieczniejsza w ostatnich latach. Uzasadnieniem PRT na TN jest przerwanie bodźców obwodowych w celu dotarcia do ośrodkowego układu nerwowego (23). Można go wykonać u tego samego pacjenta więcej niż jeden raz, jeśli jest to wymagane, ale jego skuteczność i bezpieczeństwo jest nadal niejasne, szczególnie w przypadku pacjentów w Chinach, które staraliśmy się zbadać w tym badaniu.
ct Imaging-guided localization modalies are by far the most superior strategy. Dodanie trójwymiarowej (3-D) rekonstrukcji obrazowania przyniosło bardziej skuteczne i bezpieczne wyniki niż obrazowanie dwuwymiarowe (24). Trójwymiarowa rekonstrukcja może pomóc chirurgowi uzyskać wyraźną bryłę otworu owalnego o innym kształcie u każdego pacjenta. W naszych badaniach często można zaobserwować anatomiczne zmiany wielkości i kształtu otworu owalnego, w tym integrację otworu owalnego i otworu spinosum. Czasami występuje deficyt czaszki w przednio-bocznym aspekcie otworu owalnego u niektórych pacjentów, co może skutkować katastrofalnymi powikłaniami bez ostrożności. Trójwymiarowa rekonstrukcja obrazowa podstawy czaszki należy uzyskać przed operacją, która pomaga znaleźć zmiany anatomiczne i uniknąć nieumyślnego uszkodzenia otaczających struktur nerwowo-naczyniowych. Lokalizacja w otworze owalnym i głębokość penetracji kaniuli są wizualne, co daje zaufanie chirurgowi i znacznie poprawia bezpieczeństwo pacjentów. Ponadto, u pacjentów z wyeksponowanym kośćcem wokół otworu owalnego, który może zakłócać udaną kaniulację podczas konwencjonalnej techniki, trójwymiarowy obraz rekonstrukcji jest bardziej skuteczny i dokładny niż inne techniki. Jako ogólne środki ostrożności zaleca się, aby igła była skierowana w przednio-boczną stronę otworu owalnego i „weszła” do otworu (25). Zmniejsza to możliwość bliskości tętnicy szyjnej i tętnicy oponowej Środkowej. Ponadto pacjent może leżeć w pozycji leżącej na stole, z głową i szyją w zwykłej pozycji prowadzonej przez obrazowanie trójwymiarowe. Takie techniki są bardziej wygodne dla pacjentów z rachiocyfozą i niektórych starych pacjentów niż te prowadzone przez dwuwymiarowe obrazowanie, które wymaga wydłużenia szyi i czasami jest to niemożliwe dla tych pacjentów.
zgodnie z prospektywnym badaniem obejmującym 154 pacjentów leczonych PRT I obserwowanych przez 15 lat (9, 25), 153 (99%) z nich uzyskano początkową ulgę w bólu po PRT i ból utrzymywał się tylko u jednego (1%) pacjenta. W innym badaniu z udziałem 1561 pacjentów stwierdzono odsetek 97,6% początkowego złagodzenia bólu (12). W naszym badaniu stwierdziliśmy, że wskaźniki natychmiastowego złagodzenia bólu i złagodzenia bólu po 48 godzinach były w dużej mierze podobne u pacjentów leczonych powtarzaną PRT i u pacjentów z początkową PRT, co sugeruje, że powtarzana PRT była dobrym rozwiązaniem dla pacjentów z nawracającą TN. Ponadto powtarzające się wskaźniki były porównywalne w obu grupach po 2 latach obserwacji i były zgodne z niektórymi wcześniejszymi sprawozdaniami (8, 9). Nasze dane sugerują, że skuteczność Powtórzonego PRT była porównywalna do początkowej PRT.
głównymi problemami uniemożliwiającymi powszechne stosowanie PRT są skutki uboczne. Dodatkowo przetestowaliśmy bezpieczeństwo powtarzanych PRT w porównaniu do początkowych PRT. Stwierdziliśmy, że nie ma różnicy powikłań w trakcie i po operacji między dwiema grupami, co sugeruje, że powtarzana PRT była bezpieczną procedurą operacyjną u pacjentów z nawracającą TN. Obserwowane w naszym badaniu powikłania były w dużej mierze zgodne z wcześniejszymi doniesieniami. Stwierdzono, że osłabienie żucia wynosiło aż 29%, co było wyższe niż dane przedstawione w niniejszym badaniu. Odkryliśmy, że osłabienie mięśni żucia wystąpiło u około 10% pacjentów w obu grupach, co może być spowodowane (1) ulepszonym obrazowaniem i lokalizacją igły za pomocą 3-D CT i (2) dokładnym mapowaniem przed zmianą.
częstość nawrotów po leczeniu jest kolejną ważną kwestią w leczeniu TN. W dwóch badaniach stwierdzono, że częstość nawrotów wahała się od 7, 8 do 25% odpowiednio w wieku 11, 6 i 14 lat (8, 9). Częstość nawrotów u pacjentów otrzymujących początkową PRT była porównywalna do pacjentów otrzymujących powtarzaną PRT w naszym badaniu, co sugeruje, że powtarzana PRT ma porównywalny wskaźnik nawrotów w porównaniu do początkowej PRT.
przy interpretacji danych należy pamiętać o kilku ograniczeniach. Najpierw wykluczono pacjentów z TN V1 lub V1+V2. Wykonano PRT nerwu nadoczodołowego dla izolowanego 1-go odcinka TN w celu zachowania odruchu rogówki, a PRT nerwu nadoczodołowego i nerwu szczękowego dla 1-go i 2-Go odcinka TN. Innym ograniczeniem było to, że wielkość badanej próbki była niewielka, a czas trwania obserwacji był stosunkowo krótki. Jednak wszyscy ci pacjenci będą stale monitorowani, a dalsze raporty mogą dać nawet jasny obraz powtarzającego się PRT na nawracającej TN.
wnioski
ogólnie powtarzane PRT jest bezpiecznym i skutecznym leczeniem u pacjentów z nawracającą TN. Ponadto częstość i nasilenie działań niepożądanych w przypadku powtarzających się PRT były podobne w porównaniu do początkowych PRT.
wkład autora
wszyscy wymienieni autorzy wnieśli znaczący, bezpośredni i intelektualny wkład w pracę i zatwierdzili ją do publikacji.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
1. Headache Classification Committee of the International Headache Society (IHS). International classification of headache disorders, 3rd edition. Cephalalgia (2018) 38:1–211. 10.1177/0333102417738202
CrossRef Full Text | Google Scholar
2. Mathews ES, Scrivani SJ. Percutaneous stereotactic radiofrequency thermal rhizotomy for the treatment of trigeminal neuralgia. Mt Sinai J Med. (2000) 67:288–99. doi: 10.1097/00006123-200103000-00013
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Kanpolat Y, Ugur HC. Systematyczny przegląd ablacyjnych technik neurochirurgicznych w leczeniu neuralgii nerwu trójdzielnego. Neurochirurgia (2005) 57: E601. doi: 10.1227/01.NEU.0000181084.00290.7 a
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Montano N, Papacci F, Cioni B, di Bonaventura R, Meglio M. Jakie jest najlepsze leczenie lekoopornego neuralgii nerwu trójdzielnego u pacjentów dotkniętych stwardnieniem rozsianym? analiza literaturowa zabiegów chirurgicznych. Clin Neurol Neurosurg. (2013) 115:567–72. doi: 10.1016 / j.clineuro.2012.07.011
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Tatli M, Satici O, Kanpolat Y, Sindou M. Various surgical modalities for trigeminal neuralgia: literature study of respective long-term outcomes. Acta Neurochirurgica (2008) 150:243–55. doi: 10.1007/s00701-007-1488-3
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Henson CF, Goldman HW, Rosenwasser RH, Downes MB, Bednarz G, Pequignot EC, et al. Rhizotomia glicerolu a radiochirurgia gamma knife w leczeniu neuralgii nerwu trójdzielnego: analiza pacjentów leczonych w jednej instytucji. Int J Radiat Oncol Biol Phys. (2005) 63:82–90. doi: 10.1016 / j. ijrobp.2005.01.033
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Berger I, Nayak N, Schuster J, Lee J, Stein s, Malhotra NR. Dekompresja mikronaczyniowa a stereotaktyczna radiochirurgia neuralgii nerwu trójdzielnego: analiza decyzji. Cureus (2017) 9: e1000. doi: 10.7759 / cureus.1000
PubMed Abstract / CrossRef Full Text / Google Scholar
8. Fraioli MF, Cristino B, Moschettoni L, Cacciotti G, Fraioli C. Ważność przezskórnej kontrolowanej termokoagulacji o częstotliwości radiowej w leczeniu izolowanych nerwobólów trójdzielnych trzeciego podziału. Surg Neurol. (2009) 71:180–3. doi: 10.1016 / j.surneu.2007.09.024
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Taha JM, Tew JM Jr, Buncher CR. A prospective 15-year follow up of 154 consecutive patients with trigeminal neuralgia treated by percutaneous stereotactic radiofrequency thermal rhizotomy. J Neurosurg. (1995) 83:989–93. doi: 10.3171/jns.1995.83.6.0989
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Xu SJ, Zhang WH, Chen T, Wu CY, Zhou MD. Neuronawigator-przezskórna termokoagulacja o częstotliwości radiowej w leczeniu uciążliwych nerwobólów trójdzielnych. Chin Med J. (2006)119: 1528-35.
PubMed Abstrakt | Google Scholar
11. van Kleef M, van Genderen WE, Narouze S. 1. Nerwobóle trójdzielne. Pain Pract. (2009) 9:252–9. doi: 10.1111 / j.1533-2500.2009.00298.x
CrossRef Full Text | Google Scholar
12. Kanpolat Y, Savas A, Bekar A, Berk C. Percutaneous controlled radiofrequency trigeminal rhizotomy for the treatment of idiopathic trigeminal neuralgia: 25-year experience with 1,600 patients. Neurosurgery (2001) 48:524–32; discussion 532–4.
PubMed Abstract | Google Scholar
13. Tang YZ, Jin D, Li XY, Lai GH, Li N, Ni JX. Repeated CT-guided percutaneous radiofrequency thermocoagulation for recurrent trigeminal neuralgia. Euro Neurol (2014) 72:54–9. doi: 10.1159/000357868
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Liao C, Visocchi M, Yang M, Liu P, Li S, Zhang W. Pulsed radiofrequency: a management option for recurrent trigeminal neuralgia following radiofrequency thermocoagulation. World Neurosurg. (2017) 97:e5–e7. doi: 10.1016/j.wneu.2016.09.108
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Liu P, Zhong W, Liao C, Yang M, Zhang W. The role of percutaneous radiofrequency thermocoagulation for persistent or recurrent trigeminal neuralgia after surgery. J Craniof Surg. (2016) 27:e752–5. doi: 10.1097/SCS.0000000000003118
CrossRef Full Text | Google Scholar
16. Qu S, Zhu X, Wang T, Li D. Ocena leczniczego wpływu termokoagulacji radiofrekwencyjnej na zwoje semilunarne u chorych w podeszłym wieku z nawracającymi nerwobólami trójdzielnymi. Lin Chung Er Bi Yan Hou Tou Jing Wai KE Za Zhi. (2016) 30:135–8. doi: 10.13201 / J.issn.1001-1781.2016.02. 012
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Sweet WH, Wepsic JG. Kontrolowana termokoagulacja zwojów trójdzielnych i korzeni do różnicowego niszczenia włókien bólowych. 1. Nerwobóle trójdzielne. J Neurochirurg. (1974) 40:143–56. doi: 10.3171/jns.1974.40.2.0143
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Latchaw JP Jr, Hardy RW Jr, Forsythe SB, Cook AF. Trigeminal neuralgia treated by radiofrequency coagulation. J Neurosurg. (1983) 59:479–84. doi: 10.3171/jns.1983.59.3.0479
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Mittal B, Thomas DG. Controlled thermocoagulation in trigeminal neuralgia. J Neurol Neurosurg Psychiatry (1986) 49:932–6. doi: 10.1136/jnnp.49.8.932
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Härtel F. Ueber die intracranielle injektions behandlung der trigeminus neuralgie. Med Klin. (1914) 10: 582–4.
Google Scholar
21. White JC, Sweet WH, Hackett TP. Radiofrequency leukotomy for relief of pain: koagulacja przyśrodkowych przednich białych włókien etapami za pomocą elektrod inlying. Arch Neurol. (1960) 2:317–30. doi: 10.1001 / archneur.1960.03840090081010
PubMed Abstract | CrossRef Full Text | Google Scholar
22. White JC, Sweet WH, Hackett TP. Elektrolityczna leukotomia w celu złagodzenia bólu. Koagulacja radiofrekwencyjna włókien frontothalamicznych etapami za pomocą elektrod wsadowych. Trans Am Neurol Assoc. (1959) 84:88–92.
PubMed Abstract | Google Scholar
23. Carney LR. Considerations on the cause and treatment of trigeminal neuralgia. Neurology (1967) 17:1143–51. doi: 10.1212/WNL.17.12.1143
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Liu M, Wu CY, Liu YG, Wang HW, Meng FG. Three-dimensional computed tomography-guided radiofrequency trigeminal rhizotomy for treatment of idiopathic trigeminal neuralgia. Chin Med Sci J. (2005) 20:206–9.
PubMed Abstract | Google Scholar
25. Gerber AM. Improved visualization of the foramen ovale for percutaneous approaches to the gasserian ganglion. Technical note. J Neurosurg. (1994) 80:156–9. doi: 10.3171/jns.1994.80.1.0156
PubMed Abstract | CrossRef Full Text | Google Scholar