- wprowadzenie
- materiały i metody
- materiały roślinne i warunki wzrostu
- pomiary PSI i PSII
- Elektrochromowa Analiza przesunięć
- zabiegi Fotoinhibicyjne
- Analiza statystyczna
- wyniki
- dyskusja
- rola stymulacji CEF Przy Słabym Oświetleniu
- Zmiana współczynnika utleniania P700 Przy Słabym Świetle nie jest związana z pmf
- ETRII kontroluje Współczynnik utleniania P700 Przy Słabym Oświetleniu
- wniosek
- author Contributions
- finansowanie
- Oświadczenie o konflikcie interesów
wprowadzenie
chociaż światło jest siłą napędową fotosyntezy, wysokie światło może powodować znaczną fotoinhibicję fotosyntezy II (PSII) dla liści roślin tworzących Cień (Kitao et al., 2000; Barth et al., 2001; Krause et al., 2004; Huang et al., 2015b,2016B, c). Jednak fotoinhibited PSII szybko odzyskuje siły przy słabym świetle (He and Chow, 2003; Zhang and Scheller, 2004, Allakhverdiev et al., 2005), ze względu na szybką rotację białka D1 (Aro et al., 1993; Zhang and Scheller, 2004; Allakhverdiev et al., 2005). Szybkość naprawy PSII została zmniejszona po hamowaniu syntezy ATP poprzez PSI lub PSII (Allakhverdiev i wsp ., 2005), wskazując, że szybka naprawa fotouszkodzonych kompleksów PSII wymaga dużej ilości ATP w krótkim czasie. Poprzednie badanie wykazało, że po wywołanej chłodzeniem fotoinhibicji PSII, cykliczny przepływ elektronów (CEF)był znacząco stymulowany podczas odzyskiwania przy słabym świetle (Huang et al., 2010). Zaproponowano, że ta stymulacja CEF przy słabym świetle wzmocniła syntezę ATP w celu szybkiej naprawy PSII (Huang et al., 2010). Konieczne jest jednak więcej dowodów w celu wyjaśnienia szczególnej roli stymulacji CEF przy słabym świetle po FOTOINHIBICJI PSII.
podczas CEF elektrony z NADPH lub ferredoksyny są cyklicznie przenoszone wokół PSI do puli plastochinonów. Ten transfer elektronów jest sprzężony z translokacją protonów i generuje gradient protonu przez błony tylakoidowe (ΔpH) (Shikanai i Yamamoto, 2017). Oprócz udziału w syntezie ATP, inną funkcją ΔpH jest obniżanie fotosyntetycznego transportu elektronów poprzez zakwaszanie światła tylakoidu (Shikanai, 2014, 2016). Ta regulacja obejmuje dwa różne mechanizmy: jeden jest związany z rozpraszaniem energii cieplnej i rozprasza nadmiar pochłoniętej energii świetlnej jako ciepło z anten PSII (Takahashi et al., 2009), a drugi jest w dół regulacji aktywności kompleksu Cyt b6/f i kontroluje szybkość transferu elektronów do PSI (Suorsa et al., 2012, 2016; Tikkanen i Aro, 2014). U angiosperms including Arabidopsis thaliana funkcjonują dwa szlaki cyklicznego transportu elektronów (Shikanai, 2007). Pierwszym szlakiem CEF jest szlak zależny od PGR5- / PGRL1 wrażliwy na antymycynę a (Munekage et al., 2002; Sugimoto et al., 2013), a drugi jest zależny od kompleksu dehydrogenazy chloroplastu NADH (NDH) (Burrows et al., 1998; Shikanai et al., 1998). Udział szlaku zależnego od PGR5/PGRL1 jest bardziej znaczący w roślinach C3. W dużym świetle aktywacja zależnego od PGR5/PGRL1 CEF indukuje zakwaszenie światła tylakoidu, a tym samym prowadzi do wysokiego poziomu współczynnika utleniania P700 (Suorsa et al., 2012, 2016; Kono et al., 2014; Yamori et al., 2016). Dla porównania, Współczynnik utleniania P700 przy słabym oświetleniu był w niewielkim stopniu dotknięty niedoborem zależnego od PGR5/PGRL1 CEF(Munekage et al., 2002, 2004; Kono et al., 2014). Przy umiarkowanej fotoinhibicji PSII stymulacji CEF przy słabym świetle towarzyszył wzrost dawki utleniania P700 (Huang et al., 2010). Nie jest jednak jasne, czy ten zwiększony współczynnik utleniania P700 jest spowodowany stymulacją CEF.
oprócz CEF, transfer elektronów z PSII (ETRII) odgrywa ważną rolę w wpływaniu na stan redoks PSI (Tikkanen et al., 2014; Huang et al., 2016a, c; Suorsa et al., 2016). W roślinach pgr5 A. thaliana, ciężka fotoinhibicja PSII może funkcjonować jako ostateczna kontrola fotosyntetycznego transferu elektronów, umożliwiając utrzymanie P700 optymalnie utlenionego pod nadmiarem światła (Tikkanen et al., 2014). Ostatnio, Suorsa et al. (2016) wskazał, że rośliny pgr5 wykazywały wysoki współczynnik utleniania P700 w wysokim świetle, gdy etrii został zmniejszony przez połączenie mutacji knockout w psbo1, PsbP2, PsbQ1, PsbQ2 i psbr loci. W schłodzonych liściach tytoniu, umiarkowana FOTOINHIBICJA PSII obniżyła przepływ elektronów do PSI, a następnie zwiększyła współczynnik utleniania P700 podczas dalszych zabiegów chłodzenia (Huang et al., 2016a). Ponadto, wywołana chłodzeniem fotoinhibicja PSII doprowadziła do obniżenia etrii, któremu towarzyszyło zwiększenie współczynnika utleniania P700 przy słabym świetle (Huang et al., 2010). Zakładamy, że współczynnik utleniania P700 przy słabym świetle jest kontrolowany głównie przez przepływ elektronów z PSII.
w naszym poprzednim raporcie zauważyliśmy, że cień zakład Panax notoginseng wykazały selektywną fotoinhibicję PSII pod wpływem stresu świetlnego. Po krótkotrwałym narażeniu na stres świetlny ETRII przy słabym oświetleniu znacznie się zmniejszył, ale CEF był znacznie stymulowany. Jednocześnie Współczynnik utleniania P700 znacznie wzrósł. Naszymi szczegółowymi celami było (1) zbadanie, czy stymulacja CEF przy słabym świetle głównie ułatwia syntezę ATP; i (2) określić, czy wzrost współczynnika utleniania P700 przy umiarkowanej fotoinhibicji PSII jest bardziej związany z ETRII niż stymulacją CEF lub zmianą pmf. Aby rozwiązać te pytania, nietknięte liście Panax notoginseng były traktowane w 2258 µmol fotonów m-2 s-1 przez 30 minut. Przed i po obróbce przy wysokim świetle oznaczono rozkład energii w PSII, stan redoks PSI i siłę napędową protonu (pmf) przy słabym świetle 54 µmol fotonów m-2 s-1.
materiały i metody
materiały roślinne i warunki wzrostu
w niniejszym badaniu do eksperymentów wykorzystano dwuletnie rośliny Panax notoginseng (Burkill) FH Chen ex C. Chow i wg Huang. Rośliny te były uprawiane w warunkach światła 10% nasłonecznienia (przy maksymalnym natężeniu światła w środku dnia około 200 µmol fotonów m-2 s-1). W przypadku tych roślin nie stwierdzono stresu związanego z wodą i odżywianiem. Do pomiarów fotosyntetycznych wykorzystano 9-tygodniowe w pełni rozszerzone liście.
pomiary PSI i PSII
Fotosystem I i parametry PSII były mierzone w temperaturze 25°C przez jednoczesne rejestrowanie przy użyciu podwójnego systemu pomiarowego Pam-100 (Heinz Walz GmbH, Effeltrich, Niemcy). Parametry fluorescencji chlorofilu obliczono w następujący sposób: Fv/Fm = (Fm – Fo)/Fm, Y(II) = (Fm’ – Fs)/Fm’ (Genty et al., 1989), NPQ = (Fm – Fm’)/Fm’. Fo i Fm są minimalną i maksymalną fluorescencją po ciemnej aklimatyzacji. Fs to przystosowana do światła fluorescencja w stanie stacjonarnym. Fo i Fm oznaczano po ciemnej aklimatyzacji przez 30 minut przed i po leczeniu wysokim światłem. Parametry fotosyntetyczne PSI zostały zmierzone za pomocą podwójnego PAM-100 na podstawie sygnału P700 (różnica intensywności światła pomiarowego modulowanego impulsem 830 i 875 nm docierającego do fotodetektora) (Klughammer i Schreiber, 2008). Sygnały P700+ (P) mogą się różnić między minimalnym (P700 w pełni zredukowany) a maksymalnym poziomem (P700 w pełni utleniony). Maksymalny poziom (Pm) oznaczono za pomocą impulsu nasycenia (600 ms i 10000 µmol fotonów m-2 s-1) po wstępnym oświetleniu światłem dalekiej czerwieni, a Pm wykorzystano do oszacowania aktywności PSI. Pm ’ oznaczono podobnie do Pm, ale ze światłem aktynicznym zamiast dalekiej Czerwieni. Wydajność kwantową PSI obliczono jako Y (i) = (Pm’- P)/Pm. Współczynnik utleniania P700 w danym świetle aktynowym obliczono jako Y (ND) = P/Pm. Wydajność kwantową NIEFOTOCHEMICZNEGO rozpraszania energii psi z powodu ograniczenia po stronie akceptora obliczono jako Y (NA) = (Pm – Pm’)/Pm. Wartości stanu stacjonarnego dla Y (II), NPQ, Y(I) I Y(ND) mierzono po aklimatyzacji światła przy słabym świetle przez 20 minut.
Fotosyntetyczny przepływ elektronów przez PSI i PSII obliczono jako: ETRII = Y (II) ×PPFD ×0,84 ×0,5 (Krall and Edwards, 1992), ETRI = Y (i) ×PPFD×0,84 ×0,5 (Yamori et al., 2011), gdzie przyjmuje się, że 0,5 jest proporcją pochłanianego światła docierającego do PSI lub PSII, a 0,84 przyjmuje się jako absorptancję (ułamek padającego światła pochłoniętego przez liście). Stopień aktywacji CEF oszacowano jako stosunek ETRI/ETRII (Yamori et al., 2011, 2015). Należy zauważyć, że podział wzbudzenia 1: 1 między PSI i PSII może nie być rzeczywisty, ponieważ rośliny cienia mają tendencję do zwiększania stosunku PSII/PSI (Lunde et al., 2003; Tikkanen et al., 2006; Grieco et al., 2012). Ponadto w tym badaniu parametry PSI i PSII były mierzone przy użyciu czerwonego światła aktynicznego (635 nm) dostarczonego przez Dual-PAM 100 (Walz, Niemcy). Ponieważ czerwone światło aktyniczne sprzyja wzbudzeniu PSII w porównaniu z PSI, rozkład energii wzbudzenia z LHCII do PSII i PSI może mieć wpływ na czerwone światło aktyniczne (Tikkanen et al., 2017).
Elektrochromowa Analiza przesunięć
sygnał ECS był monitorowany jako zmiana absorbancji przy 515 nm przy użyciu modułu Dual-Pam-100 (Walz, Effeltrich, Niemcy) wyposażonego w moduł emiter-detektor P515 / 535 (Walz). Sygnał ECS uzyskano po 20 minutach oświetlenia przy 54 µmol fotonów m-2 s-1, następnie zmierzono rozpad ECS przez wyłączenie światła aktynowego na 30 s. analizę kinetyki relaksacji ECS ciemnych interwałów (DIRKECS) przeprowadzono metodą Sackstedera i in. (2001) oraz Takizawa et al. (2008). Całkowity pmf oszacowano na podstawie całkowitej amplitudy szybkiego rozpadu sygnału ECS w ciągu 300 ms ciemnego interwału. Powolna relaksacja sygnału ECS umożliwiła rozpoznanie udziału gradientu protonu w błonach tylakoidów (ΔpH). Stała czasowa relaksacji ECS pierwszego rzędu (tECS)jest odwrotnie proporcjonalna do przewodności protonowej (gH+) błony tylakoidowej przez syntazę ATP (Sacksteder i Kramer, 2000; Cruz et al., 2005). W rezultacie GH+ oszacowano jako odwrotność stałej czasowej rozpadu .
zabiegi Fotoinhibicyjne
po ciemnej aklimatyzacji przez 30 minut zmierzono Fv/Fm i Pm w nienaruszonych liściach. Następnie te nienaruszone liście zostały zaadaptowane na światło przy 59 µmol fotonów m-2 s-1 przez 20 minut i zarejestrowano parametry fluorescencji chlorofilu, sygnał P700 i sygnał ECS. Następnie światło aktyniczne zostało zmienione na 2258 µmol fotonów m-2 s-1. Po ekspozycji na to wysokie światło przez 30 minut, światło aktyniczne natychmiast zmieniono na 59 µmol fotonów m-2 s-1, A parametry fotosyntetyczne zarejestrowano po aklimatyzacji światła przez 20 minut. Ostatecznie zmierzono Fv / Fm i Pm po ciemnej aklimatyzacji przez 30 min.
Analiza statystyczna
wyniki były wyświetlane jako średnie wartości pięciu niezależnych eksperymentów. Zastosowano niezależny test T na poziomie istotności α = 0,05 w celu ustalenia, czy istnieją znaczące różnice między różnymi metodami leczenia. Wszystkie analizy statystyczne przeprowadzono przy użyciu SPSS 16.0.
wyniki
podczas indukcji fotosyntetycznej przy 59 µmol fotonów m-2 s-1, ETRII stopniowo zwiększał się i osiągał stan równowagi po około 18 minutach (Fig. Dla porównania ETRI był stały w tej fazie indukcji (Fig. 1a). Po wystąpieniu tego słabego światła ETRI był znacznie wyższy niż ETRII. Jednak po 20-minutowej indukcji fotosyntetycznej ETRI był niższy niż ETRII. Wyniki te sugerowały aktywację CEF w początkowej fazie indukcji, zgodnie z wcześniejszymi badaniami (Joliot and Joliot, 2002, 2005; Makino et al., 2002). Po tej indukcji fotosyntetycznej przy słabym oświetleniu liście były oświetlane przy wysokim świetle 2258 µmol fotonów m-2 s-1 przez 30 min. Co ciekawe, ETRII stopniowo zmniejszał się podczas leczenia przy wysokim świetle (rycina 1B). W międzyczasie wartość ETRI była wyższa niż ETRII (rysunek 1B), co wskazuje na aktywację CEF w dużym świetle. Po tej obróbce przy wysokim oświetleniu maksymalny fotoutlenialny P700 (Pm) został utrzymany na stabilnym poziomie (Fig.2A). Dla porównania, maksymalna intensywność fluorescencji (Fm) zmniejszyła się o 40%, a maksymalna wydajność kwantowa PSII (Fv/Fm) zmniejszyła się z 0,80 do 0,65 (Fig.2b, C). Wyniki te wskazywały na selektywną fotoinhibicję PSII w liściach notoginseng Panax pod wpływem stresu świetlnego.
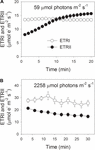
rysunek 1. Fotosyntetyczny przepływ elektronów przy słabym świetle (A) i wysokim świetle (B). (A) Ciemnoaklimatyzowane liście wystawiono na działanie światła o natężeniu 59 µmol fotonów m-2 s-1 przez 20 min. (B) po naświetleniu przy 59 µmol fotonów m-2 s-1 przez 20 min w celu aktywacji zlewu elektronów w fotosyntezie, liście wystawiono na działanie światła o natężeniu 2258 µmol fotonów m-2 s-1 przez 30 min. Wartości są średnie ± SE (n = 5).
przed zabiegiem przy wysokim świetle dojrzałe liście oświetlano przy słabym świetle 59 µmol fotonów m-2 s-1 przez 20 minut w celu aktywacji fotosyntezy, a następnie rejestrowano wartości ETRI, ETRII, Y(ND) i NPQ. Po leczeniu przy wysokim świetle przez 30 minut, wartości ETRI, ETRII, Y(ND) i NPQ zostały zarejestrowane po nowej fazie aklimatyzacji trwającej 20 minut do słabego światła. Przed obróbką światłem wartości dla ETRI i ETRII przy 59 µmol fotonów m-2 s-1 wynosiły odpowiednio 13,4 i 15,7 µmol elektronów m-2 s-1 (Fig. 3A, B). Po obróbce przy wysokim oświetleniu ETRI i ETRII przy słabym oświetleniu wynosiły odpowiednio 12,8 i 11,2 µmol elektronów m-2 s-1 (Fig. 3A, B). Wartość ETRII przy 59 µmol fotonów m-2 s-1 zmniejszyła się o około 30% po leczeniu fotoinhibicyjnym, co wskazuje na spadek ETRII przy umiarkowanej fotoinhibicji PSII. Przed obróbką światłem wartość stosunku ETRI/ETRII przy 59 µmol fotonów m-2 s-1 wynosiła 0,85 (Fig.3C). Po leczeniu fotoinhibicyjnym stosunek ETRI/ETRII znacznie wzrósł do 1,14 (rycina 3C). Wyniki te sugerowały stymulację CEF przy słabym świetle po FOTOINHIBICJI PSII(Yamori et al., 2011, 2015).
po obróbce przy dużym oświetleniu wartość stanu stacjonarnego y(I) przy 59 µmol fotonów m-2 s-1 nie uległa zmianie (ryc. 4a). Co ciekawe, Y (NA) znacznie zmniejszył się z 0,36 do 0,23(rysunek 4B), a y (ND) znacznie wzrósł z 0,1 do 0,25 (rysunek 4C). Wyniki te wskazywały na zmianę stanu redoks PSI przy słabym oświetleniu po leczeniu fotoinhibicyjnym. Tymczasem wartość NPQ nieznacznie się zmieniła (rysunek 4D). W rezultacie umiarkowana fotoinhibicja PSII miała różny wpływ na współczynnik utleniania P700 i NPQ przy słabym oświetleniu.
w celu wyjaśnienia, czy wzrost y(ND) jest spowodowany wzrostem pmf, sygnały przesunięcia elektrochromowego przy 54 µmol fotonów m-2 s-1 oznaczono po aklimatyzacji światła na 20 minut przed i po leczeniu przy wysokim świetle. Co ciekawe, całkowity pmf znacznie zmniejszył się o 18% po obróbce światłem (rysunek 5A), ale poziom ΔpH zmienił się nieznacznie (rysunek 5B). Ponieważ na powstawanie pmf może mieć wpływ przewodność protonowa tylakoidu, przewodność protonowa (gH+) błony tylakoidowej przy tym słabym świetle badano również przed i po leczeniu wysokim światłem. Wynik wykazał, że gH+ nie zmieniał się w przypadku leczenia przy wysokim oświetleniu (Fig.5C), co sugeruje, że leczenie przy wysokim oświetleniu prawie nie wpływa na aktywność syntazy chloroplastu ATP przy słabym oświetleniu. Ponieważ spadkowi ETRII o 30% towarzyszył spadek pmf o 18%, stymulacja CEF przy słabym oświetleniu częściowo skompensowała powstawanie pmf i ΔpH.

rysunek 5. Wartości całkowitej siły napędowej protonu (pmf) (a), gradientu protonu (ΔpH) przez błony tylakoidowe (B) i przewodności protonowej (GH+) błony tylakoidowej (C) przy słabym oświetleniu. Wszystkie parametry mierzono po adaptacji przy 54 µmol fotonów m-2 s-1 przez 20 min. Wartości są średnie ± SE (n = 5). Gwiazdka wskazuje na istotną (p< 0,05) zmianę po leczeniu światłem.
dyskusja
rola stymulacji CEF Przy Słabym Oświetleniu
wskazano, że CEF odgrywa ważną rolę w utrzymaniu fotosyntezy i wzrostu roślin (Yamori and Shikanai, 2016). W świetle reflektorów uważa się, że CEF jest obecnie niezbędny do zrównoważenia budżetu energetycznego ATP/NADPH, a także do ochrony PSI i PSII przed uszkodzeniem (Munekage et al., 2002, 2004; Takahashi et al., 2009; Suorsa et al., 2012, 2016; Walker et al., 2014; Huang et al., 2015a, 2017b). Przy słabym natężeniu światła CEF odgrywa ważną rolę w optymalizacji fotosyntetycznej asymilacji CO2 prawdopodobnie poprzez podaż dodatkowego ATP(Yamori et al., 2011, 2015; Nishikawa et al., 2012; Huang et al., 2015a). Główna rola CEF jest elastycznie modulowana w odpowiedzi na natężenie światła. W szczególności CEF przyczynia się głównie do zrównoważenia budżetu energetycznego ATP / NADPH w Warunkach sub-nasycających intensywności światła, ale głównie chroni aparaturę fotosyntetyczną przed fotoinhibicją pod wpływem nasycających intensywności światła poprzez zakwaszenie światła tylakoidów (Huang et al., 2015a). Co ciekawe, Huang et al. (2010) stwierdził, że CEF był znacząco stymulowany przy słabym świetle po wywołanej chłodzeniem fotoinhibicji PSII i wysunął hipotezę, że ta stymulacja CEF głównie zwiększyła syntezę ATP w celu szybkiej naprawy PSII. Potrzebne były jednak więcej dowodów na poparcie tej hipotezy. W niniejszym badaniu zaobserwowaliśmy, że wartość ETRI/ETRII przy słabym świetle znacznie wzrosła (rysunek 3C), wskazując na stymulację CEF wokół PSI (Huang et al.,2011, 2012, 2017a, b; Yamori et al., 2011, 2015). Jednocześnie Amplituda pmf zmniejszyła się znacząco, a ΔpH nieznacznie. Wyniki te wskazywały, że stymulacja CEF nie wywołała zależnej od ΔpH regulacji w dół fotosyntetycznego transportu elektronów. Innymi słowy, ta stymulacja CEF przy słabym oświetleniu głównie ułatwiała syntezę ATP.
chociaż leczenie wysokostopniowe nie miało wpływu na przewodnictwo protonowe syntazy chloroplastu ATP, mniejszy rozmiar pmf powodował spadek rzeczywistej szybkości syntezy ATP. Tempo naprawy PSII i fotosyntetycznej asymilacji CO2 przy słabym oświetleniu jest ograniczone głównie przez tempo syntezy ATP (Allakhverdiev et al., 2005; Yamori et al., 2011, 2015; Nishikawa et al., 2012). Ponieważ etrii znacznie zmniejszył się podczas FOTOINHIBICJI PSII, tempo syntezy ATP przez ETRII było znacznie zmniejszone. W celu zrównoważenia stosunku ATP / NADPH wymaganego przez pierwotny metabolizm i szybką naprawę PSII, potrzebny jest elastyczny mechanizm, aby zapewnić dodatkowy ATP. Pod tym warunkiem etrii zmniejszył się o 30%, ale całkowity pmf zmniejszył się tylko o 18%. Wyniki te wskazują, że stymulacja CEF skompensowała redukcję zależnego od ETRII tworzenia pmf, zwiększając syntezę ATP. Szybka naprawa FOTOUSZKODZONYCH PSII zależy od syntezy ATP (Allakhverdiev et al., 2005). Przyspieszenie CEF wokół PSI zwiększyło wewnątrzkomórkowe stężenie ATP, przyspieszając w ten sposób tempo naprawy PSII w Synechocystis (Allakhverdiev et al., 2005). Łącznie proponujemy, aby stymulacja CEF przy słabym oświetleniu odgrywała ważną rolę w szybkiej naprawie aktywności PSII poprzez dodatkową syntezę ATP.
Zmiana współczynnika utleniania P700 Przy Słabym Świetle nie jest związana z pmf
interesującym zjawiskiem jest to, że współczynnik utleniania P700 przy słabym świetle znacznie wzrósł przy umiarkowanej fotoinhibicji PSII (Huang et al., 2010), co również wykazano w niniejszym badaniu. W warunkach, w których pochłaniane światło przekracza wymagania dla fotosyntezy, zależne od CEF wytwarzanie ΔpH w dół reguluje aktywność złożonej aktywności Cyt b6 / f i kontroluje przepływ elektronów z PSII do PSI (Suorsa et al., 2012, 2016; Shikanai, 2014, 2016), optymalizacja stanu redoks P700 w PSI i minimalizacja produkcji ROS w PSI podczas fotosyntezy. W pgr5-roślinach A. thaliana P700 jest redukowany przez elektrony w świetle z powodu utraty wytwarzania pmf. Jednak w zmutowanym białku flawodiironowym pgr5 poziom pmf został również przywrócony do poziomu dzikiego typu, a zatem P700 został utleniony tak jak w dzikim typie (Yamamoto et al., 2016). W liniach mutacji pszenicy z niedoborem chlorofilu B, niewystarczający gradient protonów tylakoidów prowadzi do nadmiernej redukcji strony akceptora PSI, a tym samym fotoinhibicji PSI w wysokim świetle lub wysokiej temperaturze (Brestic et al., 2015, 2016). Ostatnio niektóre badania donosiły, że zwiększona aktywność syntazy chloroplastu ATP zaburzyła tworzenie pmf i spowodowała nadmierną redukcję fotosyntetycznego łańcucha transportu elektronów, powodując fotouszkodzenie PSI w dużym świetle i fluktuującym świetle(Kanazawa et al., 2017; Takagi et al., 2017). Raporty te wspierają kluczową rolę pmf w utrzymaniu P700 optymalnie utleniony pod nadmiarem energii świetlnej.
nasze obecne wyniki wykazały, że po obróbce w wysokim świetle przez 30 minut Całkowity pmf utworzony przy tym słabym świetle znacznie zmniejszył się, a tworzenie ΔpH zmieniło się nieznacznie (Fig.5A,B). Tymczasem współczynnik utleniania P700 znacznie wzrósł z 0,1 (przed leczeniem) do 0,25(po leczeniu) (Fig. Wyniki te silnie wskazują, że tego wzrostu współczynnika utleniania P700 nie można wytłumaczyć zmianą pmf, która w dużej mierze różni się od korelacji między y(ND) i pmf w wysokim świetle (Yamamoto et al., 2016; Takagi et al., 2017). W związku z tym regulujący wpływ pmf na współczynnik utleniania P700 jest minimalny przy słabym świetle, ale staje się szczególnie kluczowy w dużym świetle lub zmiennym świetle. W wysokim świetle, wysoka wartość Y (ND)zwykle towarzyszy wysokiej wartości NPQ (Munekage et al., 2002, 2004; Kono et al., 2014; Zivcak et al., 2015), Ze względu na wzrost pmf. Upośledzenie tworzenia ΔpH prowadzi do zmniejszenia poziomów Y (ND) i NPQ w dużym świetle (Suorsa et al., 2012; Kono et al., 2014; Yamamoto et al., 2016; Kanazawa et al., 2017). Indukcja NPQ przy słabym oświetleniu zależy głównie od poziomu zakwaszenia światła. Po obróbce przy wysokim oświetleniu stopień zakwaszenia prześwitu nie uległ zmianie (Fig. 5B), a NPQ pozostał stabilny (Fig.4D). Dla porównania, Y (ND) znacznie wzrosła. Wyniki te wskazują, że przy słabym oświetleniu, Y(ND) i NPQ były kontrolowane przez różne mechanizmy regulacyjne.
ETRII kontroluje Współczynnik utleniania P700 Przy Słabym Oświetleniu
psi ulega nadmiernej redukcji tylko wtedy, gdy przepływ elektronów z PSII przekracza zdolność akceptorów elektronów PSI do radzenia sobie z elektronami. Gdy przepływ elektronów do PSI jest ograniczony, PSI jest wyjątkowo odporny na naprężenia lekkie w roślinach pgr5 A. thaliana (Suorsa et al., 2012, 2016; Tikkanen et al., 2014). W przypadku rośliny tworzącej Cień Psychotria rubra aktywność PSI była niewrażliwa na stres świetlny w obecności DCMU (Huang et al., 2016c). W schłodzonych liściach tytoniu umiarkowana fotoinhibicja PSII pozwoliła na utrzymanie optymalnie utlenionego P700, a następnie chroniła aktywność PSI przed dalszym fotouszkodzeniem (Huang et al., 2016a). Wyniki te wskazywały na ważną rolę ETRII w kontrolowaniu stanu redoks PSI w warunkach wysokich naprężeń świetlnych lub chłodniczych. Nasze obecne wyniki wykazały, że umiarkowana fotoinhibicja PSII doprowadziła do znacznego obniżenia etrii przy słabym świetle. W międzyczasie aktywność PSI i aktywność syntazy chloroplastu ATP nieznacznie się zmieniły, a całkowite pmf i ΔpH nie wzrosły. W rezultacie zmniejszenie etrii nie było spowodowane zależną od ΔpH kontrolą fotosyntetyczną za pomocą kompleksu Cyt b6 / f, ale prawdopodobnie było spowodowane zmniejszeniem aktywności PSII (Tikkanen et al., 2014). Zmniejszona podaż elektronów z PSII do PSI doprowadziła do wzrostu poziomu utleniania P700. Tak więc współczynnik utleniania P700 przy słabym świetle był w dużej mierze kontrolowany przez ETRII.
wniosek
odkryliśmy, że selektywna fotoinhibicja PSII wywołała stymulację CEF i wzrost współczynnika utleniania P700 przy słabym świetle. Stymulacja CEF nie wywołała zależnej od ΔpH regulacji w dół fotosyntetycznego transportu elektronów. W rezultacie stymulacja CEF przy słabym świetle ułatwiła głównie syntezę ATP, która jest niezbędna do szybkiej naprawy FOTOUSZKODZONYCH PSII. Wzrost współczynnika utleniania P700 nie mógł być wyjaśniony zmianą zależnej od ΔpH kontroli fotosyntetycznej w kompleksie Cyt b6 / f, ale był spowodowany głównie zmniejszonym zapasem elektronów z PSII do PSI.
WH, S-BZ I TL WH i Y-JY przeprowadzili eksperymenty. WH, Y-JY, S-BZ I TL analizowały dane. WH napisał pierwszy szkic rękopisu, który był intensywnie edytowany przez wszystkich autorów.
finansowanie
to badanie było wspierane przez National Natural Science Foundation Of China (31670343), Youth Innovation Promotion Association Chińskiej Akademii Nauk (2016347) oraz główne programy nauki i Techniki w prowincji Yunnan (2016zf001).
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Kono, M., Noguchi, K., and Terashima, I. (2014). Rola cyklicznego przepływu elektronów wokół PSI (CEF-PSI) i alternatywnych szlaków zależnych od O2 w regulacji przepływu elektronów fotosyntetycznych w krótkotrwałym świetle fluktuacyjnym u Arabidopsis thaliana. Plant Cell Physiol. 55, 990–1004. doi: 10.1093/pcp/pcu033
PubMed Abstract | CrossRef Full Text/Google Scholar
Sieć regulacyjna siły napędowej protonu: udział cyklicznego transportu elektronów wokół fotosystemu I. Fotosynt. Res. 129, 253-260. doi: 10.1007 / s11120-016-0227-0
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Yamori, W., Makino, A., and Shikanai, T. (2016). Fizjologiczna rola cyklicznego transportu elektronów wokół fotosystemu I w podtrzymywaniu fotosyntezy pod wpływem zmiennego światła w ryżu. Sci. 6:20147. doi: 10.1038/srep20147
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Yamori, W., and Shikanai, T. (2016). Fizjologiczne funkcje cyklicznego transportu elektronów wokół fotosystemu I w podtrzymywaniu fotosyntezy i wzrostu roślin. Annu. Rev. Plant Biol. 67, 81–106. doi: 10.1146/annurev-arplant-043015-112002
PubMed Streszczenie | CrossRef Pełny tekst/Google Scholar
Yamori, W., Shikanai, T., and Makino, A. (2015). Fotosystem i cykliczny przepływ elektronów przez kompleks podobny do dehydrogenazy chloroplastu nadh pełni fizjologiczną rolę w fotosyntezie przy słabym oświetleniu. Sci. / Align = „left” / 13908 doi: 10.1038/srep13908
PubMed Abstract | CrossRef Full Text/Google Scholar
Fotoinhibicja fotosystemu I w temperaturze schładzania i późniejsze odzyskiwanie u Arabidopsis thaliana. Plant Cell Physiol. 45, 1595–1602. doi: 10.1093/pcp/pch180
PubMed Abstract | CrossRef Full Text | Google Scholar