postać dawkowania: wstrzyknięcie
Drugs.com. Ostatnia aktualizacja Dec 22, 2020.
- skutki uboczne
- dawkowanie
- profesjonalne
- interakcje
- ciąża
- Więcej
tylko Rx.
jałowy roztwór dożylny
- Inamrinone opis
- Inamrinon – Farmakologia kliniczna
- farmakokinetyka
- Farmakodynamika
- wskazania i zastosowanie inamrinonu
- przeciwwskazania
- Ostrzeżenia
- środki ostrożności
- ogólne
- badania laboratoryjne
- interakcje między lekami
- interakcje chemiczne
- Karcynogeneza, mutageneza, upośledzenie płodności
- ciąża
- matki karmiące
- stosowanie u dzieci
- działania niepożądane
- Postępowanie w przypadku działań niepożądanych
- przedawkowanie
- Inamrinone Dawkowanie i sposób podawania
- interakcje chemiczne
- jak jest dostarczany Inamrinone
- VIAL LABEL
- More about inamrinone
- Related treatment guides
Inamrinone opis
INAMRINONE injection USP reprezentuje nową klasę kardiologicznych środków inotropowych różniących się od glikozydów naparstnicy lub katecholamin. Mleczan inamrynonu jest oznaczany chemicznie jako 2-hydroksypropanian 5-Amino-6(1H)-ONU i ma następującą strukturę:
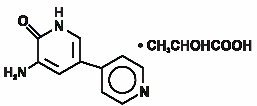
Inamrinon jest jasnożółtym krystalicznym związkiem o masie cząsteczkowej 187,20 i wzorze cząsteczkowym C10H9N3O. każdy mol kwasu mlekowego ma masę cząsteczkową 90,08 i wzór empiryczny C3H6O3. Rozpuszczalność Inamrinonu przy pH 4,1, 6,0 i 8,0 wynosi odpowiednio 25, 0,9 i 0,7 mg/mL.
inamrinone injection jest przezroczystym żółtym jałowym roztworem dostępnym w 20 mL fiolkach do podawania dożylnego. Każdy mL zawiera mleczan Inamrinonu, co odpowiada 5 mg inamrinonu i 0,25 mg metabisiarczynu sodu dodanego jako środek konserwujący w wodzie do wstrzykiwań. Wszystkie dawki podane w ulotce dla pacjenta są wyrażone w kategoriach Zasady, Inamrinonu. Kwas mlekowy lub wodorotlenek sodu reguluje pH w zakresie od 3,2 do 4,0. Całkowite stężenie kwasu mlekowego może wahać się od 5 mg do 7,5 mg.
Inamrinon – Farmakologia kliniczna
Inamrinon jest dodatnim środkiem inotropowym o działaniu rozszerzającym naczynia krwionośne, różniącym się strukturą i sposobem działania zarówno glikozydów naparstnicy, jak i katecholamin.
mechanizm działania inotropowego i rozszerzającego naczynia krwionośne nie został w pełni wyjaśniony.
w odniesieniu do jego działania inotropowego, eksperymentalne dowody wskazują, że nie jest on agonistą beta-adrenergicznym. Hamuje aktywność fosfodiesterazy cyklicznego adenozynomonofosforanu (C-AMP) mięśnia sercowego i zwiększa poziom komórkowy c-AMP. W przeciwieństwie do naparstnicy nie hamuje aktywności adenozynotrifosfatazy sodowo-potasowej.
w odniesieniu do działania rozszerzającego naczynia krwionośne, Inamrinon zmniejsza obciążenie wtórne i wstępne dzięki bezpośredniemu działaniu zwiotczającemu na mięśnie gładkie naczyń.
farmakokinetyka
po dożylnym bolusie (1 do 2 minut) wstrzyknięciu 0, 68 mg/kg mc.do 1, 2 mg/kg mc. normalnym ochotnikom objętość dystrybucji Inamrinonu wynosiła 1, 2 litra/kg mc., a po okresie półtrwania fazy dystrybucji wynoszącym około 4, 6 minut w osoczu, średni pozorny okres półtrwania w końcowej fazie eliminacji pierwszego rzędu wynosił około 3, 6 godzin. U pacjentów z zastoinową niewydolnością serca otrzymujących infuzje Inamrinonu średni pozorny okres półtrwania w końcowej fazie eliminacji pierwszego rzędu wynosił około 5, 8 godziny.
w jednym badaniu wykazano, że Inamrynon wiąże się w 10% do 22% z białkami osocza ludzkiego w drodze ultrafiltracji in vitro, a w innym badaniu w 35% do 49% w drodze ultrafiltracji lub dializy równowagowej.
główną drogą wydalania u człowieka jest wydalanie z moczem zarówno Inamrynonu, jak i kilku metabolitów (N-glikolilu, N-octanu, o-glukuronidu i N-glukuronidu). U zdrowych ochotników około 63% doustnej dawki Inamrynonu znakowanego izotopem 14C zostało wydalone z moczem w ciągu 96 godzin. W ciągu pierwszych 8 godzin 51% radioaktywności w moczu stanowiło Inamrinon z 5% w postaci N-octanu, 8% w postaci N-glikolanu i mniej niż 5% W przypadku każdego glukuronidu. Około 18% podanej dawki było wydalane z kałem w ciągu 72 godzin.
w 24-godzinnym, nieradioaktywnym badaniu dożylnym, 10% do 40% dawki było wydalane z moczem w postaci niezmienionej Inamrinonu, a metabolit N-acetylowy stanowił mniej niż 2% dawki.
u pacjentów z zastoinową niewydolnością serca, po podaniu dawki nasycającej w bolusie, stężenie w osoczu w stanie stacjonarnym wynoszące około 2, 4 µg/mL było możliwe do utrzymania przez wlew 5 µg/kg mc./min do 10 µg/kg mc./min. U niektórych pacjentów z zastoinową niewydolnością serca, z towarzyszącym zaburzeniem przepływu przez nerki i wątrobę, możliwe jest zwiększenie stężenia Inamrinonu w osoczu w okresie infuzji; dlatego u tych pacjentów może być konieczne monitorowanie odpowiedzi hemodynamicznej i (lub) stężenia leku. Główne miary odpowiedzi pacjenta obejmują indeks serca, ciśnienie klinowe naczyń włosowatych w płucach, centralne ciśnienie żylne i ich związek ze stężeniami w osoczu. Dodatkowo, pomiary ciśnienia krwi, wyjście moczu, i masy ciała może okazać się przydatne, podobnie jak takie objawy kliniczne jak ortopnea, duszność, i zmęczenie.
Farmakodynamika
u pacjentów z obniżoną czynnością mięśnia sercowego Inamrinon powoduje szybkie zwiększenie pojemności minutowej serca ze względu na jego działanie inotropowe i rozszerzające naczynia krwionośne.
Po podaniu dożylnym inamrinonu w bolusie w dawce 0.75 mg/kg mc.do 3 mg/kg mc. u pacjentów z zastoinową niewydolnością serca występuje zależne od dawki maksymalne zwiększenie pojemności minutowej serca (o około 28% przy dawce 0, 75 mg/kg mc. do około 61% przy dawce 3 mg / kg mc.). Maksymalne działanie występuje w ciągu 10 minut przy wszystkich dawkach. Czas trwania działania zależy od dawki i wynosi około 1/2 godziny przy dawce 0, 75 mg / kg mc.i około 2 godziny przy dawce 3 mg/kg mc.
w tym samym zakresie dawek, ciśnienie klinowe naczyń włosowatych w płucach i całkowity opór obwodowy wykazują zależne od dawki zmniejszenie (średnie maksymalne zmniejszenie o 29% ciśnienia klinowego naczyń włosowatych w płucach i 29% ogólnoustrojowego oporu naczyniowego). Po podaniu dawek do 3 mg / kg mc.obserwowano zależne od dawki obniżenie ciśnienia rozkurczowego (do 13%). Średnie ciśnienie tętnicze zmniejsza się (9,7%) po dawce 3 mg/kg mc. Tętno na ogół nie zmienia się.
zmiany parametrów hemodynamicznych utrzymują się podczas ciągłego wlewu dożylnego, a następnie przez kilka godzin.
Inamrinon jest skuteczny u pacjentów w pełni zdigitalizowanych bez powodowania objawów toksyczności glikozydów nasercowych. Jego działanie inotropowe jest addytywne do działania naparstnicy. W przypadku trzepotania/migotania przedsionków, możliwe jest, że Inamrinon może zwiększyć wskaźnik odpowiedzi komór z powodu niewielkiego wzmocnienia przewodnictwa A/V. W takich przypadkach zaleca się wcześniejsze leczenie naparstnicą.
obserwowano poprawę czynności lewej komory serca i złagodzenie zastoinowej niewydolności serca u pacjentów z chorobą niedokrwienną serca. Poprawa wystąpiła bez wywoływania objawów lub objawów elektrokardiograficznych niedokrwienia mięśnia sercowego.
przy stałej częstości akcji serca i ciśnieniu krwi, zwiększenie pojemności minutowej serca występuje bez mierzalnego wzrostu zużycia tlenu w mięśniu sercowym lub zmian różnicy tlenu w żyłach tętniczych.
aktywność Inotropowa jest utrzymywana po wielokrotnych dawkach dożylnych Inamrinonu. Podawanie inamrinonu powoduje korzyści hemodynamiczne i objawowe u pacjentów, u których nie uzyskano zadowalającej kontroli przez konwencjonalne leczenie lekami moczopędnymi i glikozydami nasercowymi.
wskazania i zastosowanie inamrinonu
inamrinone injection służy do krótkotrwałego leczenia zastoinowej niewydolności serca. Ze względu na ograniczone doświadczenie i możliwość wystąpienia ciężkich działań niepożądanych (patrz działania niepożądane), Inamrinon należy stosować wyłącznie u pacjentów, których można ściśle monitorować i u których nie wystąpiła odpowiednia odpowiedź na naparstnicę, leki moczopędne i (lub) leki rozszerzające naczynia krwionośne. Doświadczenie z dożylnym podawaniem Inamrinonu w kontrolowanych badaniach nie przekracza 48 godzin powtarzanych bolusów i (lub) ciągłych infuzji.
niezależnie od tego, czy podawany jest doustnie, w sposób ciągły dożylnie, czy sporadycznie dożylnie, ani Inamrinon, ani żaden inny inotropowy zależny od cyklicznego AMP nie został wykazany w kontrolowanych badaniach jako Bezpieczny lub skuteczny w długotrwałym leczeniu zastoinowej niewydolności serca. W kontrolowanych badaniach przewlekłej terapii doustnej różnymi takimi środkami (w tym Inamrinonem) objawy nie były konsekwentnie łagodzone, a inotropy zależne od cyklicznego AMP były konsekwentnie związane ze zwiększonym ryzykiem hospitalizacji i śmierci. Pacjenci z objawami IV klasy NYHA byli narażeni na szczególne ryzyko.
przeciwwskazania
inamrynon jest przeciwwskazany u pacjentów z nadwrażliwością na niego.
jest również przeciwwskazany u pacjentów, u których stwierdzono nadwrażliwość na wodorosiarczany.
Ostrzeżenia
zawiera metabisiarczyn sodu, siarczyn, który może powodować reakcje typu alergicznego, w tym objawy anafilaktyczne i zagrażające życiu lub mniej ciężkie epizody astmy u niektórych wrażliwych osób. Ogólna częstość występowania wrażliwości na siarczyny w populacji ogólnej jest nieznana i prawdopodobnie niska. Wrażliwość na siarczyny występuje częściej u astmatyków niż u osób nieastmatycznych.
środki ostrożności
ogólne
Inamrynonu nie należy stosować u pacjentów z ciężką chorobą zastawek aorty lub pulmoniczną zamiast chirurgicznego usunięcia niedrożności. Podobnie jak inne środki inotropowe, może pogorszyć niedrożność dróg odpływowych w hipertroficznym zwężeniu subaortalnym.
podczas dożylnego leczenia Inamrinonem należy monitorować ciśnienie krwi i częstość akcji serca, a szybkość infuzji spowolnić lub zatrzymać u pacjentów z nadmiernym spadkiem ciśnienia krwi.
u pacjentów, którzy otrzymywali intensywne leczenie moczopędne, może wystąpić niewystarczające ciśnienie napełniania serca, aby odpowiednio zareagować na Inamrinon, w którym to przypadku może być wskazana ostrożna liberalizacja spożycia płynów i elektrolitów.
arytmie nadkomorowe i komorowe obserwowano w leczonej populacji bardzo wysokiego ryzyka. Podczas gdy nie wykazano, że Inamrinon per se Ma działanie arytmogenne, potencjał arytmii, obecny w samej zastoinowej niewydolności serca, może być zwiększony przez jakikolwiek lek lub kombinację leków.
obserwowano trombocytopenię i hepatotoksyczność (patrz działania niepożądane).
stosowanie w ostrym zawale mięśnia sercowego
nie przeprowadzono badań klinicznych u pacjentów w ostrej fazie po zawale mięśnia sercowego. Dlatego w takich przypadkach nie zaleca się stosowania Inamrinonu.
badania laboratoryjne
zmiany w płynach i elektrolitach
zmiany w płynach i elektrolitach oraz czynność nerek powinny być dokładnie monitorowane podczas leczenia Inamrinonem. Poprawa pojemności minutowej serca w wyniku wywołanej diurezy może wymagać zmniejszenia dawki leku moczopędnego. Utrata potasu spowodowana nadmierną diurezą może predysponować do wystąpienia zaburzeń rytmu serca u pacjentów zdigitalizowanych. Dlatego hipokaliemię należy skorygować suplementacją potasu przed lub w trakcie stosowania Inamrinonu.
interakcje między lekami
w stosunkowo ograniczonym doświadczeniu nie zaobserwowano żadnych niepożądanych objawów klinicznych u pacjentów, u których Inamrinon był stosowany jednocześnie z następującymi lekami: glikozydy naparstnicy; lidokaina, chinidyna; metoprolol, propranolol; hydralazyna, prazosyna; diazotan izosorbidu, nitrogliceryna; chlortalidon, kwas etakrynowy, furosemid, hydrochlorotiazyd, spironolakton, kaptopryl, heparyna, warfaryna, suplementy potasu, insulina, diazepam.
zgłoszono jeden przypadek nadmiernego niedociśnienia, gdy Inamrinon był stosowany jednocześnie z dizopyramidem.
do czasu uzyskania dodatkowych informacji należy zachować ostrożność podczas jednoczesnego podawania z dizopyramidem.
interakcje chemiczne
interakcja chemiczna zachodzi powoli przez okres 24 godzin, gdy dożylny roztwór Inamrinonu miesza się bezpośrednio z roztworami zawierającymi dekstrozę (glukozę). Dlatego przed wstrzyknięciem Inamrinonu nie należy rozcieńczać roztworami zawierającymi dekstrozę (glukozę).
natychmiast zachodzi interakcja chemiczna, o czym świadczy tworzenie się osadu, gdy furosemid jest wstrzykiwany do linii dożylnej wlewu Inamrinonu. Dlatego furosemid nie powinien być podawany dożylnie zawierającym Inamrinon.
Karcynogeneza, mutageneza, upośledzenie płodności
nie stwierdzono możliwości działania rakotwórczego Inamrinonu podawanego doustnie przez okres do dwóch lat szczurom i myszom w dawkach do maksymalnej tolerowanej dawki 80 mg/kg mc./dobę.
pozytywny wynik testu mikrojąderkowego na myszach (przy 7, 5 do 10-krotności maksymalnej dawki stosowanej u ludzi) i testu aberracji chromosomowej jajnika chomika chińskiego wykazał zarówno potencjał klastogenny, jak i zahamowanie liczby polichromatycznych erytrocytów. Jednakże Test Amesa na salmonellę, badanie na chłoniaku myszy i hodowlana analiza metafazy ludzkich limfocytów były negatywne. Działanie klastogenne jest sprzeczne z negatywnymi wynikami uzyskanymi w badaniach płodności samców i samic szczurów oraz w badaniu trzech generacji u szczurów, w obu przypadkach po podaniu doustnym.
w tych badaniach obserwowano nieznaczne wydłużenie okresu ciąży u szczurów po podaniu dawek 50 mg/kg mc./dobę i 100 mg/kg mc./dobę. Dystocja wystąpiła u matek otrzymujących 100 mg / kg mc. / dobę, co skutkowało zwiększeniem liczby martwych urodzeń, zmniejszeniem wielkości miotu i słabym przeżywaniem szczeniąt.
ciąża
działanie teratogenne – ciąża Kategoria C
u królików białych z Nowej Zelandii wykazano, że Inamrinon wywołuje wady szkieletowe płodu i poważne wady zewnętrzne w dawkach doustnych 16 mg/kg i 50 mg / kg, które były toksyczne dla królików. Badania na francuskich królikach Hy/Cr z zastosowaniem doustnych dawek do 32 mg / kg mc. / dobę nie potwierdziły tego odkrycia. Nie obserwowano wad rozwojowych u szczurów otrzymujących Inamrinon dożylnie w maksymalnej stosowanej dawce 15 mg/kg mc. / dobę (w przybliżeniu zalecana dobowa dawka dożylna u pacjentów z zastoinową niewydolnością serca). Nie przeprowadzono odpowiednich i dobrze kontrolowanych badań u kobiet w ciąży. Inamrinon można stosować w okresie ciąży tylko wtedy, gdy potencjalne korzyści przeważają nad potencjalnym ryzykiem dla płodu.
matki karmiące
należy zachować ostrożność podczas podawania Inamrinonu kobietom karmiącym, ponieważ nie wiadomo, czy jest on wydzielany z mlekiem kobiecym.
stosowanie u dzieci
Bezpieczeństwo i skuteczność stosowania u dzieci nie zostały ustalone.
działania niepożądane
trombocytopenia: Dożylne wstrzyknięcie Inamrinonu spowodowało zmniejszenie liczby płytek krwi poniżej 100 000 / mm3 lub prawidłowych wartości granicznych u 2,4% pacjentów.
występuje częściej u pacjentów poddawanych długotrwałemu leczeniu. Do tej pory, w ściśle monitorowanych badaniach klinicznych, u pacjentów, u których liczba płytek krwi nie mogła pozostać przygnębiona, nie obserwowano objawów krwawienia.
zmniejszenie liczby płytek krwi jest zależne od dawki i pojawia się z powodu skrócenia czasu przeżycia płytek krwi. U kilku pacjentów, u których wystąpiła małopłytkowość podczas przyjmowania Inamrinonu, badania szpiku kostnego były prawidłowe. Nie ma dowodów na związek zmniejszenia liczby płytek krwi z odpowiedzią immunologiczną lub czynnikiem aktywującym płytki krwi.
działania ze strony przewodu pokarmowego: działania niepożądane ze strony przewodu pokarmowego zgłaszane podczas stosowania klinicznego inamrinonu obejmowały nudności (1,7%), wymioty (0,9%), ból brzucha (0,4%) i jadłowstręt (0,4%).
wpływ na układ sercowo-naczyniowy: działania niepożądane ze strony układu sercowo-naczyniowego zgłaszane podczas stosowania Inamrinonu obejmują arytmię (3%) i niedociśnienie tętnicze (1,3%).
toksyczność wątrobowa: U psów, w dawkach dożylnych od 9 mg/kg mc./dobę do 32 mg/kg mc. / dobę, inamrinon wykazywał zależną od dawki hepatotoksyczność objawiającą się zwiększeniem aktywności enzymów lub martwicą komórek wątroby lub obydwoma czynnikami. U ludzi po długotrwałym podaniu doustnym obserwowano hepatotoksyczność i w ograniczonym doświadczeniu (0,2%) obserwowano ją po dożylnym podaniu Inamrinonu. Odnotowano również rzadkie przypadki zwiększenia aktywności enzymów i stężenia bilirubiny oraz żółtaczki.
nadwrażliwość: zgłaszano kilka widocznych reakcji nadwrażliwości u pacjentów leczonych doustnym Inamrinonem przez około dwa tygodnie. Objawy przedmiotowe i podmiotowe były zmienne, ale obejmowały zapalenie osierdzia, zapalenie opłucnej i wodobrzusze (1 przypadek), zapalenie mięśni z śródmiąższowym zacienieniem na zdjęciu rentgenowskim klatki piersiowej i zwiększoną szybkość sedymentacji (1 przypadek) oraz zapalenie naczyń z guzkowymi gęstościami płuc, hipoksemią i żółtaczką (1 przypadek). Pierwszy pacjent zmarł, niekoniecznie z powodu możliwej reakcji, podczas gdy dwa ostatnie ustępowały po przerwaniu leczenia. Żaden z przypadków nie został ponownie rozpatrzony, więc przypisanie Inamrinonu nie jest pewne, ale należy rozważyć możliwość wystąpienia reakcji nadwrażliwości u każdego pacjenta, u którego przez dłuższy czas stosowano Inamrinon.
ogólne: dodatkowe działania niepożądane obserwowane w badaniach klinicznych Inamrinonu podawanego dożylnie obejmują gorączkę (0,9%), ból w klatce piersiowej (0,2%) i pieczenie w miejscu wstrzyknięcia (0,2%).
Postępowanie w przypadku działań niepożądanych
zmniejszenie liczby płytek krwi: Bezobjawowe zmniejszenie liczby płytek krwi (do <150 000/mm3) może zostać cofnięte w ciągu jednego tygodnia od zmniejszenia dawki leku. Ponadto, bez zmiany dawkowania leku, liczba może ustabilizować się na poziomie niższym niż przedlekowe bez żadnych następstw klinicznych. Zaleca się, aby przedlekowa liczba płytek krwi i częsta liczba płytek krwi podczas leczenia były pomocne w podejmowaniu decyzji dotyczących modyfikacji dawkowania.
W przypadku wystąpienia liczby płytek krwi mniejszej niż 150 000 / mm3, można rozważyć następujące działania:
• utrzymać całkowitą dawkę dobową bez zmian, ponieważ w niektórych przypadkach liczba pacjentów ustabilizowała się lub powróciła do poziomu obróbki wstępnej. * Zmniejszyć całkowitą dawkę dobową. * Przerwać stosowanie Inamrinonu, jeśli w ocenie klinicznej lekarza ryzyko przekracza potencjalne korzyści.
działania niepożądane ze strony przewodu pokarmowego: podczas gdy działania niepożądane ze strony przewodu pokarmowego obserwowano rzadko podczas leczenia dożylnego, w przypadku wystąpienia ciężkich lub wyniszczających, lekarz może chcieć zmniejszyć dawkę lub przerwać stosowanie leku w oparciu o zwykłe względy korzyści do ryzyka.
toksyczność wątrobowa: W dotychczasowym doświadczeniu klinicznym dotyczącym podawania dożylnego rzadko obserwowano hepatotoksyczność. W przypadku wystąpienia ostrych, wyraźnych zmian aktywności enzymów wątrobowych wraz z objawami klinicznymi sugerującymi idiosynkratyczną reakcję nadwrażliwości, należy natychmiast przerwać leczenie Inamrinonem.
Jeśli występują mniejsze niż zaznaczone zmiany enzymów bez objawów klinicznych, te niespecyficzne zmiany powinny być oceniane indywidualnie. Klinicysta może chcieć kontynuować Inamrinone, zmniejszyć dawkę lub przerwać lek w oparciu o zwykłe względy korzyści / ryzyka.
przedawkowanie
donoszono o zgonie po masowym przypadkowym przedawkowaniu (840 mg w ciągu trzech godzin w początkowym bolusie i infuzji) Inamrinonu, chociaż związek przyczynowy jest niepewny. Podczas przygotowywania i podawania produktu należy dołożyć należytej staranności.
dawki Inamrinonu mogą powodować niedociśnienie z powodu działania rozszerzającego naczynia krwionośne. W takim przypadku należy zmniejszyć lub przerwać podawanie Inamrinonu. Nie jest znane specyficzne antidotum,ale należy podjąć ogólne środki wspomagające krążenie.
u szczurów LD50 Inamrynonu w postaci soli mleczanowej wynosił 102 mg/kg mc.lub 130 mg/kg mc. dożylnie w dwóch różnych badaniach i 132 mg/kg mc. doustnie (dokastrycznie); w postaci zawiesiny w wodnym tragakancie dziąseł LD50 wynosił 239 mg/kg mc.
Inamrinone Dawkowanie i sposób podawania
nasycające dawki inamrinonu należy podawać w postaci dostarczonej (nierozcieńczonej). Infuzje Inamrinonu można podawać w normalnym lub w połowie normalnym roztworze soli fizjologicznej o stężeniu od 1 mg / mL do 3 mg / mL. Rozcieńczone roztwory należy zużyć w ciągu 24 godzin.
inamrinon iniekcja może być podawana do bieżących wlewów dekstrozy (glukozy) przez złączkę Y lub bezpośrednio do rurki, gdzie jest to preferowane.
interakcje chemiczne
interakcja chemiczna zachodzi powoli przez okres 24 godzin, gdy dożylny roztwór Inamrinonu miesza się bezpośrednio z roztworami zawierającymi dekstrozę (glukozę). Dlatego przed wstrzyknięciem Inamrinonu nie należy rozcieńczać roztworami zawierającymi dekstrozę (glukozę).
natychmiast zachodzi interakcja chemiczna, o czym świadczy tworzenie się osadu, gdy furosemid jest wstrzykiwany do linii dożylnej wlewu Inamrinonu. Dlatego furosemid nie powinien być podawany dożylnie zawierającym Inamrinon.
zalecana jest następująca procedura podawania inamrinonu we wstrzyknięciu:
1. Rozpocząć leczenie od dawki nasycającej 0,75 mg/kg mc. podawanej powoli przez 2 do 3 minut.
|
LOADING DOSE DETERMINATION 0.75 mg/kg (undiluted) |
||||||||||
|
Patient Weight in kg |
||||||||||
|
mL of undiluted Inamrinone Injection |
||||||||||
2. Continue therapy with a maintenance infusion between 5 mcg/kg/min and 10 mcg/kg/min.
3. Based on clinical response, an additional loading dose of 0.75 mg/kg may be given 30 minutes after the initiation of therapy.
4. Szybkość wlewu wynosi zwykle od 5 µg/kg mc./min do 10 µg/kg mc./min, tak że zalecana całkowita dawka dobowa (w tym dawki nasycające) nie przekracza 10 mg/kg mc. Ograniczona liczba pacjentów otrzymujących większe dawki potwierdza stosowanie schematu dawkowania do 18 mg / kg mc. / dobę przez skrócony czas trwania leczenia.
w celu zapewnienia poprawności obliczeń można zastosować następującą tabelę szybkości infuzji.
aby skorzystać z wykresu, stężenie roztworu do infuzji Inamrinonu musi wynosić 2,5 mg/mL (2500 µg/mL). Stężenie to wytwarza się przez zmieszanie roztworu Inamrinonu z równą objętością rozcieńczalnika (normalny lub pół normalny roztwór soli fizjologicznej).
| * rozcieńczanie: w celu przygotowania stężenia 2,5 mg / mL zalecanego do infuzji należy wymieszać Inamrinon z równą objętością rozcieńczalnika. Na przykład zmieszać trzy fiolki 20 mL Inamrinonu (3 x 20 mL = 60 mL) z 60 mL rozcieńczalnika, aby uzyskać całkowitą objętość 120 mL końcowego roztworu Inamrinonu o stężeniu 2,5 mg/mL. | ||||||||||
|
Inamrinone IV INFUSION RATE (mL/hr) CHART Using 2.5 mg/mL Infusion Concentration* |
||||||||||
|
Patient Weight in kg |
||||||||||
|
Dosage: 5.0 mcg/kg/min |
||||||||||
|
7.5 mcg/kg/min |
||||||||||
|
10.0 mcg/kg/min |
||||||||||
Example: A 70 kg patient would require a loading dose of 10.5 mL of undiluted Inamrinone. If the physician selects a dose of 7.5 µg / kg mc. / min w przypadku infuzji szybkość przepływu wynosiłaby 13 mL / h przy stężeniu Inamrinonu 2,5 mg/mL.
5. Szybkość podawania i czas trwania leczenia należy dostosować w zależności od odpowiedzi pacjenta na leczenie. Lekarz może zalecić zmniejszenie lub zwiększenie dawki wlewu w zależności od odpowiedzi klinicznej lub działań niepożądanych.
w powyższych schematach dawkowania można oczekiwać, że stężenie Inamrinonu w osoczu większości pacjentów wyniesie około 3 µg / mL. Zwiększenie wskaźnika serca wykazuje liniową zależność od stężenia w osoczu w zakresie 0.5 µg/mL do 7 µg/mL. Nie obserwowano większych stężeń leku w osoczu.
poprawa stanu pacjenta może być odzwierciedlona przez zwiększenie pojemności minutowej serca, zmniejszenie ciśnienia klinowego naczyń włosowatych w płucach oraz takie reakcje kliniczne, jak zmniejszenie duszności i poprawa innych objawów niewydolności serca, takich jak ortopedia i zmęczenie.
monitorowanie centralnego ciśnienia żylnego (CVP) może być cenne w ocenie niedociśnienia i gospodarki płynowej. W celu uzyskania zadowalającej odpowiedzi Inamrinonem niezbędna jest wcześniejsza korekta lub dostosowanie płynów/elektrolitów.
produkty lecznicze do podawania pozajelitowego powinny być kontrolowane wzrokowo i nie powinny być stosowane w przypadku wykrycia cząstek stałych lub zmiany zabarwienia.
jak jest dostarczany Inamrinone
INAMRINONE Injection USP jest dostarczany w jednodawkowych fiolkach zawierających 20 mL jałowego, przezroczystego żółtego roztworu w opakowaniu pojedynczym. NDC 55390-042-10.
Każdy 1 mL zawiera mleczan Inamrinonu, co odpowiada 5 mg inamrinonu.
chronić przed światłem. Opakowanie jest odporne na światło dla ochrony podczas przechowywania. Przechowywać w opakowaniu do czasu użycia.
Przechowywać w kontrolowanej temperaturze pokojowej od 15° do 30°C (59° do 86°F).
Manufactured by: Manufactured for:
Ben Venue Laboratories, Inc. Bedford Laboratories™
Bedford, OH 44146 Bedford, OH 44146
August 2002 AMR-P01
VIAL LABEL

Vial Label 100 mg/20 mL
| Inamrinone Inamrinone injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Bedford Laboratories (884528407)
Registrant – Ben Venue Laboratories (004327953)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Ben Venue Laboratories Inc. | 004327953 | MANUFACTURE(55390-042) | |
More about inamrinone
- Side Effects
- During Pregnancy
- Dosage Information
- Drug Interactions
- Drug class: inotropic agents
Related treatment guides
- Heart Failure
Medical Disclaimer