wprowadzenie
krwiak wewnątrzmaciczny aorty (IMH) jest jednym z kilku stanów włączonych do ostrego zespołu aorty (AAS).1,2 pod względem morfologicznym charakteryzuje się krwotokiem do warstwy medialnej ściany aorty przy braku łzy śródmiąższowej, co oznacza, że nie ma komunikacji ze światłem aorty. Niektórzy autorzy sugerują, że IMH jest wynikiem spontanicznego pęknięcia aorty Vasa vasorum. Częstość występowania IMH u pacjentów z klinicznie podejrzewanym AAS waha się od 5% do 20% przypadków.2-4
podobnie jak w przypadku klasycznego rozwarstwienia aorty, IMH dzieli się na dwa typy zgodnie z klasyfikacją Stanforda: Typ A, gdy występuje zaangażowanie aorty wstępującej, i typ B, gdy nie ma wpływu na aortę wstępującą.
obecnie przyjmuje się, że leczenie IMH typu A jest zasadniczo chirurgiczne, podczas gdy Typ B może być początkowo leczony terapią medyczną, rezerwując operację LUB umieszczając stent w przypadkach z dodatkowymi powikłaniami. Śmiertelność związana z IMH w pierwszych miesiącach nie jest nieistotna; głównymi niezależnymi czynnikami prognostycznymi śmierci są Średnica aorty >50 mm i zajęcie aorty wstępującej.
nadal istnieją pewne wątpliwości co do historii naturalnej tej choroby i najodpowiedniejszego leczenia pacjentów dotkniętych chorobą. Klasycznie zaleca się unikanie antykoagulacji u pacjentów z AAS głównie z dwóch powodów: w celu ograniczenia postępu rozwarstwienia krwiaka i uniknięcia tamponady serca u pacjentów z wysiękiem osierdziowym.
celem niniejszego badania jest opis charakterystyki klinicznej i radiologicznej, a także ewolucja podgrupy pacjentów z IMH, którzy otrzymywali leczenie przeciwzakrzepowe podczas hospitalizacji.
metody
wszyscy pacjenci przyjęci do naszego szpitala z rozpoznaniem AAS od stycznia 2000 do grudnia 2005 zostali poddani ocenie prospektywnej. Spośród tych pacjentów wybraliśmy wszystkich, którzy mieli IMH i otrzymywali leczenie przeciwzakrzepowe podczas hospitalizacji. Zebrano dane demograficzne, a także DANE KLINICZNE, radiologiczne i kontrolne.
rozpoznanie AAS ustalono na podstawie tomografii komputerowej (ct) ze wzmocnieniem kontrastu i bez niego. Kolejne badania obrazowe wykonano metodą tomografii komputerowej i (lub) rezonansu magnetycznego (MR).
wszyscy badani pacjenci otrzymywali leczenie ukierunkowane na ścisłą kontrolę ciśnienia tętniczego krwi (BP ≤120/80 mm Hg), które we wszystkich przypadkach obejmowało beta-adrenolityki, z wyjątkiem przeciwwskazań do tego leczenia.
wyniki
w okresie badania do naszego ośrodka przyjęto 95 pacjentów z rozpoznaniem AAS. Dwanaście (25.6%) tych pacjentów wykazywało IMH (4 typu A i 8 typu B). Trzech pacjentów z IMH, którzy otrzymali leczenie przeciwzakrzepowe podczas hospitalizacji (jeden z IMH typu A i 2 z IMH typu B) są przedmiotem niniejszego raportu.
charakterystyka kliniczna i główne dane demograficzne pacjentów z IMH, którzy otrzymywali leki przeciwzakrzepowe, zostały opisane poniżej i przedstawione w tabeli.
Przypadek 1
79-letni mężczyzna z słabo kontrolowanym nadciśnieniem tętniczym pomimo leczenia farmakologicznego i przewlekłego migotania przedsionków. Wywiad kliniczny pacjenta obejmował Epizod zatoru tętniczego w prawej górnej kończynie 5 lat wcześniej, który był leczony doustnym lekiem przeciwzakrzepowym. Został przyjęty z powodu intensywnego bólu o nagłym początku w okolicy międzyżuchwowej, który promieniował do brzucha i towarzyszyły mu obfite pocenie się i zawroty głowy. Tomografia komputerowa wykonana na oddziale ratunkowym zidentyfikowała IMH typu B, który rozciągał się od początku lewej tętnicy podobojczykowej do rozwidlenia aortoili i wpływał na pierwsze kilka centymetrów lewej tętnicy biodrowej wspólnej (ryc. 1). W momencie przyjęcia pacjent był leczony labetalolem i nitroprusydkiem przez perfuzję, a przeciwzakrzepowe leczenie przerwano. Po przerwaniu tego leczenia pacjent przedstawił nowy epizod zatoru tętniczego w lewej kończynie górnej, który wymagał embolektomii. Z tego powodu ustalono antykoagulację, początkowo heparyną sodową, a później acenokumarolem.
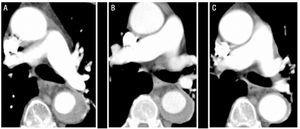
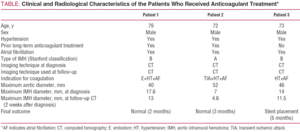
Rysunek 1.Ewolucja radiologiczna krwiaka wewnątrzmacicznego aorty typu B (IMH) u pacjenta 1. Seryjne wycinki tomografii przy rozwidleniu tętnicy płucnej wykazują postępujący spadek grubości zmiany i ostateczne jej ustąpienie. Grubość IMH w momencie diagnozy. B: Grubość w pierwszej obserwacji CT (2 tygodnie ewolucji). C: grubość IMH po 2 miesiącach.
Przypadek 2
72-letni mężczyzna z nadciśnieniem tętniczym o długiej ewolucji w trakcie leczenia farmakologicznego i przewlekłym migotaniem przedsionków w wywiadzie, na które otrzymywał digoksynę i acenokumarol. Przyszedł do naszego centrum z uciążliwym bólem w klatce piersiowej o nagłym początku, który promieniował do pleców. Wstępne badanie TK wykazało IMH typu A Z udziałem aorty wstępującej, łuku aorty i aorty zstępującej do początku tętnicy krezkowej górnej. Leczenie przeciwzakrzepowe przerwano. Podczas hospitalizacji pacjent wystąpił Epizod utraty przytomności z lewym niedowładem połowiczym,z którego wyzdrowiał bez następstw. Tomografia mózgowa nie wykazała oznak niedokrwienia ani krwotoków wewnątrzczaszkowych; stąd Epizod interpretowano jako przejściowy atak niedokrwienny pochodzenia zatorowego. Z powodu tego powikłania, leczenie przeciwzakrzepowe heparyną sodową w perfuzji, a następnie acenokumarolu zostało wznowione podczas hospitalizacji.
Przypadek 3
73-letni mężczyzna, palacz, z przewlekłą niewydolnością nerek i nadciśnieniem tętniczym o długiej ewolucji; miał przewlekłe migotanie przedsionków i otrzymywał leczenie przeciwpłytkowe. Pacjent przyszedł do naszego szpitala z powodu silnego bólu międzyżuchwowego promieniującego na obie boki. Wstępna tomografia komputerowa ustaliła rozpoznanie krwiaka śródmiąższowego typu B ograniczonego do zstępującej aorty piersiowej. W dystalnym segmencie krwiaka w obrębie krwiaka obserwowano obraz w kształcie łez (projekcja wrzodowa) (ryc. 2). Chociaż pacjent nigdy nie miał epizodu zatoru, leczenie przeciwzakrzepowe rozpoczęto przy przyjęciu ze względu na wysoki profil ryzyka zatorowego.
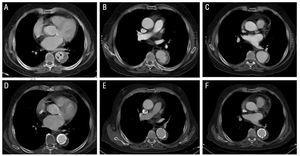
Rysunek 2. Ewolucja radiologiczna krwiaka wewnątrzmacicznego aorty typu B (IMH) u pacjenta 3. Górny panel: obrazy w momencie diagnozy (A) i podczas obserwacji (B I C). O: obserwuj obraz w kształcie łzy (projekcja wrzodowa) w IMH (strzałki). B: zlokalizowane rozwarstwienie podczas obserwacji (2 miesiące później). C: stopniowe rozszerzanie średnicy aorty. Panel dolny: obrazy po 5 miesiącach od diagnozy (D-F). Postępujące rozszerzenie krwiaka nakazuje wszczepienie dwóch stentów.
obserwacja radiologiczna
maksymalna średnica aorty i maksymalna średnica IMH w momencie rozpoznania, a także rozwój zmiany u każdego pacjenta przedstawiono w tabeli.
w okresie obserwacji radiologicznej wszyscy pacjenci wykazywali stopniowe zmniejszanie grubości IMH. U pacjentów 1 i 2 Maksymalna średnica IMH w momencie rozpoznania wynosiła odpowiednio 17,6 i 7 mm. W 2-tygodniowym badaniu kontrolnym CT średnice wynosiły odpowiednio 13 i 4,6 mm.
u pacjenta 3 grubość IMH wynosiła 14 mm w początkowej tomografii komputerowej i 11,5 mm w badaniu kontrolnym. Ponadto pacjent przedstawił obraz w kształcie łzy na dystalnym końcu IMH, który mierzył 4×??6 mm w momencie rozpoznania. Niektórzy autorzy zinterpretowali to jako znak wskazujący na wrzód aorty (projekcja wrzodowa). Po wypisie ze szpitala, u pacjenta rozwinął się miejscowy rozwarstwienie z późniejszym postępującym rozszerzeniem dotkniętego odcinka aorty (pseudoaneurysm), które wymagało wszczepienia 2 stentów (Excluder 34×??10 mm i 40??×10 mm). Późniejsza ewolucja była korzystna (Rysunek 2).
dyskusja
w badanym okresie badania 3 pacjentów z IMH otrzymywało leki przeciwzakrzepowe. Mimo że IMH jest zmianą krwotoczną, ewolucja kliniczna i morfologiczna była korzystna w tej podgrupie pacjentów, z postępującą regresją wielkości zmiany w obserwacji radiologicznej, pomimo faktu, że podano antykoagulację. U pacjenta 3 w trakcie obserwacji wystąpiły powikłania w odcinku aorty, w którym początkowa zmiana mogła być wrzód aorty (PAU). Mimo to, krwiak początkowo ulegał zmianom podobnym do tych obserwowanych u pozostałych dwóch pacjentów, ze stopniowym zmniejszaniem średnicy podczas ostrej fazy. Trudno ustalić rolę, jaką antykoagulacja mogła odegrać w patogenezie i ewolucji do pseudoaneuryzmu.
w literaturze naukowej nie ma ostatecznych danych dotyczących stosowania leków przeciwzakrzepowych u pacjentów z AAS, chociaż przerwanie leczenia jest powszechną praktyką. Jest prawdopodobne, że antykoagulacja nie zmienia naturalnego przebiegu IMH. Trzy argumenty przemawiają za tą hipotezą: a) biorąc pod uwagę, że hemostaza nie odgrywa głównej roli w patogenezie zmiany, jest mało prawdopodobne, aby miała wpływ na jej rozdzielczość; b) IMH jest stanem ograniczonym do wnętrza ściany aorty i nie ma kontaktu ze światłem naczynia, dlatego jest mało prawdopodobne, aby antykoagulant przeniknął do zmiany; i c) badania epidemiologiczne nie wykazały większej częstości występowania IMH u pacjentów z wrodzonymi lub nabytymi zaburzeniami składników hemostazy.
wnioskujemy, że w sytuacjach, w których konieczne jest leczenie przeciwzakrzepowe (pacjenci z wysokim ryzykiem zatoru), leczenie to można utrzymać, na podstawie wyników tego badania, w którym antykoagulacja nie miała wpływu na kliniczną lub morfologiczną ewolucję IMH. Oczywiście, dalsze badania z większymi seriami pacjentów są wymagane do wyciągnięcia ostatecznych wniosków.