
Sau (Larry) Lee, Ph.D., Zastępca Dyrektora Biura Badań i badań oraz przewodniczący powstającego zespołu Technologicznego, Office of Pharmaceutical Quality, CDER
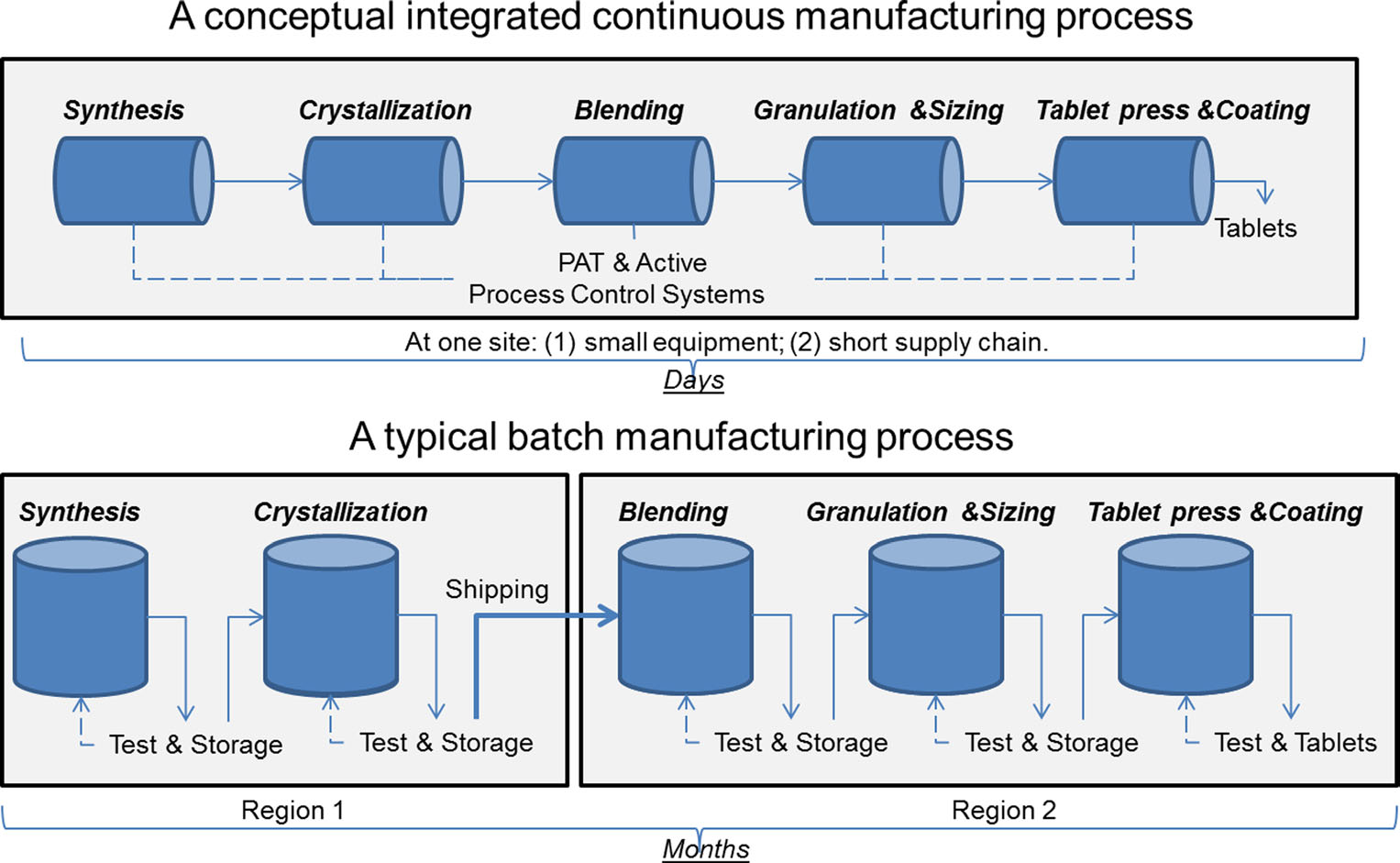 porównanie produkcji ciągłej i produkcji wsadowej. Zdjęcie dzięki uprzejmości Sau Lee. J. Pharm Innov (2015) 10:191-199.
porównanie produkcji ciągłej i produkcji wsadowej. Zdjęcie dzięki uprzejmości Sau Lee. J. Pharm Innov (2015) 10:191-199.od ponad 50 lat farmaceutyki są produkowane przy użyciu metody znanej jako „produkcja wsadowa”, wieloetapowego, długotrwałego procesu, który wymaga użycia niezgrabnego sprzętu na dużą skalę. Jednak ostatnie postępy w technologii produkcji skłoniły przemysł farmaceutyczny do rozważenia odejścia od produkcji seryjnej na rzecz szybszego i bardziej wydajnego procesu znanego jako produkcja ciągła. FDA podejmuje proaktywne kroki, aby ułatwić przemysłowi farmaceutycznemu wdrażanie nowych technologii, w tym produkcji ciągłej, w celu poprawy jakości produktów i rozwiązania wielu przyczyn niedoborów leków i wycofań.
partia vs.produkcja ciągła
produkcja wsadowa obejmuje wiele dyskretnych kroków. Po każdym etapie procesu produkcja zwykle zatrzymuje się, więc próbki mogą być testowane w trybie offline pod kątem jakości. Czasami podczas tych „czasów zatrzymania” między etapami materiał może być przechowywany w pojemnikach lub wysyłany do innych zakładów na całym świecie w celu zakończenia procesu produkcyjnego. Może to dodać tygodnie lub miesiące do czasu przetwarzania. W przypadku niektórych składników aktywnych, które są wrażliwe na środowisko, może również stwarzać ryzyko degradacji. Ponadto, jeśli popyt na pewne przepięcia leku, zwiększona produkcja może wymagać większego sprzętu. Takie skalowanie sprzętu wymaga większej przestrzeni fizycznej, większej powierzchni oraz więcej czasu i pieniędzy.
w przeciwieństwie do tego, farmaceutyki, które są wytwarzane przy użyciu ciągłej produkcji, są przenoszone bez przerwy w tym samym zakładzie, eliminując czasy wstrzymania między etapami. Materiał jest podawany przez linię montażową w pełni zintegrowanych komponentów. Ta metoda oszczędza czas, zmniejsza prawdopodobieństwo błędu ludzkiego i może reagować bardziej zwinnie na zmiany rynkowe. Aby uwzględnić większy popyt, produkcja ciągła może działać przez dłuższy okres czasu, co może zmniejszyć prawdopodobieństwo niedoborów leków.
oba rodzaje produkcji podlegają tym samym standardom kontroli jakości, ale monitorowanie jest zautomatyzowane w ciągłych zakładach produkcyjnych i wydaje się być częstsze niż w produkcji seryjnej. Podobnie jak wszystkie technologie, urządzenia do produkcji ciągłej mogą ulegać zużyciu, ale zautomatyzowane monitorowanie może wykryć problemy na długo przed wystąpieniem awarii. Takie monitorowanie może również pomóc przewidzieć oczekiwaną długość życia urządzenia, co prowadzi do lepszej proaktywnej konserwacji.
wreszcie, produkcja ciągła może pozwolić na bardziej elastyczne śledzenie i śledzenie, co byłoby zaletą w przypadku awarii produktu. Na przykład w produkcji wsadowej określona ilość (lub partia) leku jest określona przez wielkość sprzętu, który go wyprodukował. W produkcji ciągłej, ilość (lub partii) mogą być określone przez znacznik czasu, ilość leku wytwarzanego, lub ilość surowca wejściowego. Te metody śledzenia pozwalają producentowi wyizolować mniejszą ilość wadliwego materiału w przypadku awarii procesu, co prowadzi do mniejszej ilości odpadów i mniejszej szansy na niedobór.
trudne, ale opłacalne Przejście
kilka branż—takich jak przemysł chemiczny i petrochemiczny—przeszło już ewolucję produkcyjną i wykorzystuje wydajne technologie ciągłe, aby bezpiecznie wytwarzać produkty. Jednak w przemyśle farmaceutycznym przejście na produkcję ciągłą jest wciąż na wczesnym etapie z kilku powodów. Po pierwsze, koszty uruchomienia takiego przejścia mogą być wysokie. Rezygnacja ze starego sprzętu wsadowego, zakup nowych technologii i szkolenie personelu w zakresie korzystania z niego oraz modernizacja infrastruktury przemysłowej jest kosztowna, wymagając poważnego zaangażowania ze strony producenta leków. Mimo to analizy ekonomiczne wykazały potencjalne znaczne oszczędności długoterminowe. Ponadto niektóre technologie muszą jeszcze dojrzewać, zanim staną się rentowne. W przypadku niektórych rodzajów leków, takich jak produkty biologiczne, technologia ich wytwarzania w sposób ciągły może jeszcze nie istnieć. Prowadzone są badania mające na celu sprostanie tym i innym wyzwaniom. Ponadto producenci leków nadal dostrzegają niepewność regulacyjną, która może opóźnić zatwierdzenie produktu, gdy używana jest nowa technologia produkcji.
ponieważ branża rozważa, jak dokonać zmiany, FDA zapewnia zasoby i informacje, aby ułatwić przejście. Na przykład agencja współpracuje z Biomedical Advanced Research and Development Authority, programem w ramach amerykańskiego Departamentu Zdrowia i usług ludzkich, aby pomóc w finansowaniu i wspieraniu badań w tej dziedzinie. Szkolimy również nasz personel kontrolny i prowadzimy wewnętrzne badania dotyczące obszarów ryzyka związanych z produkcją ciągłą, dzięki czemu możemy lepiej ocenić powiązane technologie.
prowadzę multidyscyplinarny zespół w ramach programu Emerging Technology w biurze jakości farmaceutycznej CDER. Program został ustanowiony, aby pomóc przemysłowi we wdrażaniu innowacyjnych technologii w celu poprawy jakości produktów i modernizacji przemysłu, w celu rozwiązania podstawowych przyczyn niedoborów leków lub wycofań. Nowy program Technologiczny dotyczy nie tylko technologii produkcji ciągłej, ale także innych osiągnięć, takich jak drukowanie 3D, nowe formy dawkowania i nowe systemy pojemników. W ramach tego programu współpracujemy z przemysłem na wczesnym etapie procesu opracowywania nowych technologii i omawiamy wszelkie przewidywane kwestie regulacyjne lub naukowe, które mogą być częścią przyszłego zastosowania.
wiele firm złożyło wniosek do powstającego programu Technologicznego w odniesieniu do ich zainteresowania produkcją ciągłą. Dokument FDA zatytułowany „Advancement of Emerging technology Applications to Modernize the pharmaceutical Manufacturing Base Guidance for Industry” zawiera informacje i porady na temat współpracy z agencją na wczesnym etapie procesu rozwoju.
Przeczytaj więcej o wysiłkach FDA na rzecz modernizacji produkcji leków na blogu głosowym FDA.