Les huiles biologiques sont différentes des huiles de pétrole (carburant diesel « ordinaire ») par leur structure moléculaire et leurs propriétés.

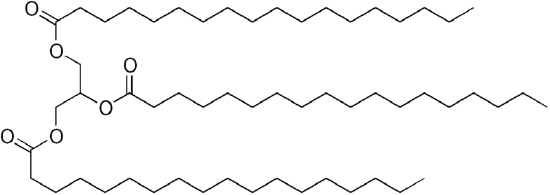
Le carburant diesel de pétrole commun est un mélange d’hydrocarbures simples, de formule chimique moyenne C12H23 (ci-dessous) , mais les composants peuvent varier approximativement de C10H20 (dodécane) à C15H28 (pentadécane). En revanche, les huiles biologiques sont des « triglycérides » (classés comme « esters ») comme le trilinoléate de glycéryle illustré ci-dessous:
|
C12H23, dodécane |
Un triglycéride: trilinoléate de glycéryle |
En raison de leur grande taille et de leurs attraits intermoléculaires conséquents, la viscosité des huiles biologiques est généralement trop élevée pour être utilisée dans des moteurs diesel conventionnels. Les huiles biologiques brûlent également un peu moins facilement et avec une flamme plus douce que le diesel de pétrole. Les huiles biologiques peuvent être utilisées dans les moteurs diesel conventionnels si elles sont préchauffées pour réduire leur viscosité, mais cela nécessite un chauffage électrique auxiliaire jusqu’à ce que le moteur se réchauffe. Pour ces résons, les huiles bilogiques nécessitent un traitement pour être utilisées comme biodiesel.
Une huile biologique est un ester, qui est un type de composé organique ayant la liaison atomique illustrée ci-dessous.
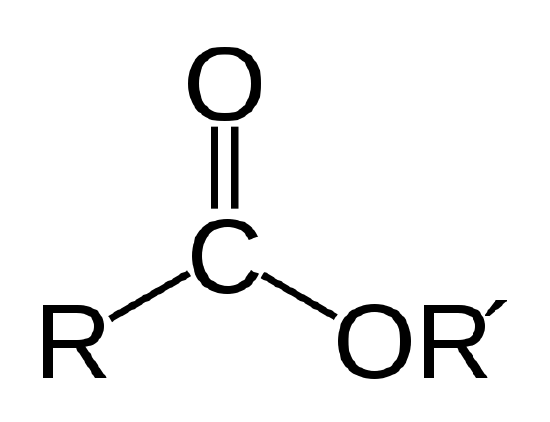
La liaison ester. R et R’ représentent des chaînes d’atomes de carbone et d’hydrogène. R =-CH3 et R’=-C18H35O2 pour le stéarate de méthyle de l’exemple 1 |
glycérol |
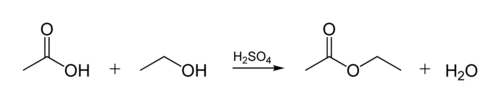
La liaison ester dans les huiles biologiques est créée lorsqu’une la molécule de glycérol réagit avec les acides organiques. La molécule de glycérol a une chaîne de 3 atomes de carbone, chacun avec un groupe -OH (alcool) dessus. La figure ci-dessous montre comment un alcool organique réagit avec un acide organique. Les chimistes organiques abrègent les structures moléculairesthe les lignes « zig-zag » sur la figure représentent des chaînes carbonées avec un atome de C à chaque « zig » ou « zag ». Chaque carbone a 4 liaisons, et si moins de 4 sont montrés, on suppose qu’ils vont aux atomes H. Ainsi, l’alcool est C2H5OH (éthanol) et l’acide est l’acide acétique (ou l’acide éthanoïque, CH3COOH) sur la figure:
Puisque le glycérol a des groupes 3-OH, 3 « acides gras » organiques à longue chaîne s’attachent pour former le « triglycéride » volumineux.
Mais tout aussi facilement que les esters peuvent être fabriqués à partir d’alcools et d’acides, ils peuvent changer d’alcools ou d’acides. En présence d’un catalyseur de base fort, comme le NaOH, un triglycéride peut réagir avec 3 petites molécules d’alcool, comme le méthanol (CH3OH), qui remplacent le « squelette » du glycérol, faisant 3 esters séparés de poids moléculaire inférieur
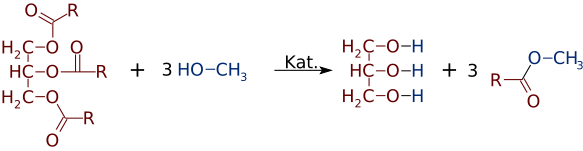
Assez souvent, un mélange de deux produits ou plus est formé. Par exemple, lorsqu’une huile végétale réagit avec le méthanol, seul un ou deux des acides peuvent être déplacés de la glycérine, ne produisant que 1 ou 2 FAMEs.
C3H5 (C18H35O2) 3 + NaOH + 2 CH3OH → C3H5 (C18H35O2) 2 (OH) + 2 C17H35COOCH3 C3H5 (C18H35O2) 3 + NaOH + 1 CH3OH → C3H5 (C18H35O2) (OH) 2 +1 C17H35COOCH3 C3H5 (C18H35O2) 3 + NaOH + 3 CH3OH → C3H5 (OH) 3 + 3 C17H35COOCH3
Habituellement, un grand excès de méthanol et d’hydroxyde de sodium est ajouté, de sorte que la réaction produit le maximum de RENOMMÉE.
Mais dans le cas d’une transestérification, même si aucun des réactifs n’est complètement consommé, aucune augmentation supplémentaire des quantités de produits ne se produit. Nous disons qu’une telle réaction ne se termine pas. Lorsqu’un mélange de produits est produit ou qu’une réaction ne se termine pas, l’efficacité de la réaction est généralement évaluée en termes de rendement en pourcentage du produit souhaité. Un rendement théorique est calculé en supposant que tout le réactif limitant est converti en produit. La masse de produit déterminée expérimentalement est ensuite comparée au rendement théorique et exprimée en pourcentage :

EXEMPLE 1 Lorsque 100,0 g de gaz C3H5 (C18H35O2)3 et 15,0 g de CH3OH sont mélangés à 55°C avec un catalyseur NaOH, ils réagissent pour former 90,96 g de biodiesel de stéarate de méthyle C17H35COOCH3. Calculez le pourcentage de rendement.
Solution Il faut calculer le rendement théorique en NH3, et pour ce faire, il faut d’abord découvrir si N2 ou H2 est le réactif limitant. Pour l’équation équilibrée
C3H5 (C18H35O2) 3 + NaOH + 3 CH3OH → C3H5 (OH)3 +3 C17H35COOCH3 stéarine + hydroxyde de sodium + 3 CH3OH → glycérol + 3 stéarate de méthyle
Le rapport stoechiométrique des réactifs est
 Maintenant, les quantités initiales des deux réactifs sontet
Maintenant, les quantités initiales des deux réactifs sontet Le rapport des quantités initiales est donc
Le rapport des quantités initiales est donc Puisque ce rapport est inférieur à
Puisque ce rapport est inférieur à , il y a un excès de CH3OH. La stéarine est le réactif limitant. En conséquence, nous devons utiliser 0,1122 mol de stéarine et 0,3366 mol de CH3OH (plutôt que 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have
, il y a un excès de CH3OH. La stéarine est le réactif limitant. En conséquence, nous devons utiliser 0,1122 mol de stéarine et 0,3366 mol de CH3OH (plutôt que 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have so that
so that We can organize these calculations in a table:
We can organize these calculations in a table:
| C3H5(C18H35O2)3(s) | + 3 CH3OH (l) | → 1 C3H5(OH)3 (l) | + 3 C18H35O2)3CH3(s) | ||
|---|---|---|---|---|---|
| m, g | 100.0 g | 15.00 g | 90.96 g | ||
| M, g/mol | 891.5 | 32.04 | 298.5 | 92.1 | |
| n present, mol | 0.1122 mol | 0.4682 mol | |||
| n actual, mol | 0.1122 | 0.3366 | 0.1122 | 0.3366 | |
| m actual, mass | 100.0 | 10.78 | 10.33 | 100.47 |
The percent yield is then
Transesterification is a classic example of a reaction which does not go to completion.