Existují experimentální metody pro detekci nepárových elektronů. Jedním z charakteristických znaků nepárových elektronů v materiálech je interakce s magnetickým polem. Tato interakce může být použita k poskytnutí informací o sloučeninách obsahujících nepárové elektrony.
elektronová paramagnetická rezonance
elektronová paramagnetická rezonance (EPR) nebo elektronová spinová rezonance (ESR) je spektroskopická metoda. Závisí na energetické separaci dvou spinových stavů, které existují pouze v přítomnosti magnetického pole.
EPR velmi úzce souvisí s jiným běžným typem spinové rezonanční spektroskopie, NMR.
Spin je kvantová vlastnost, která nemá žádnou skutečnou analogii, která by nám dávala smysl na makroskopické úrovni. Víme však, že spin s tím souvisí magnetické vlastnosti. Elektron může mít pro tyto magnetické vlastnosti jednu ze dvou hodnot. Existují různé štítky dány tyto hodnoty: někdy „nahoru“ a „dolů“, někdy,, +1/2 a -1/2. Nicméně, bez ohledu na to, jakou hodnotu spinu má elektron, není energeticky žádný rozdíl.
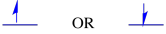
dva možné spinové stavy jsou energeticky stejné-pokud není přítomno magnetické pole. Jakmile tato situace nastane, existuje energetické oddělení mezi oběma státy.
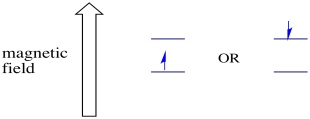
V přítomnosti magnetického pole, dva spinové stavy rozdělit na dvě různé energetické hladiny. Množství oddělení mezi energetickými hladinami závisí na velikosti magnetického pole. Čím silnější je magnetické pole, tím větší je oddělení.
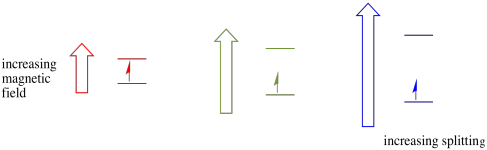
tento případ platí pouze pro nepárová otočení. Nezapomeňte, že nepárová otočení interagují s magnetickým polem. Pokud je vše spárováno, nic se nestane. To je velmi užitečné, protože nám to dává způsob, jak detekovat tyto nepárové elektrony.
elektron v jednom spinovém stavu může být stále vzrušen k druhému absorbancí fotonu. Alternativně může elektron ve vyšším stavu klesnout na nižší, pokud uvolní foton.
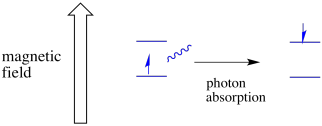
aby se něco z toho stalo, musí energie fotonu přesně odpovídat energetickému rozdílu mezi stavy. Toto pravidlo Zlatovlásky se nazývá rezonanční podmínka. Množství energie dodávané skočit z jedné energetické úrovně na další musí být tak akorát. Příliš málo energie a elektron to nezvládne. Příliš mnoho energie a elektron to také neudělá. Čeká na ten správný foton.
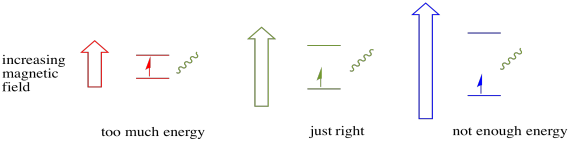
kolik energie má foton? Vzpomeňte si na svůj vztah Planck-Einstein. To popsal energie fotonu:
\(E=h \nu \)
E je energie fotonu, h je Planckova konstanta (6.625 x 10-34 Js) a ν je frekvence fotonu (to vypadá jako Římské vee, ale je to řecké písmeno nu).
alternativně kvůli vztahu mezi vlnovou délkou a frekvencí:
\(E= \frac{hc}{\lambda}\)
nový množství je c rychlost světla (3,0 x 108 m s-1) a λ, vlnová délka fotonu.
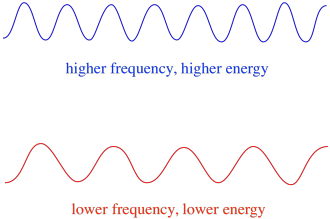
takže obecně různé vlnové délky světla dodávají různé množství energie. Modré světlo s vlnovou délkou blízko 475 nm, má více energie, než červené světlo s vlnovou délkou téměř 700 nm.
V EPR je obecným rozsahem elektromagnetického záření nebo obecným druhem fotonu mikrovlnné záření. Frekvence těchto fotonů je asi 9 nebo 10 GHz. (Jiný typ spektroskopie, rotační spektroskopie, také měří absorbanci mikrovln. Obvykle používá poněkud vyšší frekvence mikrovln. Rotační spektroskopie poskytuje strukturní nebo vazebné informace o molekulách v plynné fázi.)
v Závislosti na prostředí nepárový elektron, může být náchylnější nebo méně citlivé na vliv vnějšího magnetického pole. To znamená, že rozdělení energie mezi dvěma spinovými stavy se bude lišit od jedné molekuly k druhé. V důsledku toho by různé molekuly ve stejném magnetickém poli absorbovaly různé vlnové délky mikrovlnného záření.
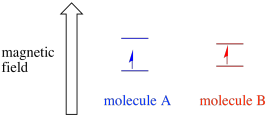
EPR spektrometr je obvykle navržen tak, aby dodával vzorku pevnou vlnovou délku mikrovlnného záření. Magnetické pole je nastaveno a přístroj měří, jaká intenzita pole byla potřebná pro absorpci fotonů. Spektrum EPR vykazuje absorbanci jako funkci síly magnetického pole.
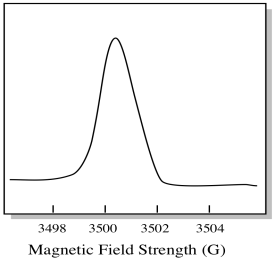
na tom, jak se EPR spektra obvykle zobrazují, je něco trochu jiného. Zobrazuje se jako derivát výše uvedeného grafu. Je to kvůli způsobu, jakým přístroj měří změnu absorbance při změně magnetického pole; tj. měří d (absorbance) / d (magnetické pole). To je sklon předchozího pozemku.
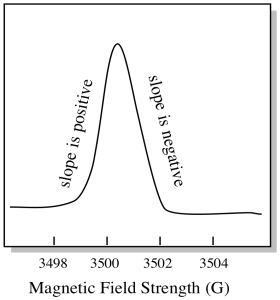
výsledkem je, že spektrum EPR skutečně vypadá spíše takto. Část nad základní linií odráží kladný sklon v předchozím grafu. Část pod základní linií odráží negativní sklon v předchozím grafu.
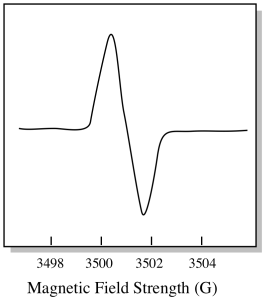
magnetické síly pole je obvykle hodnota, která je hlášena na vrcholu pozice. Místo toho je hlášeno něco, co se nazývá hodnota g. Hodnota g vychází z rovnice pro Zeemanův efekt (vliv magnetického pole na rozdělení mezi úrovněmi spinové energie). Tento vztah je:
\(\Delta E = g \beta B\)
ve kterém ΔE je energetický rozdíl mezi spin státy, g je g-hodnota, konstantou úměrnosti, která závisí na tom, jak citlivé elektron je vlivem magnetického pole, β je Bohrův magneton (9.274 x 10-24 J T-1) a B je aplikované magnetické pole.
To znamená, že pro fotonové absorpce,
\(h \nu = g \beta B\)
a tak
\(g = \frac{ h \nu}{\beta B}\)
Pamatujte, h a β jsou jenom konstanty. To znamená, že g je míra poměru fotonu absorbovaného k použitému magnetickému poli. Je to standardizační krok. Pokud mají lidé nástroje, které používají mírně odlišné vlnové délky mikrovlnného záření, pak by magnetická pole, která měří pro stejné vzorky, nesouhlasila. Pokud každý jen měří poměr vlnové délky k intenzitě pole, mělo by se to všechno vyrovnat. Hodnota g je reprodukovatelná míra prostředí elektronu, která by měla být stejná z jedné laboratoře do druhé.
podobná praxe se používá v NMR spektroskopii z podobných důvodů. Když nahlásíme chemický posun v ppm místo Hz, opravujeme sílu magnetického pole v nástroji, který používáme. Jinak by stejný vzorek dal dva různé posuny na dvou různých nástrojích.
vazba v EPR
vazba je jev, při kterém magnetická pole vzájemně interagují. V EPR dochází ke spojení kvůli vlivu blízkých jader na pozorovaný elektron.
například už možná víte, že jádro atomu vodíku má nepárovou rotaci. To je základ 1H NMR spektroskopie. Pokud má toto jádro nepárovou rotaci, má přidružené magnetické pole. Protože jádro vodíku může mít buď hodnotu spinu, +1/2 nebo -1/2, pak má dvě možná magnetická pole s ním spojená.
blízký elektron, umístěný ve vnějším magnetickém poli, by nyní mohl být v jedné ze dvou různých situací. Buď sousední proton trochu přidá k magnetickému poli, nebo trochu odečte od vnějšího pole.
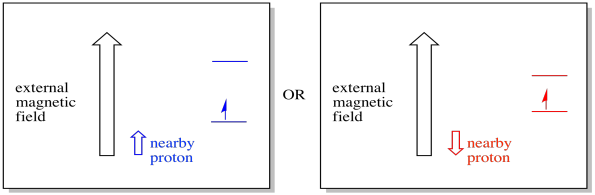
výsledkem je, že elektron může zažít dva různé obory. Pamatujte, že se ve spektroskopii nezabýváme jedinou molekulou. Máme co do činění s obrovským počtem molekul. Některé molekuly budou v jedné situaci. Některé molekuly budou v jiné situaci. Uvidíme obě situace. Bude absorbance při dvou různých silách magnetického pole.

Jako výsledek, EPR spektrum vykazuje dva vrcholy, jako je tento:
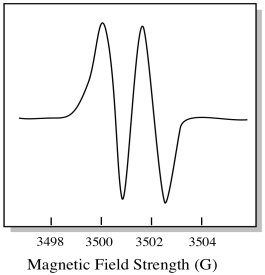
Tento typ píku ve spektru se nazývá dublet, protože dvojitá absorbance. Tato charakteristika vrcholu EPR se nazývá jeho multiplicita. Na kolik řádků je vrchol rozdělen? Dva. Je to dublet.
věci jsou ještě zajímavější, pokud existují dva blízké protony. V tom případě mají oba sousední protony spin. Buď spin může mít hodnotu + 1/2 nebo -1/2. Možná jsou oba + 1/2. Možná jsou oba -1 / 2. Možná je jeden z každého. Tyto tři možné kombinace budou mít tři různé účinky na magnetické pole, které zažívá elektron.
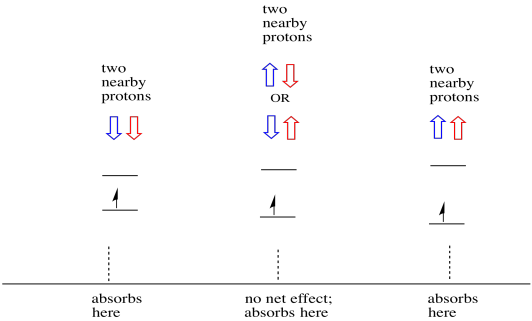
výsledkem je, že ve spektru jsou tři vrcholy. Spektrum se nazývá triplet. Tento triplet je uveden níže, pod diagramem, který ilustruje spinové kombinace sousedních vodíků.
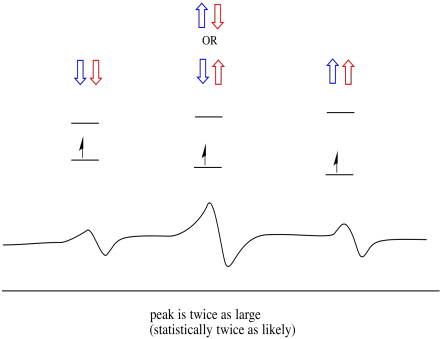
Všimněte si, že,, protože vodík může být nahoru nebo dolů ve smíšené kombinaci, existují dva způsoby, jak dosáhnout, že střední stav. Tato kombinace je dvakrát pravděpodobnější než ostatní dva, protože existuje pouze jeden způsob, jak získat tuto kombinaci: v jednom případě jsou otočení obou vodíků nahoru. Oba vodíky jsou dole ve druhém. Výsledkem je, že střední vrchol v Trojici je dvakrát větší než vrcholy na okrajích.
Cvičení \(\PageIndex{1}\)
Ukazují, že tři sousední vodíky, kvartet by výsledek, ve kterém je poměr píků 1:3:3:1.
odpověď
kombinace jsou:
a) všechny spiny dolů (a tam je jen jeden způsob, jak to udělat)
b) dvě kola se dolů, ale jeden je (a každý ze tří protonů by mohl být, takže tam jsou tři způsoby, jak to udělat)
c) dvě kola, ale jeden je dole (a každý ze tří protonů by mohl být dolů, takže tam jsou tři způsoby, jak to udělat)
d) všechny spiny nahoru (a tam je jen jeden způsob, jak to udělat, že).
výsledkem je kvarteto 1:3:3:1.
Cvičení \(\PageIndex{2}\)
Předvídat mnohosti v EPR spektrum pro každé z následujících alkoxy radikály (všimněte si, že kyslík a oxid mít žádné nespárované spiny; předpokládat, že totéž platí i pro X):
a) X3C-O. b) X2CH. c) XCH2-O. d) CH3-O.
Odpověď)
a) tričko
Odpověď b)
b) kabátec
Odpověď c)
c) triplet
Odpověď d)
d) kvarteto
Cvičení \(\PageIndex{3}\)
Předpokládejme, že benzen byly sníženy o jeden elektron získat benzen radikál aniontu. Jaká by byla multiplicita ve spektru EPR?
odpověď
a septet (V a 1:3:5:7:5:3:1 poměr).
vazba na kovové ionty
spousta jader jiných než vodík má Netto spin. Pokud se nepárový elektron nachází na kovu, spektrum EPR může poskytnout potvrzení této strukturální informace. Toto potvrzení může pocházet jak z informací o magnetickém poli (podobně jako chemický posun v NMR), tak z multiplicity.
jaderné zatočení vybraných kovů jsou uvedeny níže.
| Kovové | Spin |
| V | 7/2 |
| Mn | 5/2 |
| Fe | 0 |
| Co | 7/2 |
| Uk | 3/2 |
V každém z těchto kovů, jádro má různé možné magnetické pole. Všimněte si, že jejich účinky jsou o něco komplikovanější než účinky atomu vodíku. Například měď se spinem 3/2 působí trochu jako tři různá jádra vodíku (každé se spinem + / – 1/2), pokud jde o jeho účinek na EPR spektrum Blízkého elektromu. Množství nepárového elektronu na iontu mědi by mělo být docela výrazné.
Cvičení \(\PageIndex{4}\)
Předvídat mnohosti vrcholu v EPR spektra pro nepárový elektron na každý z následujících kovů:
a), vanad. b) mangan c) železo d) kobalt e) měď
Odpověď a)
a) oktet (v 1:3:5:7:7:5:3:1 poměr)
Odpověď b)
b) sextet (v poměru 1:3:5:5:3:1 poměr)
Odpověď c)
c) chemická vazba
Odpověď d)
d) oktet,
Odpověď e)
e) kvartet (v poměru 1:3:3:1 poměr)
Někdy jsou věci složitější, protože různé izotopy téhož prvku mohou mít různé možné spin hodnoty. Ve skutečnosti, to je pravda, s vodíku a uhlíku, ale velká většina vodíku je našel jako 1H, takže obecně můžeme myslet na to, jak mít spin = 1/2; velká většina je uhlík 12C, s spin = 0.
přírodní izotopy železa a jejich jaderné spiny jsou uvedeny v následující tabulce.
| Isotope | Spin | % Abundance |
| 54Fe | 0 | 5.9 |
| 56Fe | 0 | 91.8 |
| 57Fe | 1/2 | 2.1 |
| 58Fe | 0 | 0.2 |
The EPR spectrum of an unpaired electron on iron may be slightly more complicated than we first thought. Ve vzorku by se některé elektrony nacházely na iontech železa se spinem = 1/2, i když většina ne. Tato komplikace může stačit k zavedení mírné odchylky ve vzhledu spektra, ale celkově by to stále vypadalo skoro jako singlet.
v mnoha případech se však věci stávají mnohem složitějšími. Dobrým příkladem je molybden.
| Izotop | Spin | % Množství |
| 92Mo | 0 | 14.8 |
| 94Mo | 0 | 9.3 |
| 95Mo | 5/2 | 15.9 |
| 96Mo | 0 | 16.7 |
| 97Mo | 5/2 | 9.6 v |
| 98Mo | 0 | 24.1 |
| 100Mo | 0 |
k Dispozici je sedm přirozeně se vyskytující izotopy molybdenu. Pět z nich má spin = 0, takže nepárový elektron na těchto izotopech by dal vzniknout jednoduchému singletu ve spektru EPR. Další dva izotopy, které tvoří 25% z celkového počtu, mají spin = 5/2. Většina nepárových elektronů na molybdenu by se ukázala jako singlet. Významná část by se však ukázala jako sextet. To znamená, že, v ideálním případě, nepárový elektron na molybdenu by vést k tílko s sextet položený na to (asi čtvrt silné jako tričko).
tato situace může vypadat jako obrázek níže.
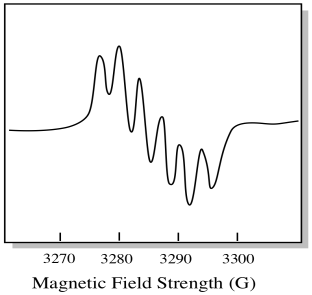
ve skutečnosti jsou EPR spektra v mnoha případech nesmírně komplikovaná. Často vypadají jako fuzzy kuličky. Existuje tolik věcí, které se spojují s tolika dalšími věcmi, že je téměř nemožné rozluštit okem. Ve většině případů jsou spuštěny počítačové simulace a experimentální data jsou porovnána s počítačovými simulacemi, aby se získal strukturální vhled.
Cvičení \(\PageIndex{5}\)
Vanad je přítomen v některých nitrogenases a tak tam byl zájem v modelu komplexy (např. Sandro Gambarotta et al., J. Am. Cheme. SOC. 1994, 116, 6927-6928). Gambarotta použil následující syntézu v rozpouštědle THF:
\(\ce{VCl3 + K -> 3V (THF)}\)
- Nakreslete strukturu produktu reakce.
- nakreslete d orbitální štípací diagram pro tento komplex.
- pro tuto sloučeninu bylo zaznamenáno spektrum EPR. Načrtněte spektrum, vzhledem k tomu, že vanad má jaderné spiny i = 7/2.
- odhad µeff pro tuto sloučeninu.
sloučenina reaguje s N2 a vytváří dimer přemostěný N2.
e) nakreslete strukturu tohoto produktu.
f) tato sloučenina neprodukuje EPR spektrum. Poskytněte rezonanční strukturu (e), která vysvětluje toto pozorování.
odpověď

EPR spectra za předpokladu, s laskavým svolením virtuální představivost / Slapdash chemie výtvory.
Attribution
Chris P Schaller, Ph.D., (Vysoká škola svatého Benedikta / univerzita svatého Jana)