- Úvod
- Materiály a Metody
- Instrumentální Analýzy
- Mikrobiální Kultury
- Média Příprava
- Kvašení Drostanolone Enanthate (1) s. C. aphidicola ATCC 28300, a F. lini NRRL 2204
- 2α-Methyl-3α,14α,17β-trihydroxy-5α-androstan (2)
- 2α-Methyl-7α-hydroxy-5α-androstan-3,17-dionu (3)
- 2α-Methyl-3α,17β-dihydroxy-5α-androstan (4)
- 2-Methylandrosta-1,4-dien-3,17-dion (5)
- 2-Methylandrosta-11α-hydroxy-1,4-dien-3,17-dion (6)
- 2-Methylandrosta-14α-hydroxy-1,4-dien-3,17-dion (7)
- 2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
- 2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
- Experimental Protocol for Cytotoxicity
- Výsledky a Diskuse
- Struktura Objasnění
- Cytotoxicitu vůči HeLa, PC3, H640, a HCT116 Rakovinu, a 3T3 Normální Buněčné Linie
- Struktura-Aktivita Vztah
- závěr
- autorské příspěvky
- Prohlášení o střetu zájmů
- Poděkování
- doplňkový materiál
Úvod
Mikrobiální transformace je jedním z nejdůležitějších přístupů pro strukturální transformace různých tříd organických sloučenin. Tato technika byla úspěšně použita v zelené chemii, tj. programy pro objevování a vývoj léčiv, které poskytují vynikající zdroj sloučenin kolem jádrových struktur, následovaný screeningem různých biologických aktivit. V několika případech, mikrobiální transformace byla použita jako důležitý nástroj pro regio-, chemo-a stereo-selektivní konverze organických sloučenin, které jsou obtížné dosáhnout pomocí konvenčních metod (Holland a Weber, 2000; Fernandes et al., 2003; Mihovilovic et al., 2003; Yildirim et al., 2003; Bartmanska a kol., 2005; Borges et al., 2009; Choudhary a kol., 2011; Ravindran et al., 2012). Vzhledem k neaktivní povaze uhlovodíkové kostry steroidů je často obtížné je derivovat konvenčními syntetickými metodami. Proto se mikrobiální transformace často používá pro strukturální změnu steroidů. Přítomnost enzymových systémů cytochromu P450 v houbách činí celobuněčnou biokatalýzu účinným nástrojem pro stereofonní a regio-specifickou hydroxylaci (Choudhary et al ., 2005a; Tong a Dong, 2009; Kristan a RiŽner, 2012; Baydoun et al., 2014).
Drostanolone, a jeho estery, deriváty, jako drostanolone propionát, drostanolone pentanoate, a drostanolone enanthate (1) jsou anabolické-androgenní steroidy (Steroidy) používají sportovci, aby posílily své svaly bez přibírání tuku. Navíc Drostanolon a jeho deriváty esterů mají schopnost inhibovat produkci estrogenu. Propionát ester drostanolone se také používá pro léčbu rakoviny prsu, pod značkou Masteron (Chowdhury et al., 1976; Clavel et al., 1982; Marinov et al., 1986; Vardar a kol., 2002; Bahrke and Yesalis, 2004).
rakovina je v současné době považována za hlavní výzvu v oblasti veřejného zdraví. Rakoviny jsou druhou hlavní příčinou úmrtí ve Spojených státech a po celém světě. Podle Světové zdravotnické organizace (WHO) prevalence rakoviny přesahuje 6 milionů případů ročně. Rakovinné buňky mají vysokou míru proliferace. Rychle se šíří v živém systému a mohou přežít proti silným chemoterapeutikům a činidlům poškozujícím DNA. Podobně cytotoxická léčiva mají mnoho nepříznivých účinků na normální buňky, a proto je jejich použití v chemoterapii rakoviny terapeutickou výzvou. Z tohoto důvodu je naléhavě nutný vývoj bezpečných, účinných a selektivních chemoterapeutických látek proti různým rakovinám (Munoz-Pinedo et al ., 2012; Su et al., 2015; Swadogo a kol., 2015; Rebecca a kol., 2016).
rakovina prsu je jednou z nejčastějších rakovin ve 140 zemích světa. To je hlavní příčinou rakoviny úmrtí u žen po celém světě, vyznačující se tím, abnormální růst buněk v prsu lobules nebo potrubí s vysokou šíření rate (Hanahan a Weinberg, 2000; Ferlay et al., 2015).
rakovina děložního čípku je po rakovině prsu druhou nejrozšířenější rakovinou u žen po celém světě. Hlavní příčinou rakoviny děložního čípku je tvorba maligních buněk v tkáních děložního čípku (Wang et al ., 2013; Hafiza a Latifah, 2014; Pariente et al., 2016). Buněčná linie rakoviny HeLa, získaná z lidských buněk rakoviny děložního čípku, je běžným buněčným modelem pro hodnocení cytotoxického potenciálu testovaných sloučenin.
rakovina prostaty je po rakovině průdušek druhou přední rakovinou u mužů na celém světě a třetí nejčastější příčinou úmrtí na rakovinu. Je to nejčastější důvod malignity u mužů. Jeho výskyt se zvyšuje s věkem, častější ve věku 50 let (Henry a Omahony, 1999; De-Bono et al., 2010; Wenbin a kol., 2015). Buněčná linie rakoviny PC-3, získaná z mužských buněk rakoviny prostaty, je široce používaným modelem pro zkoumání toxicity testovaných sloučenin.
rakovina Plic je velmi rozšířené rakoviny u mužů ve Spojených Státech od poloviny roku 1950 a mezi ženami, protože pozdní 1980. To je hlavní příčinou rakoviny souvisejících úmrtí. Rakovina plic je většinou připisována kouření (Travis et al ., 2002; Villanti et al., 2013; Mishra a kol., 2016). Na H460 rakovinné buněčné linie, získané z lidských buněk plicního karcinomu (lymphogenous metastatického subline lidských velkobuněčný karcinom plic), jsou často používány k vyhodnocení testu cytotoxicity sloučenin.
po rakovině prsu, plic a prostaty je rakovina tlustého střeva čtvrtou nejčastější rakovinou na celém světě. Je to rakovina, která se vyskytuje přibližně ve stejné frekvenci u mužů a žen. Je to druhá nejčastější příčina úmrtí souvisejících s rakovinou v západních zemích (Levin et al ., 2008; Andre et al., 2009; Ahearn et al., 2012). Nádorová buněčná linie HCT116 získaná z lidských buněk rakoviny tlustého střeva se běžně používá k hodnocení cytotoxicity testovaných sloučenin.
v pokračování našich studií o houbové transformaci bioaktivních steroidů (Choudhary et al ., 2005b, c, 2007, 2010; Ahmad et al., 2014; Siddiqui a kol., 2017), syntetizovali jsme analogy Drostanolone enanthate (1) jeho transformací s Cephalosporium aphidicola a Fusarium lini. Metabolity 2-9, stejně jako substrát 1, byly hodnoceny proti HeLa (karcinom děložního hrdla), PC-3 (karcinom prostaty), H460 (rakovina plic), HCT116 (rakovina tlustého střeva), a 3T3 (myší fibroblasty normální) buněčných linií, s použitím high-propustnost cell-based assay, nejvíce efektivní a pohodlné laboratorní metodou MTT assay předpovědět odezvu testovací látky v malignit, kde se ukázala specifičnost proti rakovinné buňky. Tato studie tak identifikovala protirakovinné metabolity Drostanolone enanthate (1) pro další studie.
Materiály a Metody
Instrumentální Analýzy
chromatografie na Tenké vrstvě (TLC) (silikagel, 20 × 20, o tloušťce 0,25 mm, PF254, Merck, Německo) byl použit pro analýzu stupeň transformace a čistota. Pro počáteční čištění metabolitů byla použita kolonová chromatografie silikagelu (70-230 mesh, e. Merck, Německo). Kromě toho byla pro konečné čištění metabolitů použita preparativní recyklace reverzní fáze (JAI LC-908W, Japonsko), vybavená YMC L-80 (4-5 µm, 20-50 mm i.d.). Struktura metabolitů byly objasněny s pomocí 1H- (400, 500 a 600 MHz) a 13C-NMR (100, 125 a 150 MHz) spektra, které byly zaznamenány na Bruker Avance-NMR spektrometry (Francie) v CD3OD, CD3COCD3 nebo DMSO-d6. HREI MS a IČ spekter bylo provedeno na JEOL JMS-600H (Japonsko) (double-se zaměřením magnetické sektoru hmotnostní analyzátor) hmotnostní spektrometr (EI, electron impact ionizace), a Bruker Vektorové 22 FT-IR spektrofotometru. Optické rotace metabolitů byly zaznamenány na polarimetru JASCO P-2000 (Japonsko). Evolution 300 UV-viditelný spektrofotometr byl použit pro záznam UV spekter. Body tání transformovaných produktů byly měřeny pomocí nástroje Buchi M-560 (Švýcarsko). Single-crystal X-ray difrakční data byla shromážděna na Bruker APEXII D8 Podnik difraktometr, vybavené PHOTON 100 detektor (CMOS Technologie) a v pohodě-zaměření uzavřené trubice s X-ray zdroj (Cu Ka záření α = 1.54178 Å). Intenzity odrazu byly integrovány pomocí softwaru SAINT. Korekce absorpce byla provedena na Multi-scan a struktura byla řešena programem SHELXTL (Gerlier a Thomasset, 1986; Sheldrick, 2008; Spek, 2009).
Mikrobiální Kultury
Mikrobiální kultury C aphidicola ATCC 28300 a F. lini NRRL 2204 byly získány z American Type Culture Collection (ATCC) a Severní Regionální Výzkumné Laboratoře (NRRL), resp. Kultury byly pěstovány na Sabouraud dextróza agar (SDA) šikmo, a udržovány při teplotě 4°C.
Média Příprava
Čtyři litr média pro růst C. aphidicola ATCC-28300 byl připraven smícháním 200 g cukru, 4 g KH2PO4, 8 g glycinu, 4 g KCl, 8 g MgSO4.7H2O, a 8 mL stopové prvky ve 4 L destilované vody. Podobně, čtyři litr média byl připraven pro F. lini NRRL 2204 smícháním 40 g glukózy, 20 g kvasničného extraktu, 20 g peptonu, 20 g KH2PO4, 20 g NaCl a 40 mL glycerolu ve 4 L destilované vody.
Kvašení Drostanolone Enanthate (1) s. C. aphidicola ATCC 28300, a F. lini NRRL 2204
Médium pro růst C. aphidicola a F. lini byl připraven smícháním výše uvedených ingrediencí ve 4 L destilované vody za každý houba, který byl poté dávkován rovnoměrně do 40 Erlenmeyerovy baňky 250 mL (100 mL do každé odměrné baňky). Všechny tyto baňky byly autoklávovat při 121°C, a byl naočkován na SDA svažuje C. aphidicola ATCC 28300 a F. lini NRRL 2204 pod sterilizované podmínky. Tyto plísňové kultury obsahující baňky byly ponechány na třepačce (121 min) na 26 ± 2°C po dobu 3-4 dnů, aby se dosáhlo maximální růst C. aphidicola a F. lini. Sloučenina 1 (1 g) byla rozpuštěna ve 20 mL acetonu pro každou houbu a byla dávkována 0,5 mL v každé baňce a znovu umístěna na rotační třepačce po dobu 12 dnů. Negativní kontrola ( střední + plísňová kultura), stejně jako pozitivní kontrola (střední + substrát) byly také připraveny analogicky k vyhodnocení metabolitů hub a degradace sloučeniny 1. Po inkubaci 12 dní, všechny baňky byly filtrovány a extrahovány s 20 L dichlormethanu (DCM), organická fáze byla oddělena, a pak se odpaří za sníženého tlaku na rotační odparce. To přineslo 1,5 g světle nažloutlé pevné suroviny. Tento surový materiál byl frakcionované přes silikagel pro sloupcovou chromatografii tím eluce s gradientem hexany a rozpouštědlo aceton systémy. Sloupcová chromatografie poskytla čtyři hlavní frakce (1-4), které byly poté vyčištěny recyklací HPLC. Metabolity 2 (tR = 16 min, 8 mg, 0.8%), 3 (tR = 19 min, 11 mg, 1.1%), 4 (tR = 17 min, 35 mg, 3.5%), 5 (tR = 23 min, 42 mg, 4.2%), 6 (tR = 20 min, 9 mg, 0.9%), 7 (tR = 21 min, 12 mg, 1,2%) a 9 (tR = 18 min, 5 mg, 0.5%) byli čistí z frakcí 1-7, respektive, a to prostřednictvím reverzní fáze recyklace pomocí HPLC methanol – voda jako rozpouštědlo systém (MeOH: H2O; 70: 30). Vzhledem k tomu, že metabolit 8 byl získán z frakce 8 recyklací HPLC v normální fázi (tR = 32 min ,CHCl3: MeOH; 95: 5, 7.5 mg, 0, 75%).
2α-Methyl-3α,14α,17β-trihydroxy-5α-androstan (2)
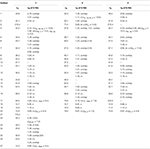
Tabulka 1. Údaje o chemickém posunu 13C – a 1H-NMR (J a W1/2 V Hz) sloučenin 1-3 (δ ppm).
2α-Methyl-7α-hydroxy-5α-androstan-3,17-dionu (3)
2α-Methyl-3α,17β-dihydroxy-5α-androstan (4)
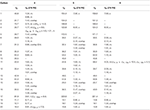
Tabulka 2. Údaje o chemickém posunu 13C – a 1H-NMR (J a W1/2 V Hz) sloučenin 4-6 (δ ppm).
2-Methylandrosta-1,4-dien-3,17-dion (5)
2-Methylandrosta-11α-hydroxy-1,4-dien-3,17-dion (6)
2-Methylandrosta-14α-hydroxy-1,4-dien-3,17-dion (7)
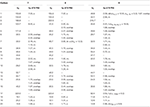
Tabulka 3. Údaje o chemickém posunu 13C-a 1H-NMR (J a W1/2 V Hz) sloučenin 7-9 (δ ppm).
2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
Experimental Protocol for Cytotoxicity
The cytotoxicity of samples was measured against HeLa (human cervical carcinoma ATCC CCl-2), PC-3 (human prostate cancer ATCC CRL-1435), NCl-H460 (human lung carcinoma ATCC HTB-177), HCT116 (human colon cancer ATCC CCl-247), and 3T3 (control fibroblast normal ATCC CRL-1658) cell lines by using standard MTT assay. Buněčné linie byly pěstovány v médiu DMEM F12, doplněné o 10% FBS pod 5% CO2 atmosférou při 37°C v inkubátoru.
kolorimetrický test MTT byl použit pro hodnocení buněčné metabolické aktivity. V tomto testu je žlutý MTT redukován na fialový formazon v mitochondriích živých buněk (Gerlier a Thomasset, 1986). Čím více živých buněk, tím více barvy a tím více absorbance je pozorováno kolorimetrem (Fesahat et al ., 2015). Tuto metodu jsme použili k analýze vlivu našich transformovaných produktů na buněčnou cytotoxicitu proti nádorovým buňkám. Přibližně 10 000 buněk každé buněčné linie (rakoviny HeLa, PC3, H460, hct116 a normální 3T3) bylo naočkováno do 96 jamkových destiček. Po dosažení 80-90% konfluence, byly ošetřeny různými koncentracemi sloučenin (25, 50, 75, 100 a 200 µM) na 24 h. Všechny sloučeniny byly rozpuštěny ve sterilní DMSO, aby se 200 mM zásobní roztok. Roztok byl filtrován a sériová ředění byla provedena v růstovém médiu. 600 µL každého ředění bylo použito k ošetření 3 jamek (trojnásobek každé) 96 jamkové destičky, tj. Každý experiment byl proveden ve třech biologických replikacích. MTT byl přidán, a inkubovány po dobu 4 h. Po odstranění MTT, fialová formazon krystaly byly rozpuštěny v DMSO, a čtení bylo pozorováno na 540 a 570 nm pro normální a rakovinné buňky, respektive. The reader Multiskan dává λmax při 540 nm v DMSO léčených 3T3 fibroblastů buněk (které jsou více splývající v morfologii) vzhledem k tomu, že v případě nádorových buněk, 570 nm dává λmax (Bonmati-Carrion et al., 2013; Danihelová a kol., 2013). V tomto experimentu byla použita široká škála buněčných linií epiteliálních karcinomů, kde cisplatina byla běžným lékem volby. Zaměřuje se na DNA, interferuje s buněčným dělením během mitózy a indukuje apoptózu (Eastman, 1999). Hodnoty IC50 byly vypočteny pro stanovení minimální koncentrace potřebné k usmrcení 50% buněk.
Vzhledem k tomu,
V = hodnota Absorbance zkoušené látky
Ab = Absorbance hodnota prázdná.
Ac = hodnota Absorbance kontroly,
Výsledky a Diskuse
Struktura Objasnění
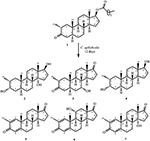
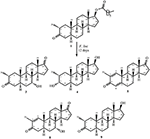
Obrázek 1. Biotransformace Drostanolone enanthate (1) s Cephalosporium aphidicola.
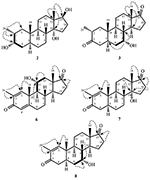
Obrázek 2. Biotransformace Drostanolone enanthate (1) s Fusarium lini.
metabolit 2 byl izolován jako bílé krystaly. Molekulární vzorec C20H30O3 byl založen na HREI-MS, který ukázal at m/z 322.2517 (calcd. 322.2508, C20H34O3), což naznačuje přidání tří vodíků a atomu kyslíku, redukci C-3 ketonického karbonylu a hydrolytické štěpení heptanoátového postranního řetězce v substrátu 1. IR absorbance při 3,531, a 3,423 cm−1 jsou díky přítomnosti hydroxylových skupin. Spektrum 1H-NMR vykazovalo další methinový protonový signál při δ 3,69 (Tabulka 1) (datový list 2). Signály pro heptanoátový postranní řetězec byly také nalezeny chybějící v 1H-NMR spektru sloučeniny 2. Spektrum 13C-NMR vykazovalo signály pro nový methinový uhlík při δ 71.4 a nový kvartérní uhlík při δ 84.8. Uhlíkové signály pro heptanoátový řetězec a ketonický karbonyl byly také nalezeny chybějící ve spektru 13C-NMR. Toto navrhlo snížení C-3 karbonyl, hydrolytickou ztrátu heptanoátového řetězce a přidání OH na C-14 (Tabulka 1). OH skupiny byl umístěn na C-3 na základě HMBC korelace H3-20 (δ 0.91, d) s C-3 (δ 71.4) (Obrázek 3). To vyplynulo z redukce C-3 karbonylu. Druhá skupina OH byla umístěna na C-14, na základě HMBC korelace H3-18 (δ 0.81, s) S C-14 (δ 84.8). Třetí OH byl na C-17, výsledkem hydrolytické ztráty heptanoátové skupiny. Skupina O-H V C-3 byla odvozena jako α-orientovaná na základě noesových korelací H-3 (δ 3.69, br. s) s β-orientovaným H-2 (δ 1,64, překrytí) a α-orientovaným H3-20 (δ 0,91, d) (obrázek 4). OH-14 byla odvozena α-orientovaný, na základě NOESY korelací H-9 (δ 1.32, m) s OH-14 (δ 2.66, y) (aceton-d6). Single-crystal X-ray difrakční analýzy dále podporován strukturu metabolitu 2, který se skládá ze tří kroužků v křesle konformaci (a, B a C), a jeden obklopují konformaci (D). Byly přiřazeny tři skupiny OH v C-3, C-14 A C-17, α -, α-a β-orientace (obrázek 5). Monokrystalická difrakční data metabolitu 2 byla předložena Cambridge Crystallographic Data Collection (CCDC 1500706). Struktura metabolitu 2 byla tedy odvozena jako 2α-methyl-3α,14α,17β-trihydroxy-5α-androstan.
obrázek 3. Klíčové HMBC (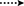 ) a COSY (
) a COSY ( ) korelace v nových metabolitech.
) korelace v nových metabolitech.
Obrázek 4. Klíčové korelace NOESY v nových metabolitech.
Metabolitu 3 byl získán jako bílá pevná látka. Hrei-MS zobrazil at m / z 318.2192 (calcd. 318.2195, C20H30O3). To představovalo ztrátu heptanoátového postranního řetězce a přidání atomu kyslíku v substrátu 1. IR spektrum vykazovalo absorbance pro OH (3 436 cm-1) a ketonické karbonyly (1 711 cm−1). Ve spektru 1H-NMR byly zjištěny chybějící signály heptanoátového řetězce A C-17 methinového protonu, zatímco nový signál methinového protonu byl pozorován při δ 3.92 (Tabulka 1) (datový list 3). To naznačuje hydroxylaci steroidní kostry a oxidační štěpení heptanoátové části. Spektrum 13C-NMR také podporovalo výše uvedené závěry. Uhlíkové signály pro heptanoátovou část byly nalezeny chybějící, zatímco nové ketonické karbonylové a oxy-methinové signály se objevily ve spektru 13C-NMR (Tabulka 1). To indikovalo oxidační štěpení heptanoátového řetězce a hydroxylaci v substrátu 1. Nově se objevil tzv. methenylové protonem při δ 3.92 (H-7), ukázal, HMBC korelace s C-5 a C-8, což naznačuje, OH na C-7 (viz Obrázek 3). HMBC korelace H3-18 a H2-16 s uhlíkem při δ 223.8 naznačovaly ketonický uhlík při C-17. OH u C-7 byl dále podpořen vzájemnou korelací H-7 s H2-6 A H-8. H-7 (δ 3.92, y) ukázal, NOESY korelace s axiálně orientovaný H-8 (δ 1.70, překrývají), které naznačují α-orientace z – v, C-7 (viz Obrázek 4). Struktura metabolitu 3 byla tedy odvozena jako 2α-methyl-7α-hydroxy-5α-androstan-3,17-Dion.
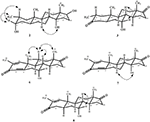
Monokrystalové rentgenové difrakční analýzy byly také provedeny na sloučeninách 1 a 5. Sloučenina 1 se skládala ze čtyř kroužků, tj. A, B, C A D s konformacemi židle, židle, židle a obálky. Methyl byl přítomen na C-2 s Rovníkovou orientací. Řetězec esteru heptanoátu byl přítomen v C-17 kruhu D (obrázek 6). Zatímco metabolit 5 obsahuje kroužky a, B, C A D v hoblíku, křesle, křesle a obálkách. Postranní řetězec heptanoátu chyběl v metabolitu 5 (Obrázek 7). Monokrystalická difrakční data metabolitů 1 a 5 byla předložena ke sběru krystalografických dat v Cambridge (CCDC 1500705 a CCDC 1500707). Jednokrystalová rentgenová difrakční analýza dat sloučenin 1, 2 a 5 je uvedena v tabulce 4.
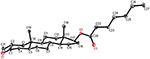
obrázek 6. Počítačem generovaný ORTEP výkres konečného rentgenového modelu sloučeniny 1. Barevné kódy: uhlík, Černá; kyslík, červená.
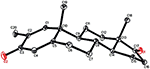
Obrázek 7. Počítačem generovaný ORTEP výkres konečného rentgenového modelu sloučeniny 5. Barevné kódy: uhlík, Černá; kyslík, červená.

Tabulka 4. Jednokrystalová rentgenová difrakční analýza sloučenin 1, 2 a 5.
Cytotoxicitu vůči HeLa, PC3, H640, a HCT116 Rakovinu, a 3T3 Normální Buněčné Linie
Přírodní produkty, např. flavonoidy, steroidy, terpeny, atd. může sloužit jako vynikající zdroj pro výrobu mnoha léků, protože jsou uváděny pro mnoho biologických aktivit, jako jsou protirakovinné, protizánětlivé, anti-leishmaniální, antibakteriální aktivity atd. Proto je nutné je derivatizovat, studovat vztah struktura-aktivita, který by mohl být užitečný pro syntézu bezpečných a účinných léků. V současné době je mnoho farmaceutických produktů účinně syntetizováno mikrobiální biotransformací kvůli přítomnosti řady enzymů v nich. Na základě hlášených anti-rakovina činnosti drostanolone (9), drostanolone propionát, a drostanolone heptanoate (1), sloučeniny 1-9 byly hodnoceny na cytotoxicitu vůči HeLa, PC-3, H460, a HCT116 nádorových buněčných linií. Je zajímavé, že všechny sloučeniny vykazovaly střední až silnou protirakovinovou aktivitu. Anti-rakovina činnosti sloučenin 1-9 byly odvozeny z hodnoty IC50 proti HeLa (lidský cervikální karcinom), PC-3 (lidská rakovina prostaty), H460 (lidská rakovina plic), a HCT116 (lidská rakovina tlustého střeva) (Tabulka 5). Na základě těchto výsledků cytotoxicity těchto látek byla také hodnocena proti 3T3 (myší fibroblasty) normální buněčné linie, kde jsou všechny sloučeniny, s výjimkou 8 (IC50 = 74.6 ± 3.7 µM) a 9 (IC50 = 62.1 ± 1,2 µM), bylo zjištěno, že non-cytotoxické.

Tabulka 5. Cytotoxicita sloučenin 1-9 proti rakovině HeLa, PC3, H460 a HCT116 a normálním buněčným liniím 3T3.
Struktura-Aktivita Vztah
Změny ve struktuře metabolitů provedeno jejich protirakovinné aktivity. Metabolit 2 s absencí ester část, a dvě aO-H skupiny na C-3 a C-14 a ßO-H skupinou na C-17 vykazovaly nižší cytotoxicitu vůči HeLa, H460, a HCT116 nádorových buněčných linií, ale jeho anti-rakovina činnosti byla vyšší proti PC-3 nádorových buněčných linií, ve srovnání se sloučeninou 1. Metabolit 3 se ztrátou ester skupiny a dvě keto skupiny na C-3 a C-17, a aO-H skupinou na C-7 také vykazovala nižší aktivitu proti HeLa, H460, a HCT116 nádorových buněčných linií, ale zvýšená aktivita proti PC-3 nádorových buněčných linií ve srovnání se substrátem 1. Snížení C-3 karbonylové O-H a hydrolytické štěpení esterových složkou v krmných 4 zvýšil svou aktivitu proti HeLa a PC-3 nádorových buněčných linií, do určité míry, ale jeho anti-rakovina činnosti proti H460, a HCT116 nádorových buněčných linií, se snížil v porovnání se substrátem 1. Přítomnost C = C mezi C-1/C-2 a C-4/C-5, C = O na C-3 a C-17 vyrobeny metabolitu 5 silný anti-rakovina činidlo proti HeLa nádorových buněčných linií, ve srovnání se substrátem 1 a standardní léčivem (cisplatina). Kromě toho byla také zvýšena jeho protinádorová aktivita proti buněčné linii rakoviny PC-3 ve srovnání se substrátem 1. Zajímavé je, že jeho protirakovinná aktivita proti h460 a hct116 rakovinných buněčných linií byla nižší ve srovnání se sloučeninou 1. Přítomnost C = C mezi C-1/C-2 a C-4/C-5, C = O na C-3 a C-17, spolu s aO-H skupina na C-11 v metabolitu 6 zvýšil jeho anti-rakovina aktivitu proti HeLa a PC-3 nádorových linií ve srovnání se substrátem 1 a vykazovaly podobné anti-rakovina potenciál proti HeLa nádorových buněk linie jako standardní lék (cisplatina). Nicméně, jeho Protirakovinné aktivity proti H460, a hct116 rakovinných buněčných linií se snížil ve srovnání se sloučeninou 1. Přítomnost C = C mezi C-1/C-2 a C-4/C-5, C = O na C-3 a C-17, spolu s aO-H skupinou na C-14 v metabolitu 7 opět zvýšila jeho anti-rakovina aktivitu proti HeLa a PC-3 nádorových buněčných linií, a snížil jeho anti-rakovina činnosti proti H460, a HCT116 buněčných linií ve srovnání se substrátem 1. Přítomnost C = C C-1/C-2, C = O na C-3 a C-17, a aOH na C-7 metabolitu 8 nejsilnějších anti-rakovina, proti HeLa nádorových buněčných linií ve srovnání se substrátem 1 a standardní léčivem (cisplatina). Rovněž vykazoval dobrou aktivitu proti buněčné linii rakoviny PC-3, ale snížil protirakovinovou aktivitu proti h460 a hct116 rakovinné buněčné linie ve srovnání se substrátem 1. Metabolit 9 pouze s hydrolýzou na C-17 prokázaly zvýšenou anti-rakovina aktivitu proti HeLa, PC-3, a HCT116 nádorových buněčných linií, ale snížená cytotoxicita proti H460 rakovinné buněčné linie ve srovnání se substrátem 1 a standardní léčivem (cisplatina). Na základě výše uvedené diskuse lze dospět k závěru, že zvýšená aktivita anti-karcinom sloučeniny 5-8 proti HeLa a PC-3 nádorových buněk linie byla pravděpodobně vzhledem k přítomnosti C = C C-1/C-2, a karbonylové keton na C-3 a C-17 v porovnání se substrátem 1.
závěr
autorské příspěvky
koncept prezentovaného výzkumu byl vyvinut a navržen MIC. MIC byl také vedoucím projektu. Všechna data byla analyzována a interpretována MIC, A-t-W a HC. MS, sy, MA a NF provedly experimenty. MIC, A-t-W, A MS napsali rukopis. Všichni autoři rukopis revidovali. Konečná verze rukopisu byla také schválena MIC před odesláním.
Prohlášení o střetu zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být vykládány jako potenciální střet zájmů.
Poděkování
V-W, a MIKROFON na vědomí, umožňující roli Vysokoškolského Vzdělávání Komise v Islámábádu, Pákistán, přes finanční podporu v rámci, „Studie o Chemoprevention Mléčné Karcinogeneze o Dietní Agentů, (20-3790/NRPU/R&D/HEC/13/793).“SY uznává finanční podporu OPCW (organizace pro zákaz chemických zbraní) prostřednictvím výzkumného projektu s názvem „strukturální a biologické studie nových anabolických steroidů získaných biotransformací.“HC uznává finanční podporu“ děkanství vědeckého výzkumu (DSR), King Abdulaziz University, Ministerstvo školství, Saúdská Arábie.“
doplňkový materiál
Eastman, a. (1999). „Mechanismus účinku cisplatiny: od aduktů po apoptózu,“ v cisplatině: Chemie a biochemie předního protinádorového léčiva, ed B. Lippert (Zürich: Verlag Helvetica Chimica Acta), 111-134. doi: 10.1002/9783906390420.ch4
CrossRef Plný Text | Google Scholar
Vardar, E., Vardar, S. a., a Cengiz, T. (2002). Anabolické androgenní zneužívání steroidů. Anato. J. Psychiatrie 3, 104-107.