Introduction
Les fuites d’air pulmonaires prolongées sont fréquentes et peuvent entraîner un niveau élevé de morbidité, des séjours prolongés à l’hôpital, des complications infectieuses et cardiopulmonaires.1,2
Bien qu’il existe des variations entre les différents auteurs dans leur définition des fuites d’air, des études récentes sur la lobectomie pulmonaire ont établi une durée moyenne approximative de séjour à l’hôpital de 5 jours; il a donc été proposé qu’une fuite d’air persistante soit définie comme une fuite d’air qui dure au-delà du cinquième jour postopératoire.3 En fait, cela est conforme à la définition de la base de données de la Society of Thoracic Surgeons, qui fait référence aux fuites d’air persistantes comme celles qui se présentent généralement lorsque le patient serait autrement déchargé s’il n’y avait pas de fuite d’air continue.
La grande majorité des fuites d’air postopératoires sont des fuites d’air alvéolaires; ceci est pertinent car la prise en charge de celles-ci est très différente de la prise en charge de la fistule bronchopleurale qui nécessite souvent une intervention chirurgicale immédiate.3
Le facteur de risque de fuite d’air prolongée le plus systématiquement identifié est la maladie pulmonaire obstructive chronique,4 un faible volume expiratoire forcé à la 1ère seconde et un faible pourcentage maximal de ventilation volontaire.5,6
Les options de traitement des fuites d’air prolongées comprennent une attente vigilante avec drainage continu à travers un tube de thoracostomie, une pleurodèse 6, des interventions chirurgicales 2 ainsi que l’utilisation de techniques endoscopiques.
Les approches endobronchiques comprennent l’application de mousse de gel, l’utilisation de colle de fibrine, de bobines ou de valves endobronchiques.1,7 Généralement, le gonflage du cathéter à ballonnet est utilisé pour identifier la ou les voies respiratoires segmentaires ou sous-segmentaires responsables de la fuite d’air.8 Schweigert et coll.9 ont rapporté une méthode différente utilisant du bleu de méthylène via les tubes thoraciques. Nous décrivons un cas de fuite d’air persistante traitée par placement de valves endobronchiques dans des segments identifiés à l’aide de bleu de méthylène via le tube thoracique.
Rapport de cas
Un homme de 68 ans présentait une toux, une perte de poids et une masse pulmonaire dans le lobe moyen droit (ML).
Il était un ancien fumeur avec un historique de tabagisme de 45 ans et, au cours de sa vie professionnelle, il avait été exposé à l’amiante pendant de nombreuses années. Ses antécédents médicaux comprenaient une prostatectomie due à un cancer de la prostate 6 ans plus tôt, sans preuve de récidive.
Un adénocarcinome pulmonaire a été diagnostiqué par biopsie par aspiration à l’aiguille transthoracique de la lésion ML et la tomographie par émission de positons – tomodensitométrie (TEP/ TDM) réalisée pour la stadification, a révélé une absorption de fluorodésoxyglucose (FDG) non seulement sur la masse ML (valeur maximale d’absorption normalisée (SUVmax) -11) mais également sur la plèvre droite, ce qui a conduit à des investigations pleurales supplémentaires avec de multiples biopsies négatives pour les cellules malignes. Il a été mis en scène T2N0M0 et a été soumis à une intervention chirurgicale
Une thoracotomie avec une lobectomie médiane droite, qui comprenait une division du ligament triangulaire plus une lymphadénectomie systématique a été réalisée et, comme des plaques pleurales ont été trouvées au cours de la procédure, elles ont été enlevées et une décortication pleurale du lobe inférieur droit a été réalisée.
La pathologie a confirmé un adénocarcinome pT1bN0R0, sans signe d’atteinte maligne pleurale, mais une pleurite fibrineuse chronique a également été diagnostiquée.
L’extubation du patient était possible peu de temps après l’opération et il n’y avait pas besoin de ventilation mécanique postopératoire. La kinésithérapie qui est une intervention de routine et largement reconnue visant à améliorer l’expansion pulmonaire a été lancée dès que possible.
Bien que l’expansion pulmonaire ait été atteinte en 2 jours, une fuite d’air a été identifiée et l’aspiration nécessaire pour maintenir l’expansion pulmonaire a été poursuivie pendant dix jours de plus jusqu’à ce qu’il n’y ait pas de fuite d’air visible pendant la respiration de marée normale. À ce stade, l’aspiration a été arrêtée et les tubes ont été serrés après 2 jours. Comme il n’y avait pas de compromis clinique, pas d’aggravation du pneumothorax ni d’augmentation de l’air sous-cutané, le tube thoracique a été retiré (Fig. 1), et le patient est sorti de l’hôpital dans les 48h.
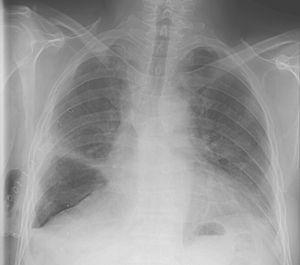
Radiographie thoracique le 12e jour après la lobectomie médiane droite et 24h après la remotion du tube thoracique.
Deux semaines après la sortie de l’hôpital – 1 mois après la chirurgie – il a été réadmis avec les symptômes cliniques d’une infection thoracique. Une tomodensitométrie du thorax a montré un grand hidropneumothorax antérieur droit, une épaisseur pleurale et un emphysème sous-cutané. Un empyème et une fuite d’air postopératoire ont été diagnostiqués. Des antibiotiques à large spectre ont été initiés, une sonde thoracique a été immédiatement mise en place et une bronchofibroscopie a été utilisée pour évaluer l’intégrité du moignon et l’absence d’autres complications endobronchiques. Malgré ces mesures, le patient a subi une décortication pleuro-pulmonaire, compliquée par des adhérences pleurales denses. Au cours de la procédure, une suture des lacérations pulmonaires a été réalisée et le spray Tissucol® a été utilisé pour contrôler les fuites d’air. Bien que l’état de santé clinique et les paramètres d’infection se soient initialement améliorés, le patient présentait une fuite d’air persistante avec un pneumothorax asymptomatique stable sur joint d’étanchéité à l’eau qui augmentait chaque fois qu’une aspiration négative était suspendue et que le drain thoracique était laissé en drainage libre.
Une attente vigilante avec drainage continu à travers un tube thoracique a été maintenue pendant 2 mois, pendant cette période, jusqu’à ce que la fuite d’air semble être résolue et que le patient puisse tolérer que le drain soit serré; une pleurodèse au talc à travers le tube thoracique a été tentée sans résultats satisfaisants.
Une approche endoscopique a été essayée pour gérer la fuite d’air. Un cathéter à ballonnet introduit par le bronchoscope a été gonflé sur différents segments pendant que l’observation du système de drainage thoracique évaluait la fuite d’air. Une réduction de la fuite d’air semblait être obtenue lorsque les segments B7 et B8 du lobe inférieur droit étaient occlus et que des valves (Zephyr EBV) étaient placées dans ces segments. Les valves endobronchiques ont été mises en place à l’aide d’un cathéter flexible. Les valves ont été comprimées dans l’extrémité distale du cathéter d’administration à l’aide d’un chargeur de valves fourni avec le système. Le cathéter d’administration a ensuite été passé à travers le canal de travail d’un bronchoscope adulte standard (>diamètre intérieur de 2,8 mm) et guidé vers les voies respiratoires cibles. Une fois en place, la vanne a été déployée. Cependant, cela n’a permis que de réduire la fuite d’air.
Trois semaines plus tard (4 mois après la chirurgie initiale), une thoracomyoplastie à l’aide d’un lambeau droit de l’abdomen pour effacer l’espace pleural a été réalisée et les valves endobronchiques ont été retirées. Trois semaines après cette chirurgie ultérieure, il était possible de serrer et de retirer le tube thoracique sans aggravation clinique ou radiologique.
Malheureusement, deux semaines plus tard, le patient a été réadmis avec une détresse respiratoire et un pneumothorax, de sorte qu’un tube thoracique a été remis en place et maintenu sous aspiration (Fig. 2). Le patient n’était pas cliniquement apte à la chirurgie, une approche endoscopique a donc été tentée à nouveau.

Tomodensitométrie thoracique montrant une cavité pleurale avec un tube thoracique à l’intérieur et un épaississement pleural.
Cette fois, l’instillation de bleu de méthylène (1 ampoule diluée dans une solution saline de 1 litre) via le tube thoracique a été utilisée pour localiser le segment bronchique menant à la fistule. Pendant que la solution bleue était instillée, un autre clinicien a regardé à travers le bronchoscope et a regardé la solution bleue apparaître sur les segments menant à la fistule. Les segments B6 et B7 ont été identifiés visuellement (Fig. 3) et des valves endobronchiques ont été mises en place comme décrit ci-dessus.
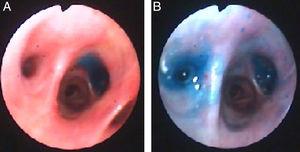
Bleu de méthylène sur les segments B7 (Panneau A) et B6 (panneau B) du lobe inférieur droit après instillation à travers le tube thoracique.
Après la procédure, la taille de la fuite d’air semblait être réduite et le serrage a été tenté. Comme il n’y avait aucune preuve d’aggravation du pneumothorax, de développement progressif de l’air sous-cutané ou de dyspnée, le tube thoracique a été retiré.
L’état de santé du patient s’est lentement amélioré et il est sorti de l’hôpital. Lors du suivi, des métastases ont été trouvées sur les deux poumons et le patient est décédé 8 mois plus tard.
Discussion
Les auteurs décrivent un cas de fuite d’air persistante après résection pulmonaire. Les fuites d’air sont un problème courant souvent associé à des séjours hospitaliers prolongés, à des complications infectieuses et cardiopulmonaires, et elles nécessitent occasionnellement une réopération3 et /ou des techniques bronchoscopiques.
Le patient présenté présentait plusieurs facteurs de risque de développement d’une fuite d’air puisqu’il était atteint d’une bronchopneumopathie chronique obstructive,10 et d’une importance particulière dans ce cas, la présence d’adhérences pleurales importantes.5,11 Il est fort probable que les adhérences pleurales étaient liées à son exposition connue à l’amiante à l’âge adulte.
Les options de traitement des fuites d’air comprennent l’attente vigilante, les interventions chirurgicales ainsi que la thérapie médicale comme la pleurodèse, et en particulier l’utilisation de différentes techniques de bronchoscopie telles que les colles, les bobines et les mastics. Le succès a été variable et il ne semble pas y avoir de thérapie optimale. Les interventions possibles actuelles semblent être complémentaires et le traitement doit être individualisé.7 Il n’existe pas d’études contrôlées comparant les différentes approches.
Dans le cas présent, la première option était une intervention chirurgicale car une thoracotomie était nécessaire pour contrôler l’infection qui ne répondait pas aux antibiotiques et pour le drainage par le tube thoracique. Pendant la chirurgie, on a tenté de fermer le site de la fuite d’air et le spray Tissucol® a été utilisé, mais il a persisté même après une période d’attente de plusieurs semaines.
Une pleurodèse chimique a ensuite été tentée. L’instillation d’un agent sclérosant dans l’espace pleural à travers le tube de thoracostomie favorise la symphyse pleurale, ce qui peut conduire à la fermeture des fuites,12 mais comme le montre la littérature n’a pas été très efficace.
La présence d’empyème postopératoire où la décortication a échoué et la présence de fistules bronchiques sont actuellement considérées comme des indications pour les procédures de thoracomyoplastie.13 Il permet l’oblitération complète et définitive de l’espace pleural infecté par une combinaison de thoracoplastie et l’utilisation de lambeaux musculaires de voisinage (latissimus dorsi, serratus anterior, pectoralis, rectus abdominis, etc.).
Cela s’est produit dans ce cas mais, bien que des publications récentes montrent un taux de réussite global de 90%, avec une guérison rapide et définitive, cela n’a été efficace que pour contrôler l’infection et non la fistule.
Les approches bronchoscopiques de la gestion des fuites d’air pulmonaires sont devenues plus populaires non seulement comme outils de diagnostic mais aussi comme outils thérapeutiques.
Afin de gérer avec succès une fistule avec des techniques bronchoscopiques, la fistule doit être directement visualisée (fistules proximales) et il doit y avoir des preuves que l’occlusion a considérablement diminué ou que la fuite d’air s’est arrêtée. La technique la plus couramment utilisée pour localiser le segment bronchique menant aux fistules distales est l’utilisation de ballons, comme le cathéter Swan-Ganz, pour obstruer systématiquement les segments bronchiaux8 avec observation simultanée du système de drainage thoracique pour évaluer la fuite d’air. Cette méthode peut s’avérer difficile chez les patients présentant de petites fuites d’air qui ne sont présentes que lorsqu’ils toussent et non pendant une respiration volumique normale.
Bien que le bleu de méthylène soit utilisé depuis de nombreuses années pour diagnostiquer la présence de fistules, par instillation à travers le moignon et s’il est détecté dans le tube thoracique, il peut confirmer une fistule brochopleurale, son utilisation pour localiser le segment bronchique menant à la fistule n’a été décrite qu’en 2011.9 Le bleu de méthylène a été utilisé via le tube thoracique et immédiatement après l’instillation, si une fistule était présente; le bleu de méthylène a pu être vu par le bronchoscopiste sur le segment bronchique menant à la fistule.
Chez notre patient, l’utilisation du bleu de méthylène a permis l’identification de deux segments bronchiques impliqués dans la fuite d’air, l’un commun à celui identifié par la méthode du ballon mais également un autre insoupçonné par la technique précédente.
Après l’identification du segment bronchique, plusieurs approches peuvent être envisagées, notamment l’application de mousse de gel, l’utilisation de colle de fibrine, la mise en place de bobines, de stents et de valves endobronchiques.7 Il n’existe aucune étude contrôlée pour déterminer laquelle de ces études est la plus efficace ou la plus sûre. Travaline et coll.1 a montré que l’implantation de valves unidirectionnelles endobronchiques (Zephyr EBV) était efficace chez un grand nombre de patients présentant des fuites d’air prolongées. L’arrêt complet de la fuite d’air a été atteint chez 48% des patients et la diminution de l’ampleur chez 45%.
Dans ce cas, l’implantation d’une valve Zéphyr sur les segments B6 et B7, en association avec la cicatrisation pleurale et l’épaississement, a suffisamment diminué l’ampleur de la fuite d’air pour que le tube thoracique puisse être retiré. Ces approches non chirurgicales semblent prometteuses et, pour certains patients, peuvent être la seule option de traitement. Les auteurs souhaitent mettre l’accent sur l’utilisation du bleu de méthylène via le tube thoracique pour identifier les segments de la fuite d’air persistante et guider le placement des valves endobronchiques.
Divulgations éthiques
Protection des sujets humains et animaux. Les auteurs déclarent qu’aucune expérience n’a été réalisée sur des humains ou des animaux pour cette étude.
Confidentialité des données. Les auteurs déclarent avoir suivi les protocoles de leur centre de travail sur la publication des données des patients et que tous les patients inclus dans l’étude ont reçu suffisamment d’informations et ont donné leur consentement éclairé écrit pour participer à l’étude.