biologiske olier adskiller sig fra petroleumsolier (“almindeligt” dieselbrændstof) i molekylær struktur og egenskaber.

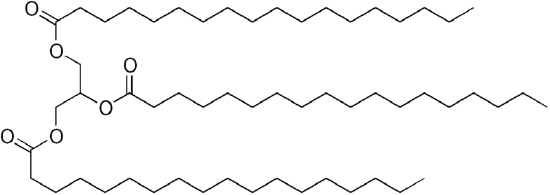
Common petroleum diesel fuel er en blanding af enkle kulbrinter med den gennemsnitlige kemiske formel C12H23 (vist nedenfor), men komponenter kan variere Ca.fra c10h20 (dodecan) til c15h28(pentadecan). I modsætning hertil er biologiske olier ” triglycerider “(klassificeret som “estere”) som glyceryltrilinoleat vist nedenfor:
| C12H23, dodecane | a triglycerid: glyceryltrilinoleat |
på grund af deres store størrelse og deraf følgende store intermolekylære attraktioner er viskositeten af biologiske olier generelt for høj til brug i konventionelle dieselmotorer. Biologiske olier brænder også lidt mindre let og med en sooter flamme end petroleumsdiesel. Biologiske olier kan bruges i konventionelle dieselmotorer, hvis de forvarmes for at reducere deres viskositet, men dette kræver en ekstra elektrisk varmelegeme, indtil motoren opvarmes. For disse resoner kræver bilogiske olier behandling til brug som biodiesel.
en biologisk olie er en ester, som er en type organisk forbindelse med atomforbindelsen vist nedenfor.
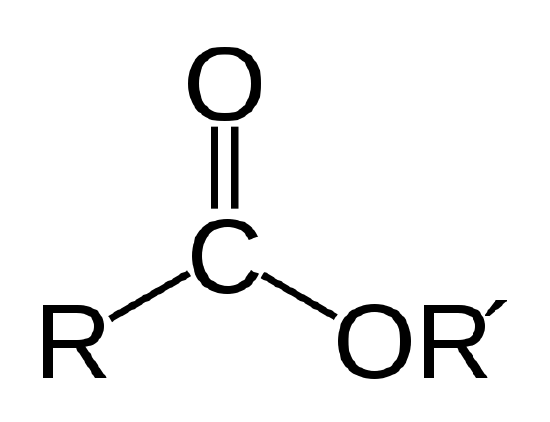 esterforbindelsen. R og R’ repræsenterer kæder af carbon-og hydrogenatomer. R = -CH3 og R’ = -C18H35O2 for methylstearatet I eksempel 1 |
glycerol |
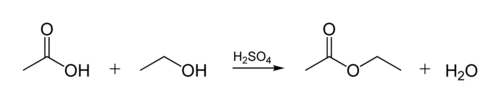
esterforbindelsen i biologiske olier oprettes når et glycerolmolekyle reagerer med organiske syrer. Glycerolmolekylet har en kæde af 3 carbonatomer, hver med en-OH (alkohol) gruppe på den. Figuren nedenfor viser, hvordan en organisk alkohol reagerer med en organisk syre. Organiske kemikere forkorter molekylære strukturer-” siksag “-linjerne i figuren repræsenterer carbonkæder med et C-atom ved hver” siks “eller”siks”. Hvert kulstof har 4 bindinger, og hvis færre end 4 vises, antages det, at de går til H-atomer. Så alkoholen er C2H5OH (ethanol), og syren er eddikesyre (eller ethansyre, CH3COOH) i figuren:
da glycerol har 3-OH-grupper, fastgøres 3 langkædede organiske “fedtsyrer” for at gøre det omfangsrige “triglycerid”.
men lige så let som estere kan fremstilles af alkoholer og syrer, kan de skifte alkoholer eller syrer. I nærvær af en stærk basekatalysator, som NaOH, kan et triglycerid reagere med 3 små alkoholmolekyler, som methanol (CH3OH), som erstatter glycerol “rygraden”, hvilket gør 3 separate estere med lavere molekylvægt
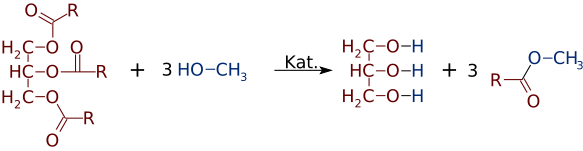
ganske ofte dannes en blanding af to eller flere produkter. For eksempel, når en vegetabilsk olie reagerer med methanol, kan kun en eller to af syrerne forskydes fra glycerinet og producerer kun 1 eller 2 FAMEs.
C3H5(C18H35O2)3 + NaOH + 2 CH3OH-C3H5(C18H35O2)2(OH) + 2 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 1 CH3OH-C3H5(C18H35O2)(OH)2 + 1 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 3 CH3OH C3H5(Oh)3 + 3 C17h35cooch3
normalt tilsættes et stort overskud af methanol og NATRIUMHYDROKSID, således at reaktionen producerer den maksimale mængde berømmelse.
men i tilfælde af en transesterificering, selvom ingen af reaktanterne forbruges fuldstændigt, forekommer der ingen yderligere stigning i mængderne af produkterne. Vi siger, at en sådan reaktion ikke går til færdiggørelse. Når en blanding af produkter fremstilles, eller en reaktion ikke går til færdiggørelse, vurderes reaktionens effektivitet sædvanligvis i procent udbytte af det ønskede produkt. Et teoretisk udbytte beregnes ved at antage, at alt det begrænsende reagens omdannes til produkt. Den eksperimentelt bestemte masse af produktet sammenlignes derefter med det teoretiske udbytte og udtrykkes som en procentdel:

eksempel 1 Når 100,0 g C3H5(C18H35O2)3 gas og 15,0 g CH3OH blandes ved 55 liter C med NaOH-katalysator, reagerer de til dannelse af 90,96 g c17h35cooch3 methylstearat biodiesel. Beregn procentudbyttet.
løsning vi skal beregne det teoretiske udbytte af NH3, og for at gøre dette skal vi først opdage, om N2 eller H2 er det begrænsende reagens. For den afbalancerede ligning
C3H5(C18H35O2)3 + NaOH + 3 CH3OH-kur C3H5(OH)3 + 3 C17H35COOCH3 stearin + natriumhydroksid + 3 CH3OH-kur glycerol + 3-methylstearat
det støkiometriske forhold mellem reaktanterne er
 nu er de indledende mængder af de to reagenser og
nu er de indledende mængder af de to reagenser og forholdet mellem indledende mængder er således
forholdet mellem indledende mængder er således da dette forhold er mindre end
da dette forhold er mindre end , er der et overskud af CH3OH. Stearin er det begrænsende reagens. Derfor skal vi bruge 0.1122 mol stearin og 0.3366 mol CH3OH (snarere end 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have
, er der et overskud af CH3OH. Stearin er det begrænsende reagens. Derfor skal vi bruge 0.1122 mol stearin og 0.3366 mol CH3OH (snarere end 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have so that
so that We can organize these calculations in a table:
We can organize these calculations in a table:
| C3H5(C18H35O2)3(s) | + 3 CH3OH (l) | → 1 C3H5(OH)3 (l) | + 3 C18H35O2)3CH3(s) | ||
|---|---|---|---|---|---|
| m, g | 100.0 g | 15.00 g | 90.96 g | ||
| M, g/mol | 891.5 | 32.04 | 298.5 | 92.1 | |
| n present, mol | 0.1122 mol | 0.4682 mol | |||
| n actual, mol | 0.1122 | 0.3366 | 0.1122 | 0.3366 | |
| m actual, mass | 100.0 | 10.78 | 10.33 | 100.47 |
The percent yield is then
Transesterification is a classic example of a reaction which does not go to completion.