Der er eksperimentelle metoder til påvisning af uparrede elektroner. Et af kendetegnene ved uparrede elektroner i materialer er interaktion med et magnetfelt. Denne interaktion kan bruges til at give information om forbindelser, der indeholder uparrede elektroner.
Elektronparamagnetisk resonans
Elektronparamagnetisk resonans (EPR) eller elektronspinresonans (ESR) er en spektroskopisk metode. Det afhænger af den energiske adskillelse af to spin-tilstande, der kun eksisterer i nærværelse af et magnetfelt.
EPR er meget tæt forbundet med en anden almindelig type spinresonansspektroskopi, NMR.
Spin er en kvanteegenskab, der ikke har nogen reel analogi, der ville give mening for os på et makroskopisk niveau. Vi ved dog, at spin har forbundet med det magnetiske egenskaber. En elektron kan have en af to værdier for disse magnetiske egenskaber. Der er forskellige mærker givet til disse værdier: nogle gange “op” og “ned”, nogle gange +1/2 og -1/2. Men uanset hvilken værdi af spin en elektron besidder gør ingen forskel energisk.
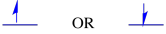
de to mulige spintilstande er de samme energisk-medmindre et magnetfelt er til stede. Når denne situation opstår, er der en energisk adskillelse mellem de to stater.
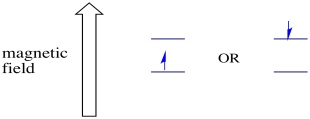
i nærvær af et magnetfelt adskilles de to spintilstande i to forskellige energiniveauer. Mængden af adskillelse mellem energiniveauerne afhænger af magnetfeltets størrelse. Jo stærkere magnetfeltet er, desto større er adskillelsen.
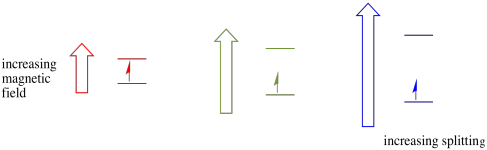
denne sag gælder kun for uparrede spins. Husk, at uparrede spins interagerer med et magnetfelt. Hvis alt er spin-parret, sker der intet. Det er meget nyttigt, fordi det giver os en måde at opdage de uparrede elektroner på.
en elektron i en spin-tilstand kan stadig være begejstret for den anden ved absorbansen af en foton. Alternativt kan en elektron i højere tilstand falde ned til den nederste, hvis den frigiver en foton.
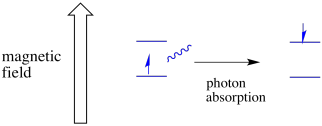
for at noget af dette skal ske, skal fotonens energi nøjagtigt matche energiforskellen mellem tilstande. Denne Goldilocks-regel kaldes resonansbetingelsen. Mængden af energi, der leveres til at hoppe fra et energiniveau til det næste, skal være helt rigtigt. For lidt energi og elektronen vil ikke gøre det. For meget energi og elektronen vil heller ikke gøre det. Det venter på den helt rigtige foton.
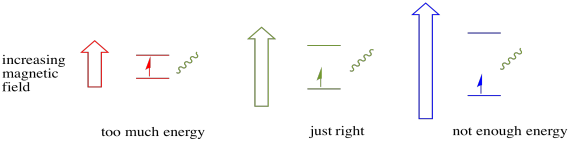
hvor meget energi har en foton? Husk dit Planck-Einstein-forhold. Den beskrev en fotons energi:
\(E=h \nu\)
E er fotonens energi, h er Plancks konstant (6.625 gange 10-34 Js), og prisT er fotonens frekvens (det ligner en romersk vee, men det er det græske bogstav, nu).
alternativt på grund af forholdet mellem bølgelængde og frekvens:
\(E= \ frac{HC}{\lambda}\)
de nye mængder er c, lysets hastighed (3,0 gange 108 m s-1) og liter, fotonens bølgelængde.
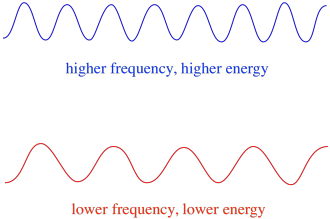
så generelt leverer forskellige bølgelængder af lys forskellige mængder energi. Blåt lys med en bølgelængde tæt på 475 nm har mere energi end rødt lys med en bølgelængde tæt på 700 nm.
i EPR er det generelle interval for elektromagnetisk stråling eller den generelle type foton mikrobølgestråling. Frekvensen af disse fotoner er omkring 9 eller 10 GG. (En anden type spektroskopi, rotationsspektroskopi, måler også absorbansen af mikrobølger. Det bruger typisk noget højere frekvenser af mikrobølger. Rotationsspektroskopi giver strukturel eller bindingsinformation om molekyler i gasfasen.)
afhængigt af miljøet i den uparrede elektron kan det være mere modtageligt eller mindre modtageligt for indflydelsen af det eksterne magnetfelt. Det betyder, at energiopdelingen mellem de to spintilstande vil variere fra et molekyle til et andet. Som et resultat ville forskellige molekyler i det samme magnetfelt absorbere forskellige bølgelængder af mikrobølgestråling.
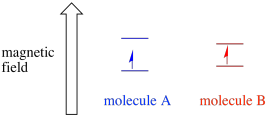
normalt er et EPR-spektrometer designet således, at det leverer en fast bølgelængde af mikrobølgestråling til prøven. Magnetfeltet justeres, og instrumentet måler, hvilken feltstyrke der kræves til absorption af fotonerne. Et EPR-spektrum viser absorbans som en funktion af magnetfeltstyrken.

Der er noget lidt anderledes ved, hvordan EPR-spektre normalt vises. Det vises som et derivat af plottet vist ovenfor. Det er på grund af den måde, hvorpå instrumentet måler ændringen i absorbans, da det ændrer magnetfeltet; dvs.det måler d(absorbans)/d(magnetfelt). Det er hældningen af det foregående plot.
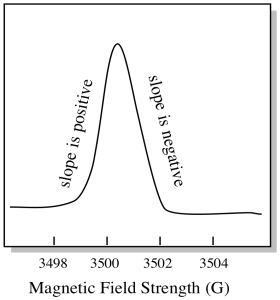
som et resultat ser et EPR-spektrum virkelig mere ud som dette. Delen over basislinjen afspejler den positive hældning i det foregående plot. Delen under basislinjen afspejler den negative hældning i det foregående plot.
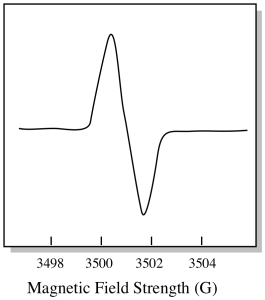
magnetfeltstyrken er typisk ikke den værdi, der rapporteres for toppositionen. I stedet rapporteres noget, der hedder g-værdien. G-værdien stammer fra ligningen for Tidseffekten (effekten af magnetfeltet på splittelsen mellem spin-energiniveauer). Dette forhold er:
\(\Delta E = g \beta B\)
i hvilken Kriste er energiforskellen mellem spintilstande, g er g-værdien, en proportionalitetskonstant, der afhænger af, hvor modtagelig elektronen er for magnetfeltets indflydelse, Krish er Bohr-magnetonen (9.274 * 10-24 J T-1) og B er det anvendte magnetfelt.
det betyder, at for fotonabsorption,
\(h \nu = g \beta b\)
og så
\(g = \frac{ h \nu}{\beta B}\)
husk, h og List er bare konstanter. Det betyder, at g er et mål for forholdet mellem den absorberede foton og det anvendte magnetfelt. Det er et standardiseringstrin. Hvis folk har instrumenter, der bruger lidt forskellige bølgelængder af mikrobølgestråling, ville de magnetiske felter, de måler for de samme prøver, ikke være enige. Hvis alle bare måler forholdet mellem bølgelængde og feltstyrke, skal det hele udjævne. G-værdien er et reproducerbart mål for miljøet af en elektron, der skal være den samme fra et laboratorium til et andet.
en lignende praksis anvendes i NMR-spektroskopi af lignende årsager. Når vi rapporterer et kemisk skift i ppm i stedet for HS, korrigerer vi for styrken af magnetfeltet i det instrument, vi bruger. Ellers ville den samme prøve give to forskellige skift på to forskellige instrumenter.
kobling i EPR
kobling er et fænomen, hvor magnetfelter interagerer med hinanden. I EPR opstår kobling på grund af indflydelsen af nærliggende kerner på den elektron, der observeres.
for eksempel ved du måske allerede, at et hydrogenatoms kerne har et uparret spin. Det er grundlaget for 1H NMR spektroskopi. Hvis kernen har et uparret spin, har det et tilknyttet magnetfelt. Fordi hydrogenkernen kunne have enten spinværdi, +1/2 eller -1 / 2, så har den to mulige magnetfelter forbundet med den.
en nærliggende elektron, placeret i et eksternt magnetfelt, kunne nu være i en af to forskellige situationer. Enten tilføjer den nærliggende proton lidt til magnetfeltet, eller det trækker lidt fra det eksterne felt.
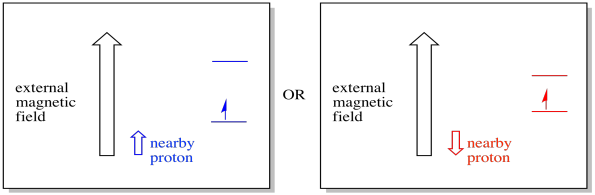
som et resultat kan elektronen opleve to forskellige felter. Husk, at vi ikke har at gøre med et enkelt molekyle i spektroskopi. Vi har at gøre med et stort antal molekyler. Nogle af molekylerne vil være i en situation. Nogle af molekylerne vil være i den anden situation. Vi vil se begge situationer. Der vil være absorbans ved to forskellige magnetfeltstyrker.

som et resultat viser EPR-spektret to toppe, som dette:
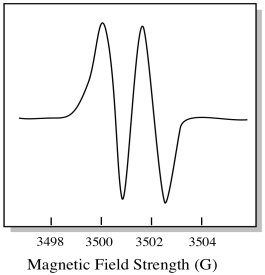
denne type top i spektret kaldes en dublet på grund af den dobbelte absorbans. Denne egenskab ved en EPR-top kaldes dens mangfoldighed. Hvor mange linjer er toppen opdelt i? To. Det er en dublet.
ting er endnu mere interessante, hvis der er to nærliggende protoner. I så fald har begge naboprotoner spin. Enten spin-kunne have værdi +1/2 eller -1/2. Måske er de begge +1/2. Måske er de begge -1 / 2. Måske er der en af hver. Disse tre mulige kombinationer vil have tre forskellige effekter på magnetfeltet oplevet af elektronen.
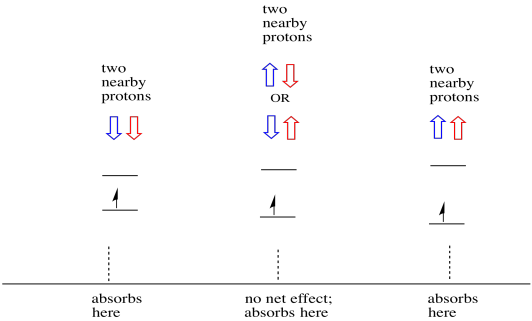
som følge heraf er der tre toppe i spektret. Spektret kaldes en triplet. Denne triplet er vist nedenfor under diagrammet, der illustrerer spinkombinationerne af de nærliggende hydrogener.
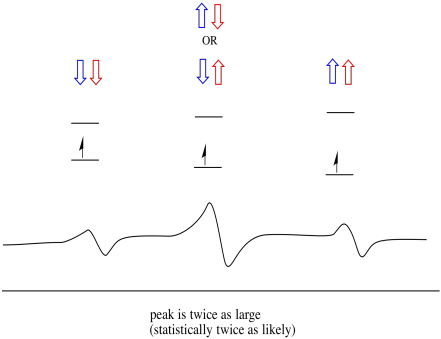
Bemærk, at fordi enten brint kunne være op eller ned i den blandede kombination, er der to måder at ankomme til den midterste tilstand. Denne kombination er dobbelt så sandsynlig som de to andre, fordi der kun er en måde at få denne kombination på: begge hydrogens spins er op, i et tilfælde. Begge hydrogener er nede i den anden. Som et resultat er den midterste top i en triplet dobbelt så stor som toppe på kanterne.
øvelse \(\Sideindeks{1}\)
viser, at der med tre nabohydrogener ville opstå en kvartet, hvor forholdet mellem toppe er 1:3:3:1.
svar
kombinationerne er:
a) ALLE spins ned (og der er kun en måde at gøre det på)
b) to af spins er nede, men en er op (og hver af de tre protoner kan være op, så der er tre måder at gøre det på)
c) to af spins er op, men en er nede (og hver af de tre protoner kan være nede, så der er tre måder at gøre det på)
d) ALLE spins op (og der er kun en måde at gøre det).
resultatet er en 1: 3: 3: 1 kvartet.
øvelse \(\Sideindeks{2}\)
Forudsig multiplikationen i EPR-spektret for hver af de følgende alkoksisradikaler (bemærk, at ilt og kulstof ikke har nogen uparrede spins; Antag, at det samme gælder for H):
a) H3C-O. b) H2CH-O. c) HCH2-O. D) CH3-O.
svar A)
A) singlet
svar b)
b) Doublet
svar c)
c) triplet
svar d)
d) kvartet
øvelse \(\sideindeks{3}\)
antag, at bensene blev reduceret med en elektron for at opnå den radikale anion. Hvad ville være mangfoldigheden i EPR-spektret?
svar
en septet (i en 1:3:5:7:5:3:1 forhold).
kobling til metalioner
masser af andre kerner end hydrogen har et netspin. Hvis den uparrede elektron tilfældigvis findes på et metal, EPR-spektret kan give bekræftelse af denne strukturelle information. Denne bekræftelse kan komme fra både magnetfeltinformationen (svarende til kemisk skift i NMR) og fra mangfoldigheden.
nukleare spins af udvalgte metaller er vist nedenfor.
| Metal | Spin |
| V | 7/2 |
| Mn | 5/2 |
| Fe | 0 |
| co | 7/2 |
| cu | 3/2 |
i hvert af disse metaller har kernen forskellige mulige magnetfelter. Bemærk, at deres virkninger er lidt mere komplicerede end et hydrogenatom. For eksempel fungerer kobber med spin 3/2 lidt som tre forskellige hydrogenkerner (hver med spin +/- 1/2) med hensyn til dens virkning på et nærliggende electroms EPR-spektrum. Mangfoldigheden af en uparret elektron på en kobberion skal være ret karakteristisk.
øvelse \(\Sideindeks{4}\)
Forudsig multiplikationen af en top i EPR-spektret for en uparret elektron på hvert af følgende metaller:
a) vanadium b) mangan c) jern d) kobolt e) kobber
svar A)
a) en oktet (i en 1:3:5:7:7:5:3:1 forhold)
svar b)
b) en sekstet (i en 1:3:5: 5: 3:1 forhold)
svar c)
C) en singlet
svar D)
D) en oktet
svar e)
e) en kvartet (i forholdet 1:3:3:1)
nogle gange er tingene mere komplicerede, fordi forskellige isotoper af det samme element kan have forskellige mulige spinværdier. Faktisk er det sandt med hydrogen og kulstof, men det store flertal af hydrogen findes som 1h, så generelt kan vi tænke på det som at have spin = 1/2; det store flertal af kulstof er 12c, med spin = 0.
de naturlige isotoper af jern og deres nukleare spins er vist i nedenstående tabel.
| Isotope | Spin | % Abundance |
| 54Fe | 0 | 5.9 |
| 56Fe | 0 | 91.8 |
| 57Fe | 1/2 | 2.1 |
| 58Fe | 0 | 0.2 |
The EPR spectrum of an unpaired electron on iron may be slightly more complicated than we first thought. Inden for prøven ville nogle af elektronerne være placeret på jernioner med spin = 1/2, selvom de fleste ikke ville. Denne komplikation kan være nok til at introducere en lille variation i spektrumets udseende, men generelt ser det stadig stort set ud som en singlet.
men i mange tilfælde bliver tingene meget mere komplekse. Molybdæn er et godt eksempel.
| isotop | Spin | % overflod |
| 92Mo | 0 | 14.8 |
| 94mo | 0 | 9.3 |
| 95Mo | 5/2 | 15.9 |
| 96mo | 0 | 16.7 | 97mo | 5/2 | 9.6 |
| 98mo | 0 | 24.1 |
| 100mo | 0 |
der er syv naturligt forekommende isotoper af molybdæn. Fem af dem har spin = 0, så en uparret elektron på disse isotoper ville give anledning til en simpel singlet i EPR-spektret. De to andre isotoper, der omfatter 25% af det samlede antal, har spin = 5/2. De fleste uparrede elektroner på molybdæn ville dukke op som en singlet. Imidlertid, en betydelig brøkdel ville dukke op som en sekstet. Det betyder, at en uparret elektron på molybdæn i et ideelt tilfælde ville give anledning til en singlet med en sekstet overlejret på den (ca.en fjerdedel så stærk som singlet).
denne situation kan se noget ud som tegningen nedenfor.

i virkeligheden er EPR-spektre enormt komplicerede i mange tilfælde. De ligner ofte uklar klatter. Der er så mange ting kobling til så mange andre ting, at det bliver næsten umuligt at dechifrere ved øjet. I de fleste tilfælde køres computersimuleringer, og de eksperimentelle data sammenlignes med computersimuleringerne for at opnå strukturel indsigt.
øvelse \(\Sideindeks{5}\)
Vanadium er til stede i nogle nitrogenaser, og der har derfor været interesse for modelkomplekser (f.eks. Chem. Soc. 1994, 116, 6927-6928). Gambarotta anvendte følgende syntese i THF-opløsningsmiddel:
\(\ce{VCl3 + K – > 3V (THF)}\)
- tegn strukturen af reaktionsproduktet.
- Tegn en d orbital opdeling diagram for dette kompleks.
- et EPR-spektrum blev registreret for denne forbindelse. Skitse spektret, da vanadium har nuklear spin I = 7/2.
- anslå kurteff for denne forbindelse.
forbindelsen reagerer med N2 og danner en N2-broet dimer.
e) tegn strukturen af dette produkt.
f) denne forbindelse producerer intet EPR-spektrum. Giv en resonansstruktur af (e), der forklarer denne observation.
svar
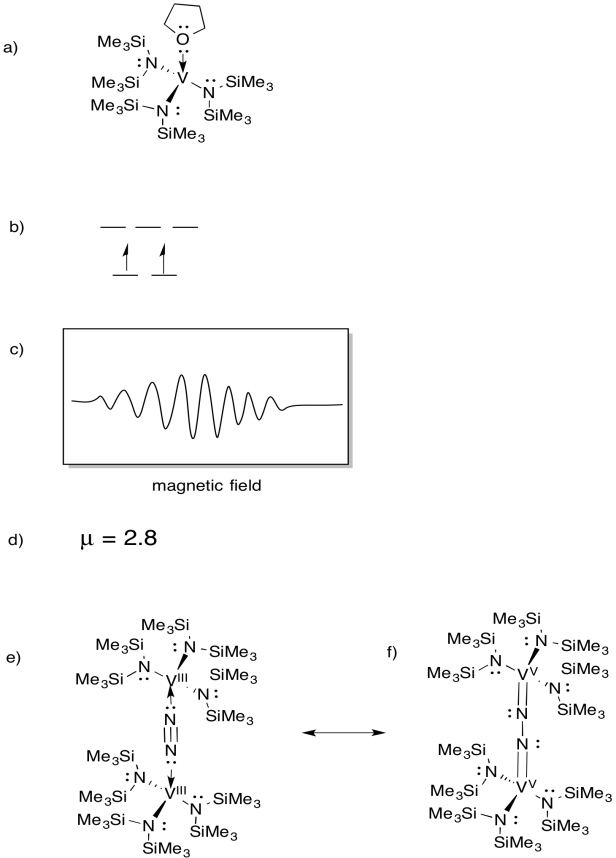
EPR spectra forudsat høflighed af Virtual Imagination / Slapdash Kemi kreationer.
Attribution
Chris P Schaller, Ph. D., (College of Saint Benedict / Saint John ‘ s University)