introduktion
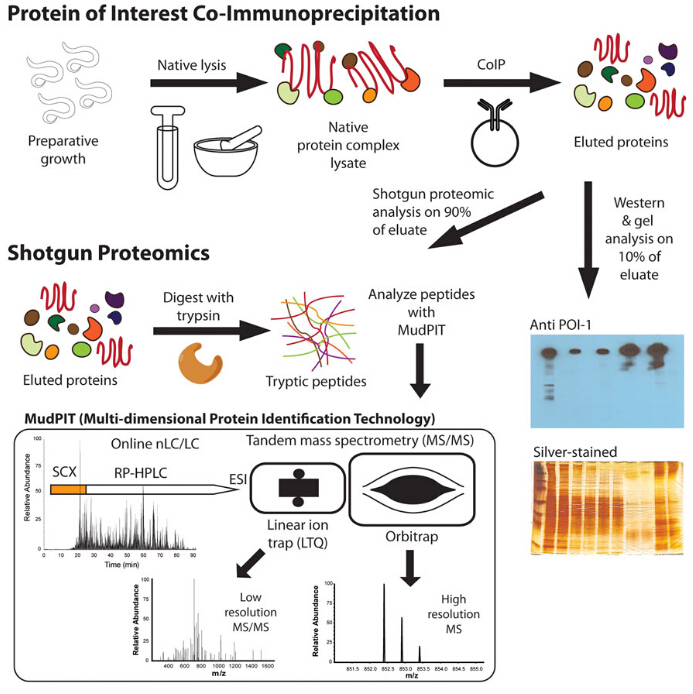
Co-immunopræcipitation, Co-IP kort sagt, er en bredt anvendt teknik til at identificere fysiologisk relevante protein-protein-interaktioner ved at anvende målproteinspecifikke antistoffer til indirekte at fange proteiner, der er bundet til dette specifikke målprotein. Som en udvidelse af IP kan Co-IP fange og rense ikke kun det primære mål, men også andre makromolekyler, der binder til målet ved native interaktioner. Forskellen mellem IP og co-IP er fokus for eksperimentet. IP er fokuseret på det primære mål, som binder antistoffet. Mens Co-IP retter sig mod de sekundære mål, der interagerer med de primære proteiner, i stedet for antistof. Efter immunudfældning vaskes og elueres proteiner fanget på perlerne for at opnå oprensede primære og sekundære målproteiner. Disse målproteiner kan karakteriseres i forskellige metoder, såsom Vestligblot og massespec-analyse under haglgeværstrategi, at identificere partnerprotein-id ‘ er, bindende affiniteter, kinetik for binding og uopdagede funktioner af det primære protein.
kritiske faktorer om Co-IP:
som en kraftfuld teknik anvendes Co-IP regelmæssigt af biokemikere til at udforske protein–proteininteraktioner. Mens Co-IP-metoden er ligetil, er det ikke let at identificere fysiologiske protein-protein-interaktioner gennem Co-IP-reaktion på grund af interaktionens ustabilitet, uspecifik binding til IP-reagenser og antistofforurening. Alle ovenstående problemer kan have negative virkninger på påvisning af protein-protein-interaktioner.
Co-IP af proteinkomplekser
da Co-IP afhænger af protein-protein-interaktioner for at detektere de bundne proteiner, er bindingsaffiniteten og stabiliteten af de fysiologiske interaktioner under hele Co-IP-processen meget vigtig. Utilstrækkelig bindingstid og omfattende vasketrin kan reducere bindingseffektiviteten og forårsage manglende påvisning af proteininteraktion. Derfor, for proteiner, som forudsiges at have ugebindende affinitet eller dynamiske interaktioner, forhåndsstabilisering af protein-protein-interaktioner er nødvendig, for eksempel, tværbindingsprocesser kan udføres før Co-IP.
uspecifikke interaktioner
brud på cellemembran og organeller forårsager frigivelse af store mængder proteiner, som adskilles af grænsen, for at komme i kontakt. Derfor er det uundgåeligt, at uspecifikke interaktioner, med andre ord falske positive interaktioner, kan forekomme, hvilket forstyrrer dataanalysen. Dette er især almindeligt for proteiner, der har udfoldede eller fleksible regioner, som er relativt klæbrige og uspecifikt binder andre proteiner. Måder at genopleve sådanne problemer kan være præclearance af lysat ved anvendelse af primære antistoffer til fjernelse af uspecifikke proteiner og ændring af bufferens Ioniske styrke for at reducere den uspecifikke binding.
Creative Proteomics kan levere brugerdefineret eksperimentelt design og forfine Co-IP-parametre baseret på kundernes behov. Vi lover pålidelig Co-IP analyse af protein-protein interaktioner med vores erfarne forskere og teknikere.
funktioner af Co-IP-tjeneste:
- Undersøg interaktionerne mellem proteiner og proteinkompleks
- Overvåg dynamikken i proteininteraktion
- Undersøg protein-proteininteraktion i en ikke-denaturerende tilstand, som er næsten fysiologisk
- kortlægning af de interagerende domæner af proteiner
vores Co-IP-tjeneste indeholder:
- Eksperimentdesign baseret på dine specifikke projektbehov: buffere, perler, perler, perler, svampe, svampe og andre proteiner, antistoffer osv.
- Parameteroptimering, såsom bindingstid
- cellelyse, IP, vask & eluering
- Vestligblot/ massespektrometri, afhængigt af projektets behov
- dataanalyse & rapport levering
bestillingsprocedure:
