- Værtsspecifik interaktion mellem Jordstænglen og Plantepartnerne
- Determinate and Indeterminate nodule Development
- vækst af symbiotiske celler involverer amplifikation af værtsgenomet ved Endoreduplikationscyklusser
- forskellige skæbner af kvælstoffikserende Bakterioider
- Værtspeptider styrer Bakterioiddifferentiering
- NCR247: et eksempel på multi-Target Host Effector
- konklusion
- interessekonflikt Erklæring
- anerkendelser
Værtsspecifik interaktion mellem Jordstænglen og Plantepartnerne
de bakterier, der danner kvælstoffikserende symbiose med bælgplanter, der tilhører forskellige grupper af larr-og larr-proteobacteria, kaldes samlet jordstængler (Chen et al., 2003; MacLean et al., 2007). Mange kurp-proteobakterier er involveret i langsigtede interaktioner med højere eukaryoter. Disse interaktioner spænder fra overfladekolonisering gennem fakultative symbiotiske forhold til at forpligte intracellulært patogen eller endosymbiont livsstil. De symbiotiske gener, der kræves til dannelse af knuder, værtscelleinfektion og nitrogenfiksering, er erhvervet ved lateral genoverførsel, som er den primære kilde til genetisk mangfoldighed af jordstængler. Derfor kan jordstængler være tættere forbundet med patogener (såsom Agrobacterium eller Brucella) end med hinanden. Jordstængler har tendens til at have store genomer (op til 10.5 Mbp), som i hurtigt voksende jordstængler er spredt på flere replikoner (MacLean et al., 2007). For eksempel har sinorhisobium meliloti, endosymbiont af Medicago-arter, et tredelt genom; et kromosom på 3,65 Mbp og to megaplasmider, pSymA og pSymB (1,35 og 1,68 Mbp), som begge er uundværlige og bærer størstedelen af symbiotiske gener. Imidlertid indeholder mange S. meliloti-stammer yderligere hjælpestore mellemstore plasmider, og S. meliloti-genomet kan således indeholde op til 9.000 gener (Barnett et al., 2001; Capela et al., 2001). I modsætning til jordstængler har obligatoriske endosymbionter af insekter normalt et stærkt reduceret (160-450 Kbp) genom, der sikrer deres multiplikation og koder for et par specifikke biosyntetiske veje, herunder dem, der opfylder værtens behov (Moran et al., 2008; Price et al., 2011). Disse utroligt reducerede genomer forstærkes ikke desto mindre og kompenserer det formindskede genom med et polyploid DNA-indhold.
plantepartnerne af jordstængler tilhører familien Leguminosae/Fabaceae. Kvælstoffikserende symbiose har udviklet sig i flere slægter, men ikke alle bælgplanter danner symbiose. Hidtil er 12.000 nodulerede bælgplantearter kendt, og hver har sin egen Jordstængelpartner(er). Symbiosen udløses af kvælstofsult af værtsplanten, som skal vælge sin Jordstængelpartner blandt milliarder af bakterier i jordstænglen. Dette opnås ved sekretion af flavonoid signalmolekyler fra roden, der fungerer som kemo-tiltrækningsmidler, men vigtigst af alt som inducere af Jordstængelknudulationsgenerne (Oldroyd, 2013). Disse gener er nødvendige til produktion af bakterielle signalmolekyler; Nod-faktorerne (NFs), der udløser knudeudviklingsprogrammet i værtsplanten (2000). NFs er lipochitooligosaccharidmolekyler, der bærer værtsspecifikke substitutioner på de terminale sukkerrester og karakteristiske lipidkæder, som genkendes af LysM-type værtsreceptorer og er nødvendige både til knudeudvikling og bakteriel infektion. Interessant nok fungerer den gamle symbiose af landplanter med armuskulære mykorrhisale (AM) svampe med lignende lipochitooligosaccharidsignalmolekyler, Myc-faktorerne, der opfattes af lignende, men forskellige lysm-receptorer som NFs (Abdel-Lateif et al., 2012; Oldroyd, 2013). Myc-faktorerne og NFs aktiverer en fælles signalvej, men efter involveringen af de almindelige symbiotiske gener, der er konserveret i planter, afviger stierne; den ene fører til nodulation, den anden til AM-symbiose.
planteinfektion og dannelse af knuder er indviklede processer; Nodfaktorer spiller forskellige roller i nodulorganogenese og rodhårinfektion. Desuden er forskellige bakterielle overfladepolysaccharider ved siden af Nod-faktorer afgørende for effektiv infektion (Fraysse et al., 2003). I de fleste bælgfrugter kommer jordstænglen ind i værten via rodhårene, hvor der ved invagination af plasmamembranen dannes en infektionstråd (den), der indeholder de multiplikerende bakterier og vokser mod rodbarken. En mindre hyppig og gammel infektionsform forekommer via revner på rodoverfladen af visse bælgfrugter.
Determinate and Indeterminate nodule Development
nodule development kræver mitotisk reaktivering af kortikale celler, der fører til nodule primordium dannelse, som derefter differentierer sig til nitrogenfikserende rodknuder, der giver mikroaerob tilstand i det centrale område for funktion af det iltfølsomme nitrogenase i bakteroiderne. Afhængig af den forbigående og vedvarende karakter af værtscelleproliferation kan knuderne enten være bestemte eller ubestemte (Terpolili et al., 2012; Kondorosi et al., 2013). Bestemte knuder har ingen meristem og indeholder homogen population af symbiotiske celler. Bestemte knuder udvikler sig for eksempel på Phaseolus vulgaris og Lotus japonicus rødder.
tværtimod opretholdes den aktive celledeling i de ubestemte knuder. En nodul meristem er til stede i det apikale område (område I), som ved konstant dannelse af nye celler fremkalder kontinuerlig vækst og langstrakt knudeform. Cellerne, der forlader meristemet, deler sig ikke længere og går ind i en differentieringsfase. Infektionstråden frigiver bakterierne i de submerstematiske celler, som gradvist differentieres langs 12-15 cellelagene i infektionsområdet (område II), hvilket fører til udvikling af nitrogenfikserende symbiotiske celler i knudeområde III (Figur 1; Franssen et al., 1992). Medicago sativa, M. truncatula, Vicia sativa og Pisum sativum er eksempler på planter, der danner ubestemte knuder.
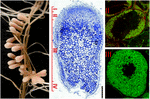
figur 1. Struktur af nitrogenfikserende rodknuder dannet i S. meliloti – M. truncatula symbiose. De forskellige knudepunkter er angivet på den langsgående knudesektion: (I) meristem, (II) infektionsområde, (III) nitrogenfikseringsområde, (IV) aldringsområde. Symbiotiske celler i område II indeholder de differentierende endosymbionter, mens værtscytoplasmaet i område III er fuldt pakket med lange nitrogenfikserende bakterioider. Endosymbionter farvet med Syto9 har grøn fluorescens.
vækst af symbiotiske celler involverer amplifikation af værtsgenomet ved Endoreduplikationscyklusser
ekstrem plantecelleforstørrelse kan observeres i både determinate og ubestemte knuder. Cytoplasmaet i en nitrogenfikserende symbiotisk celle er vært for omkring 50.000 bakterier. For at imødekomme et så stort antal endosymbionter vokser værtscellerne. I M. truncatula-knuder er volumenet af de nitrogenfikserende celler 80 gange større end for de diploide meristematiske celler. Væksten af inficerede celler sker trinvis i område II og er konsekvensen af gentagen endoreduplikation (ER) af genomet uden mitose. I område II er cellecyklusmaskineriet stadig aktivt, men manglen på mitotiske cykliner hæmmer mitose og omdanner de mitotiske cyklusser til endoreduplikationscyklusser (cebolla et al., 1999). Dette opnås ved cellecyklusomskifteren CCS52A-protein, der ved ødelæggelsen af de mitotiske cykliner inducerer gentagne runder af genomduplikation, der fører til dannelsen af gradvist voksende polyploide celler (Roudier et al., 2003; Kondorosi og Kondorosi, 2004). Hos Medicago-arter kan ploidiniveauerne nå 64C, der repræsenterer 64 gange højere DNA-indhold sammenlignet med haploide celler (C svarer til det haploide DNA-indhold; Vinardell et al., 2003). Nedregulering af CCS52A i M. truncatula havde ingen effekt på primordiumdannelse, men var skadelig for noduledifferentiering, hvilket indikerer, at ER-cyklusser og dannelse af store stærkt polyploide celler er essentielle for nodulefunktion (Vinardell et al., 2003). Interessant nok er kortikale celler, der indeholder am-svampe, også polyploide såvel som de nematodefodrende gigantiske rodceller (Favery et al., 2002; Genre et al., 2008). Tilsvarende er insektsymbiotiske celler, bakteriocytterne, der huser intracellulære endosymbionter, også store og polyploide (Nakabachi et al., 2010). I angiospermplanter er polyploidi hyppig, og det specifikke arvelige mønster af polyploidi i forskellige organer, væv og celletyper antyder, at det kunne være en vigtig kilde til værtscellernes specialiserede fysiologi (Nagl, 1976; Edgar et al., 2014). Ved siden af cellevækst kan de flere genkopier, mangel på kromosomkondensation bidrage til højere transkriptionelle og metaboliske aktiviteter. Associering af polyploidi med forskellige cellefunktioner antyder imidlertid en indvirkning af polyploidi også på nukleosomernes arkitektur og på epigenomet, der styrer aktivering eller undertrykkelse af specifikke genomiske regioner. Følgelig ser det polyploide genomindhold i symbiotiske celler ud til at være en forudsætning for noduledifferentiering og for ekspressionen af de fleste symbiotiske værtsgener (Maunoury et al., 2010).
forskellige skæbner af kvælstoffikserende Bakterioider
bakterierne frigivet fra IT er til stede i værtscytoplasmaet som organellignende strukturer, kaldet symbiosomer. Bakterierne har ingen direkte kontakt med cytoplasma, da de er omgivet af en peribacteroid membran, også kendt som symbiosom membran (SM). Bakteroid, sm og rummet mellem dem omfatter symbiosom (Catalano et al., 2004). SM under dens dannelse afspejler dens plasmamembranoprindelse, senere ændringer af dens sammensætning åbner nye, specialiserede roller ved host-endosymbiont-grænsefladen (Limpens et al., 2009; Ivanov et al., 2012; Brear et al., 2013; Sinharoy et al., 2013). Bakteroiderne formerer sig i de voksende værtsknudeceller til en bestemt celletæthed, tilpasser sig den endosymbiotiske livsstil og mikroaerobe tilstande og modnes til kvælstoffikserende bakterioider. Formen og fysiologien af bakterioider kan imidlertid være påfaldende forskellig i de forskellige bælgplanter. I visse bælgplanteværter har de kvælstoffikserende bakterioider den samme morfologi som dyrkede celler; denne type bakterioider kan vende tilbage til den fritlevende form. I andre foreninger omdannes bakteroiderne irreversibelt til polyploide, forstørrede, ikke-dyrkbare endosymbionter. Disse terminalt differentierede bakterioider kan være aflange og endda forgrenede og 5 til 10 gange længere end de fritlevende celler eller kan være sfæriske fra 8 til mindst 20 gange amplificeret genom afhængigt af værten (Mergaert et al., 2006; Nakabachi et al., 2010). Terminal differentiering af bakterioider er værtskontrolleret, udviklet i flere grene af Leguminosae-familien, der indikerer værtsfordel og sandsynligvis højere symbiotisk ydeevne (Oono et al., 2010). Terminal bacteroid differentiering er den bedst belyste i S. meliloti – M. truncatula symbiosen. I M. multiplikation af bakterioider stopper midt i område II, hvor celleforlængelse og ensartet amplifikation af de multiple replikoner ved endoreduplikationscyklusser begynder. Langs 2-3 cellelag ved grænsen til område II og III (kaldet interområde) er pludselig vækst af bakterioider synlig og når næsten deres endelige størrelse, men nitrogenfiksering finder kun sted i område III.
Værtspeptider styrer Bakterioiddifferentiering
sammenligning af nodultranskriptomer af bælgfrugter med reversibel og irreversibel bakterioiddifferentiering afslørede eksistensen af flere hundrede små gener, der kun var til stede i genomet af de værtsplanter, hvor bakterioiddifferentiering var terminal. I M. truncatula producerer knudecellerne mindst 600 knudespecifikke symbiotiske peptider (symPEPs). SymPEP-generne aktiveres kun i de S. meliloti-inficerede polyploide symbiotiske celler (Kevei et al., 2002; Mergaert et al., 2003), dog visse sæt på det tidligere, andre i de senere stadier af noduleudvikling. En stor del, mere end 500 gener koder for nodulespecifikke cysteinrige (NCR) peptider (Mergaert et al., 2003; Alunni et al., 2007; Nallu et al., 2014). NCR-peptiderne er målrettet mod bakteroiderne, og når deres levering til endosymbionterne blev blokeret, blev bakterioiddifferentiering afskaffet, hvilket demonstrerede, at peptiderne er ansvarlige for terminal differentiering af S. meliloti-bakteroider (Van de Velde et al., 2010). Den høje sekvensvariant og de karakteristiske ekspressionsmønstre for NCR-gener antyder mangfoldighed i deres funktioner, virkningsmåder og bakterielle mål på forskellige stadier af bakterioid modning (figur 2). Men hvorfor producerer værtscellen et arsenal af NCR ‘ er? Hvad kan være fordelen ved et så forskelligt peptidrepertoire? Er det nødvendigt for interaktion mellem værten og forskellige bakterier? De symbiotiske partnere af M. truncatula er S. meliloti og S. medicae, men i jorden er der utallige stammevarianter af begge arter. M. truncatula er også repræsenteret af mange forskellige økotyper og tiltrædelser, der adskiller sig i antallet, sekvenserne og ekspressionsprofilen for NCR-gener og i deres symbiotiske interaktioner med forskellige S. meliloti-og S. medicae-stammer (Nallu et al., 2014; Pernille et al., 2014). Mens en knude indeholder en enkelt bakterietype, kan de forskellige knuder på det samme rodsystem have forskellige bakteriepopulationer. Det er muligt, at planten, der genkender de forskellige endosymbionter, manipulerer dem med et stammespecifikt repertoire af peptider. Disse forskelle kan tilføje et ekstra kontrolniveau for vært-symbiont-specificitet og derved for nodulationseffektivitet.

figur 2. Differentiel ekspression af symPEP gener i M. truncatula knuder. Sort signal: in situ hybridisering, blåt signal: Gus aktivitet af symPEP promotor-GUS fusioner i transgene knuder.
selvom symPEPs repræsenterer unikke peptidklasser, ligner deres strukturer antimikrobielle peptider (ampere). Forstærkere med bredt spektrum af mikrobiel celledrabningsaktivitet er hyppigst kationisk provokerende celledød ved poredannelse, membranforstyrrelse og deraf følgende lysis af mikrobielle celler. Det faktum, at celledelingsevnen definitivt går tabt under endosymbiont-differentiering, indikerer, at i det mindste visse symPEPs har antimikrobielle aktiviteter. Behandling af bakterier med syntetiske kationiske NCR ‘ er fremkaldte faktisk hurtig og effektiv dosisafhængig eliminering af forskellige Gram-negative og Gram-positive bakterier inklusive vigtige humane og plantepatogener (Van De Velde et al., 2010; Et al., 2013). Denne eks-planta-dræbende virkning korreleret med permeabilisering af mikrobielle membraner, men symPEPs i deres naturlige miljø – i knudecellerne – gennemsyrer ikke bakteriemembranerne og dræber ikke endosymbionterne. Mest sandsynligt er peptidkoncentrationerne i knuderne signifikant lavere end dem, der anvendes i In vitro-analyserne. Desuden produceres kationiske peptider sammen med anioniske og neutrale peptider i den samme celle, og mulig kombination af nogle få tiere eller hundreder af peptider med forskellige ladninger og hydrofobicitet kan neutralisere den direkte bakteriedræbende virkning af de kationiske peptider.
inddragelsen af ampere eller AMP-lignende peptider er ikke unik for symbiose med jordstængler-bælgplanter. I vævets Sitophilus producerer de symbiotiske celler det antimikrobielle peptid coleoptericin-a (ColA), som fremkalder udviklingen af gigantiske filamentøse endosymbionter ved at hæmme celledeling og beskytter de nærliggende insektvæv mod bakteriel invasion (Login et al., 2011). I dette system er et enkelt peptid tilstrækkeligt til differentiering af den obligatoriske lodret transmitterede endosymbiont i modsætning til knuder, der fungerer med hundreder af symPEPs og kan være vært for utallige stammevarianter som deres endosymbionter. I bladlus-Buchnera-symbiosen producerer værtscellerne også bakteriocytspecifikke peptider inklusive cysteinrige peptider (BCR ‘ er), der ligner Medicago NCR-peptiderne, men funktionerne af disse symbiotiske peptider er endnu ikke rapporteret (Shigenobu og Stern, 2013).
NCR247: et eksempel på multi-Target Host Effector
Transkriptomanalyse af M. truncatula-knuder på forskellige stadier af deres udvikling, lasermikrodissektion af knudeområder, in situ-hybridisering, immunolokalisering af udvalgte peptider og symPEP-promotor-reporter-genfusioner i transgene knuder tillader kortlægning af virkningen af individuelle peptider i de symbiotiske celler fra den tidlige infektion indtil den sene nitrogenfikseringstilstand. NCR247 udtrykkes i de ældre cellelag i område II og i området, hvor bakteriecelledeling stopper og bemærkelsesværdig forlængelse af endosymbionterne forekommer (Farkas et al., 2014). Dette lille kationiske peptid dræbte effektivt forskellige mikrober in vitro, og in silico-analysen angav dets ekstreme proteinbindingskapacitet. FITC-mærket NCR247 trådte ind i bakteriecytosolen, hvor dets interaktioner med adskillige bakterielle proteiner var mulige. Bindingspartnere blev identificeret ved behandling af S. meliloti-bakterier eller bakterioider med StrepII/FLAG-mærkede peptider efterfulgt af affinitetskromatografi og identifikation af interagerende partnere med LC-MS/MS og vestlig analyse (Farkas et al., 2014).
en af interaktorerne var celledelingsproteinet, der spillede en afgørende primær rolle i celledeling. Et antal antibiotiske peptider er kendt for at udøve bakteriedræbende eller bakteriostatisk virkning gennem interaktionen med FTS, inhibering af dets polymerisering og derved hindre korrekt dannelse af Ring-og septum (Handler et al., 2008). NCR247 blev co-oprenset med FTS fra den bakterielle cytoplasma og viste sig at forstyrre septumdannelsen. NCR035 udviser in vitro også bakteriedræbende virkning og produceret i de samme symbiotiske celler som NCR247 akkumuleres ved divisionsseptumet, hvilket indikerer samtidig eller på hinanden følgende virkning af disse peptider og udvikling af flere værtsstrategier for at hæmme endosymbiontproliferation. En anden undersøgelse viste, at ekspression af vigtige celledelingsgener, herunder gener, der kræves til R-ringfunktion, blev stærkt svækket i celler behandlet af NCR247 (Penterman et al., 2014). Forbehandling af bakterier med sub-dødelige NCR247-koncentrationer afskaffede lokalisering af FITC-NCR035 til septum og provokerede celleforlængelse (Farkas et al., 2014).
ribosomale proteiner var de mest rigelige NCR247 interagerende partnere. NCR247 blev observeret at hæmme bakterieproteinsyntese stærkt på en dosisafhængig måde både in vivo og in vitro (Farkas et al., 2014). Disse resultater antydede, at en tilstand af NCR247-peptidvirkningen er bindende til ribosomerne både i bakterieceller og bakteroider. Interessant nok blev der observeret et ændret mønster og reduceret kompleksitet af de interagerende proteiner i bakteroiderne. Følgelig var det generelle ekspressionsniveau for ribosomale proteiner i gennemsnit 20 gange lavere i bakteroiderne end i de fritlevende celler med forskellig relativ overflod af udskrifter af individuelle ribosomale proteiner. Ribosomdiversificering i bakterioider kan have en væsentlig rolle ved at bidrage til den avancerede translation af specifikke proteiner og derved understøtte den specialiserede, energikrævende fysiologi med meget rigelig nitrogenfikseringsfunktion.GroEL chaperon var også en direkte interagerende partner af NCR247 (Farkas et al., 2014). Ud af de 5 Groelproteiner er GroEL1 eller GroEL2 tilstrækkelig til overlevelse, mens GroEL1 udtrykt på højt niveau i knuden er afgørende for symbiose (Bittner et al., 2007). Det er nødvendigt for fuld aktivering af nodulationsgenerne og samling af nitrogenasekomplekset. GroEL besidder ekstrem funktionel alsidighed ved at interagere med hundredvis af proteiner. NCR247-GroEL1-interaktionen kan have konsekvenser direkte på GroEL, men indirekte også på GroEL-substraterne og de tilknyttede biologiske processer. Fravær af GroEL1 alvorligt påvirket bakteriel infektion og vedligeholdelse og differentiering af bakterioider, der viser et generelt behov for GroEL1 i alle faser af kvælstoffikserende knudeudvikling.
inddragelsen af GroEL-og værtspeptider i mikrobe-vært-interaktioner er ikke unik for symbiose med jordstængler-bælgplanter. I de vævende symbiotiske celler interagerer coleoptericin-a (ColA) også med GroEL (Login et al., 2011). GroEL spiller også en vigtig rolle i vedligeholdelsen af endosymbionter (Moran, 1996; Kupper et al., 2014). Da de fleste symbiotiske systemer endnu ikke er udforsket, og genomiske og proteomiske værktøjer med høj kapacitet først er tilgængelige for nylig, vi kan kun forudsige, at værtspeptider-medieret endosymbiont-differentiering, ligeledes genomforstærkning af værtsceller og terminalt differentierede endosymbionter er generelle strategier for symbiose.
konklusion
symbiotiske og patogene bakterier bruger lignende tilgange til at interagere med deres værter og overleve i værtsceller, selvom resultaterne af disse interaktioner er påfaldende forskellige. Planter og dyr kan generere medfødte immunresponser på mikroorganismer efter opfattelsen af MAMP ‘ er (mikroorganisme-associerede molekylære mønstre). Denne opfattelse resulterer i aktivering af signalkaskader og produktion af antimikrobielle effektorer. AMP – lignende vært peptider såsom M. truncatula NCR-peptider eller det lille ColA antimikrobielle peptid spiller centrale og mangesidede roller i styringen af multiplikation og differentiering af endosymbionter og derved begrænser tilstedeværelsen af bakterier til de symbiotiske celler. Således bruger værtsorganismer disse effektorpeptider til at tæmme og endda ansætte udvalgte mikrobielle angribere til service.
interessekonflikt Erklæring
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
anerkendelser
arbejdet i vores laboratorier understøttes af Det Europæiske Forskningsråds”SYM-BIOTICS” Advanced Grant til Kristiva Kondorosi (bevillingsnummer 269067) og af T-KRISTIMOP-4.2.2.A-11/1/KONV-2012-0035 støttet af Den Europæiske Union og medfinansieret af Den Europæiske Socialfond.
Abdel-Lateif, K., falsk, D. og Hocher, V. (2012). Flavonoidernes rolle i etableringen af planterødder endosymbioser med armuskulære svampe, jordstængler og Frankia bakterier. Plant Signal. Opfør dig ordentligt. 7, 636–641. doi: 10.4161 / psb.20039
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Alunni, B., Kevei, Z., Redondo-Nieto, M., Kondorosi, A., Mergaert, P., and Kondorosi, E. (2007). Genomic organization and evolutionary insights on GRP and NCR genes, two large nodule-specific gene families in Medicago truncatula. Mol. Plant Microbe Interact. 20, 1138–1148. doi: 10.1094/MPMI-20-9-1138
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Barnett, M. J., Fisher, R. F., Jones, T., Komp, C., Abola, A. P., Barloy-Hubler, F., et al. (2001). Nukleotidsekvens og forudsagte funktioner af hele sinorhisobium meliloti pSymA megaplasmid. Proc. Natl. Acad. Sci. USA 98, 9883-9888. doi: 10.1073 / pnas.161294798
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Bittner, A. N., Folts, A. og Oke, V. (2007). Kun et af fem groel-gener er påkrævet for levedygtighed og vellykket symbiose i sinorhisobium meliloti. J. Bakteriol. 189, 1884–1889. doi: 10.1128 / JB.01542-06
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Brear, E. M., Day, D. A., and Smith, P. M. (2013). Iron: an essential micronutrient for the legume-Rhizobium symbiosis. Front. Plant Sci. 4:359. doi: 10.3389/fpls.2013.00359
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Catalano, C. M., Lane, W. S., and Sherrier, D. J. (2004). Biochemical characterization of symbiosome membrane proteins from Medicago truncatula root nodules. Electrophoresis 25, 519–531. doi: 10.1002/elps.200305711
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Capela, D., Barloy-Hubler, F., Gousi, J., Bothe, G., Ampe, F., Batut, J.,et al. (2001). Analyse af kromosomsekvensen af legume symbiont Sinorhisobium meliloti-stammen 1021. Proc. Natl. Acad. Sci. USA 98, 9877-9882. doi: 10.1073 / pnas.161294398
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Cebolla, A., Vinardell, J. M., Kiss, E., OL L., B., Roudier, F., Kondorosi, A.,et al. (1999). Den mitotiske hæmmer ccs52 er nødvendig til endoreduplikation og ploidyafhængig celleforstørrelse i planter. EMBO J. 18, 4476-4484. doi: 10.1093 / emboj / 18.16.4476
CrossRef Fuld tekst
Chen, M. M., Moulin, L., Bontemps, C., Vandamme, P., B. L., Og Boivin-Masson, C. (2003). Legume symbiotisk nitrogenfiksering af Kurt-proteobacteria er udbredt i naturen. J. Bakteriol. 185, 7266–7272. doi: 10.1128 / JB.185.24.7266-7272.2003
CrossRef Fuld tekst
Edgar, B. A., N. Og Gutierres, C. (2014). Endocykler: en tilbagevendende evolutionær innovation til Post-mitotisk cellevækst. Nat. Pastor Mol. Celle. Biol. 15, 197–210. doi: 10.1038/nrm3756
Pubmed abstrakt | Pubmed Fuld tekst | CrossRef Fuld tekst
Farkas, A., Mar Pristi, G., D Pristrg, H., Gy Pristrgyp Pristrl, A., Lima, R. M., Medsihradsky, K. F.,et al. (2014). Medicago truncatula symbiotisk peptid NCR247 bidrager til bakterioid differentiering gennem flere mekanismer. Proc. Natl. Acad. Sci. U. S. A. 111, 5183-5188. doi: 10.1073 / pnas.1404169111
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Favery, B., Complainville, A., Vinardell, J. M., Lecomte, P., Vaubert, D., Mergaert, P.,et al. (2002). The endosymbiosis-induced genes ENOD40 and CCS52a are involved in endoparasitic-nematode interactions in Medicago truncatula. Mol. Plant-Microbe Interact. 15, 1008–1013. doi: 10.1094/MPMI.2002.15.10.1008
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franssen, H. J., Vijn, I., Yang, W. C., and Bisseling, T. (1992). Developmental aspects of the Rhizobium-legume symbiosis. Plant Mol. Biol. 19, 89–107. doi: 10.1007
CrossRef Full Text
Fraysse, N., Couderc, F., and Poinsot, V. (2003). Surface polysaccharide involvement in establishing the Rhizobium–legume symbiosis. Eur. J. Biochem. 270, 1365–1380. doi: 10.1046/j.1432-1033.2003.03492.x
CrossRef Full Text
Genre, A., Chabaud, M., Faccio, A., Barker, D. G., and Bonfante, P. (2008). Præpenetrationsapparatets samling går forud for og forudsiger koloniseringsmønstrene for armuskulære mykorrhisale svampe inden for rodbarken af både Medicago truncatula og Daucus carota. Plantecelle 20, 1407-1420. doi: 10.1105 / tpc.108.059014
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Handler, A. A., Lim, J. E. og Losick, R. (2008). Peptidinhibitor af cytokinesis under sporulation i Bacillus subtilis. Mol. Mikrobiol. 68, 588–599. doi: 10.1111 / j. 1365-2958.2008. 06173.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ivanov, S., Fedorova, E. E., Limpens, E., De Mita, S., Genre, A., Bonfante, P.,et al. (2012). Rhizobium–legume symbiosis shares an exocytotic pathway required for arbuscule formation. Proc. Natl. Acad. Sci. U.S.A. 109, 8316–8321. doi: 10.1073/pnas.1200407109
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kevei, Z., Vinardell, J. M., Kiss, G. B., Kondorosi, A., and Kondorosi, E. (2002). Glycinrige proteiner kodet af en knudespecifik genfamilie er impliceret i forskellige stadier af symbiotisk knudeudvikling i Medicago spp. Mol. Plant Mikrobe Interagerer. 15, 922–931. doi: 10.1094 / MPMI.2002.15.9.922
Pubmed abstrakt | Pubmed Fuld tekst | CrossRef Fuld tekst
Kondorosi, E., Og Kondorosi, A. (2004). Endoreduplikation og aktivering af det anafasefremmende kompleks under symbiotisk celleudvikling. FEBS Lett. 567, 152–157. doi: 10.1016 / j. febslet.2004.04.075
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Kondorosi, E., Mergaert, P. og Keresst, A. (2013). Et paradigme for endosymbiotisk liv: celledifferentiering af Jordstængelbakterier fremkaldt af værtsplantefaktorer. Annu. Rev. Microbiol. 67, 611–628. doi: 10.1146 / annurev-micro-092412-155630
CrossRef Fuld tekst
Kupper, M., Gupta, S. K., Feldhaar, H. og Gross, R. (2014). Chaperonin Groels alsidige roller i mikroorganisme-insektinteraktioner. FEMS Microbiol. LETT. 353, 1–10. doi: 10.1111 / 1574-6968.12390
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Limpens, E., Ivanov, S., Van Esse, V., Voets, G., Fedorova, E. og Bisseling, T. (2009). Medicago N2-fikserende symbiosomer erhverver den Endocytiske identitetsmarkør Rab7, men forsinker erhvervelsen af vakuolær identitet. Plantecelle 21, 2811-2828. doi: 10.1105 / tpc.108.064410
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Log ind, F. H., Balmand, S., Vallier, A., Vincent-Mon Lengat, C., Vigneron, A., Vaiss-Gayet, M., et al. (2011). Antimikrobielle peptider holder insektendosymbionter under kontrol. Videnskab 334, 362-365. doi: 10.1126 / videnskab.1209728
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
MacLean, A. M., Finans, T. M. Og Sadovsky, M. J. (2007). Genomer af de symbiotiske nitrogenfikserende bakterier af bælgfrugter. Plant Physiol. 144, 615–622. doi: 10.1104/s.107. 101634
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Maunoury, N., Redondo-Nieto, M., Bourcy, M., Van De Velde, V., Alunni, B., Laporte, P., et al. (2010). Differentiering af symbiotiske celler og endosymbionter er koblet til to transkriptomomskiftere i Medicago truncatula nodulation. PLoS en 5: e9519. doi: 10.1371 / tidsskrift.pone.0009519
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Mergaert, P., Nikovics, K., Kelemen, S., Maunoury, N., Vaubert, D., Kondorosi, A.,et al. (2003). En ny familie i Medicago truncatula bestående af mere end 300 knudespecifikke gener, der koder for små, udskillede polypeptider med konserverede cysteinmotiver. Plant Physiol. 132, 161–173. doi: 10.1104/pp.102.018192
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mergaert, P., Uchiumi, T., Alunni, B., Evanno, G., Cheron, A., Catrice, O.,et al. (2006). Eukaryotic control on bacterial cell cycle and differentiation in the Rhizobium-legume symbiosis. Proc. Natl. Acad. Sci. U.S.A. 103, 5230–5235. doi: 10.1073/pnas.0600912103
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Moran, N. A. (1996). Accelereret evolution og Mullers skralde i endosymbiotiske bakterier. Proc. Natl. Acad. Sci. USA 93, 2873-2878. doi: 10.1073 / pnas.93.7.2873
CrossRef Fuld tekst
Moran, N. A., McCutcheon, J. P. og Nakabachi, A. (2008). Genomik og udvikling af arvelige bakterielle symbionter. Annu. Pastor Genet. 42, 165–690. doi: 10.1146 / annurev.genet.41.110306.130119
CrossRef Fuld tekst
Nakabachi, A., Koshikava, S., Miura, T. og Miyagishima, S. (2010). Genomstørrelse af Pachypsylla venusta (Hemiptera: Psyllidae) og ploidien af dens bakteriocyt, den symbiotiske værtscelle, der har intracellulære mutualistiske bakterier med det mindste cellulære genom. Bull. Entomol. Res. 100, 27-33. doi: 10.1017 / S0007485309006737
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Nagl, V. (1976). DNA endoreduplikation og polyteni forstås som evolutionære strategier. Natur 261, 614-615. doi: 10.1038/261614a0
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Nallu, S., Silverstein, K. A. P., Young, N. D. og Vandenbosch, K. A. (2014). Mønstre af divergens af en stor familie af nodule cysteinrige peptider i tiltrædelser af Medicago truncatula. Plante J. 78, 697-705. doi: 10.1111 / tpj.12506
Pubmed abstrakt / Pubmed Fuld tekst / CrossRef Fuld tekst
Oldroyd, G. E. (2013). Tal, ven og indtast: signalsystemer, der fremmer gavnlige symbiotiske foreninger i planter. Nat. Rev. Microbiol. 11, 252–263. doi: 10.1038/nrmicro2990
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Oono, R., Schmitt, I., Sprent, J. I., and Denison, R. F. (2010). Multiple evolutionary origins of legume traits leading to extreme rhizobial differentiation. New Phytol. 187, 508–520. doi: 10.1111/j.1469-8137.2010.03261.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Penterman, J., Abo, R. P., De Nisco, N. J., Arnold, M. F., Longhi, R., Zanda, M.,et al. (2014). Værtsplantepeptider fremkalder et transkriptionelt respons for at kontrollere Sinorhisobium meliloti cellecyklus under symbiose. Proc. Natl. Acad. Sci. U. S. A. 111, 3561-3566. doi: 10.1073 / pnas.1400450111
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
pris, D. R., Duncan, R. P., Shigenobu, S. og Vilson, A. C. (2011). Genomudvidelse og differentiel ekspression af aminosyretransportører ved den symbiotiske grænseflade bladlus/buchnera. Mol. Biol. Evol. 28, 3113–3126. doi: 10.1093/molbev/msr140
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Roudier, F., Fedorova, E., Lebris, M., Lecomte, P., Györgyey, J., Abad, P.,et al. (2003). The Medicago species A2-type cyclin is auxin regulated and involved in meristem formation but dispensable for endoreduplication-associated developmental programs. Plant Physiol. 131, 1091–1103. doi: 10.1104/pp.102.011122
CrossRef Full Text
Roux, B., Rodde, N., Jardinaud, M. F., Timmers, T., Sauviac, L., Cottret, L.,et al. (2014). En integreret analyse af plante-og bakteriegenekspression i symbiotiske rodknuder ved hjælp af laser-capture mikrodissektion koblet til RNA-sekventering. Plante J. 77, 817-837. doi: 10.1111 / tpj.12442
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Shigenobu, S., and Stern, D. L. (2013). Bladlus udviklede nye udskillede proteiner til symbiose med bakteriel endosymbiont. Proc. Biol. Sci. 280, 20121952. doi: 10.1098 / rspb.2012.1952
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
Sinharoy, S., Torres-jeres, I., Bandyopadhyay, K., Keresst, A., Pislariu, C. I., Nakashima, J.,et al. (2013). C2H2-transkriptionsfaktorregulatoren for symbiosom-differentiering undertrykker transkription af det sekretoriske vejgen VAMP721a og fremmer symbiosom udvikling i Medicago truncatula. Plantecelle 25, 3584-3601. doi: 10.1105 / tpc.113.114017
Pubmed abstrakt / Pubmed Fuld tekst/CrossRef Fuld tekst
Terpolili, J. J., Hood, G. A., and Poole, P. S. (2012). What determines the efficiency of N(2)-fixing Rhizobium-legume symbioses? Adv. Microb. Physiol. 60, 325–389. doi: 10.1016/B978-0-12-398264-3.00005-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tiricz, H., Szûcs, A., Farkas, A., Pap, B., Lima, R. M., Maróti, G.,et al. (2013). Antimicrobial nodule-specific cysteine-rich peptides induce membrane depolarization associated changes in Sinorhizobium meliloti. Appl. Env. Microbiol. 79, 6737–6746. doi: 10.1128/AEM.01791-13
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Van de Velde, W., Zehirov, G., Szatmari, A., Debreczeny, M., Ishihara, H., Kevei, Z.,et al. (2010). Plant peptides govern terminal differentiation of bacteria in symbiosis. Science 327, 1122–1126. doi: 10.1126/science.1184057
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vinardell, J. M., Fedorova, E., Cebolla, A., Kevei, Z., Horvath, G., Kelemen, Z.,et al. (2003). Endoreduplikation medieret af den anafasefremmende komplekse aktivator CCS52A er påkrævet til symbiotisk celledifferentiering i Medicago truncatula knuder. Plantecelle 15, 2093-2105. doi: 10.1105 / tpc.014373
Pubmed abstrakt | Pubmed Fuld tekst/CrossRef Fuld tekst
rollator, S. A., J. A. (2000). Indgang af jordstængler leguminosarum bv. viciae i rodhår kræver minimal Nodfaktorspecificitet, men efterfølgende infektionstrådevækst kræver nodO eller nodE. Mol. Plant-Mikrobe Interagerer.13, 54–62. doi: 10.1094 / MPMI.2000.13.7.754
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text