- introduktion
- materialer og metoder
- Instrumental analyse
- mikrobielle kulturer
- Mediepræparat
- fermentering af Drostanolone Enanthate (1) med C. aphidicola ATCC 28300 og F. lini NRRL 2204
- 2 liter-Methyl-3 liter,14 liter, 17 liter-trihydroksi-5 liter-androstan (2)
- 2α-Methyl-7α-hydroxy-5α-androstan-3,17-dion (3)
- 2α-Methyl-3α,17β-dihydroxy-5α-androstan (4)
- 2-Methylandrosta-1,4-dien-3,17-dion (5)
- 2-Methylandrosta-11-3,17-dion (7)
- 2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
- 2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
- Experimental Protocol for Cytotoxicity
- resultater og diskussion
- strukturbelysning
- cytotoksicitet mod HeLa -, PC3 -, H640-og HCT116-kræft og 3T3 normale cellelinjer
- struktur-aktivitetsforhold
- konklusion
- Forfatterbidrag
- interessekonflikt Erklæring
- anerkendelser
- supplerende materiale
introduktion
mikrobiel transformation er en af de vigtigste tilgange til strukturel transformation af forskellige klasser af organiske forbindelser. Denne teknik er blevet anvendt med succes i grøn kemi, dvs. lægemiddelopdagelses-og udviklingsprogrammerne, der giver en fremragende kilde til forbindelser omkring kernestrukturer, efterfulgt af screening for forskellige biologiske aktiviteter. I flere tilfælde er mikrobiel transformation blevet brugt som et vigtigt redskab til regio-, kemo-og stereoselektive konverteringer af organiske forbindelser, som er vanskelige at opnå ved konventionelle metoder (Holland og Uber, 2000; Fernandes et al., 2003; Mihovilovic et al., 2003; Yildirim et al., 2003; Bartmanska et al., 2005; Borges et al., 2009; Choudhary et al., 2011; Ravindran et al., 2012). På grund af den inaktive karakter af carbonhydridskelet af steroider er de ofte vanskelige at blive derivatiseret ved konventionelle syntetiske metoder. Derfor anvendes mikrobiel transformation ofte til strukturel ændring af steroider. Tilstedeværelsen af P450-cytokromsystemer i svampe gør biokatalyse i hele celler til et effektivt værktøj til stereo-og regio-specifik hydroksylation (Choudhary et al., 2005A; Tong og Dong, 2009; Kristan og Ri Kurtner, 2012; Baydoun et al., 2014).
Drostanolone og dets esterderivater, såsom drostanolone propionat, drostanolone pentanoat og drostanolone Enanthate (1) er anabolske androgene steroider (AASs), der anvendes af atleter til at styrke deres muskler uden at få fedt. Desuden har Drostanolon og dets esterderivater evnen til at hæmme produktionen af østrogen. Propionatester af Drostanolon bruges også til behandling af brystkræft under varemærket Masteron (Chovdhury et al., 1976; Clavel et al., 1982; Marinov et al., 1986; Vardar et al., 2002; Bahrke og Yesalis, 2004).
kræft er i øjeblikket anerkendt som en stor folkesundhedsudfordring. Kræft er den næstledende dødsårsag i USA og over hele verden. Ifølge Verdenssundhedsorganisationen (hvem) er forekomsten af kræft over 6 millioner tilfælde om året. Kræftceller har høj proliferationshastighed. De spredes hurtigt i det levende system og kan overleve mod stærke kemoterapeutika og DNA-skadelige stoffer. På samme måde har cytotoksiske lægemidler mange bivirkninger på normale celler, og deres anvendelse i kræftkemoterapi er således en terapeutisk udfordring. På grund af dette er der behov for udvikling af sikre, effektive og selektive kemoterapeutiske midler mod forskellige kræftformer (Munose-Pinedo et al., 2012; Su et al., 2015; Pernille et al., 2015; Rebecca et al., 2016).
brystkræft er en af de mest almindelige kræftformer i 140 lande i verden. Det er en væsentlig årsag til kræftrelateret død hos kvinder over hele verden, kendetegnet ved den unormale vækst af celler i brystlobulerne eller kanalerne med den høje proliferationshastighed (Hanahan og Viinberg, 2000; Ferlay et al., 2015).
livmoderhalskræft er den næstmest dominerende kræft hos kvinder over hele verden efter brystkræft. Den vigtigste årsag til livmoderhalskræft er dannelsen af maligne celler i væv i livmoderhalsen (Vang et al., 2013; Latifah, 2014; Pariente et al., 2016). HeLa-kræftcellelinjen, opnået fra humane livmoderhalscancerceller, er en almindelig cellulær model til evaluering af testforbindelsernes cytotoksiske potentiale.
prostatacancer er den næstledende kræft hos mænd over hele verden efter bronchus kræft, og den tredje mest almindelige årsag til kræftdød. Det er den mest almindelige årsag til malignitet hos mænd. Dens forekomst stiger med alderen, mere almindelig over 50 år (Henry og omahony, 1999; De-Bono et al., 2010; Jørgen et al., 2015). PC – 3-kræftcellelinjen, opnået fra mandlige prostatacancerceller, er en meget anvendt model til at undersøge toksiciteten af testforbindelser.lungekræft er en meget udbredt kræft blandt mænd i USA siden midten af 1950 ‘erne og blandt kvinder siden slutningen af 1980’ erne. Det er en førende årsag til kræftrelateret død. Lungekræft skyldes for det meste rygning (Travis et al., 2002; Villanti et al., 2013; Mishra et al., 2016). H460-kræftcellelinjen, opnået fra humane lungecancerceller (lymfogen metastatisk underlinie af humant storcellet lungecarcinom), bruges ofte til at evaluere cytotoksicitet af testforbindelser.
efter bryst -, lunge-og prostatacancer er tyktarmskræft den fjerde mest udbredte kræft over hele verden. Det er kræften, der findes i omtrent lige hyppighed hos mænd og kvinder. Det er den næst mest almindelige årsag til kræftrelaterede dødsfald i vestlige lande (Levin et al., 2008; Andre et al., 2009; Ahearn et al., 2012). Hct116-kræftcellelinjen, opnået fra humane tyktarmscancerceller, bruges almindeligvis til at vurdere cytotoksiciteten af testforbindelser.
i forlængelse af vores undersøgelser om svampetransformation af bioaktive steroider (Choudhary et al., 2005B, c, 2007, 2010; Ahmad et al., 2014; Pernille et al., 2017) syntetiserede vi analoger af drostanolone enanthate (1) gennem dets transformation med cephalosporium aphidicola og fusarium lini. Metabolitter 2-9 såvel som substrat 1 blev evalueret mod HeLa (cervical carcinoma), PC-3 (prostatacarcinom), H460 (lungekræft), hct116 (tyktarmskræft) og 3T3 (musefibroblast normal) cellelinjer ved hjælp af cellebaseret analyse med høj kapacitet, den mest effektive og praktiske laboratoriemetode, MTT-analysen til at forudsige respons af testforbindelser i maligniteter, hvor de viste specificitet over for kræftcellerne. Denne undersøgelse har således identificeret anticancermetabolitter af drostanolone enanthate (1) til yderligere undersøgelser.
materialer og metoder
Instrumental analyse
tyndtlagskromatografi (TLC) (silicagel, 20 liter 20, 0,25 mm tyk, PF254, Merck, Tyskland) blev anvendt til analyse af grad af transformation og renhed. Silicagelkolonnekromatografi (70-230 mesh, E. Merck, Tyskland) blev anvendt til den indledende oprensning af metabolitter. Derudover blev præparativ reversfasegenvinding (JAI LC-908V, Japan), udstyret med YMC L-80 (4-5 liter, 20-50 mm i.d.), anvendt til den endelige oprensning af metabolitter. Strukturer af metabolitter blev belyst ved hjælp af 1h- (400, 500 og 600 Mh ‘er) og 13C-NMR (100, 125 og 150 Mh’ er) spektre, som blev registreret på Bruker Avance-NMR-spektrometre (Frankrig) i CD3OD, CD3COCD3 eller DMSO-D6. HREI-MS og IR spektre blev udført på JEOL JMS – 600h (Japan) (dobbeltfokuseret magnetisk sektormasseanalysator) massespektrometer (EI, elektronpåvirkningionisering) og Bruker vektor 22 FT-ir spektrofotometer, henholdsvis. Optiske rotationer af metabolitter blev registreret på JASCO P-2000 polarimeter (Japan). Evolution 300 UV-synligt spektrofotometer blev brugt til at registrere UV-spektre. Smeltepunkterne for de transformerede produkter blev målt ved hjælp af buchi M-560-instrumentet. Enkeltkrystal røntgendiffraktionsdata blev indsamlet på Bruker APEKSII D8 Venture diffraktometer, udstyret med PHOTON 100 detektor (CMOS-teknologi) og finfokuseret forseglet rør med røntgenkilde (cu Ka-strålinger larr = 1,54178 larr). Refleksionsintensiteter blev integreret ved hjælp af SAINT-programmer. Absorptionskorrektion blev udført på Multiscanning, og strukturen blev løst af Gerlier and Thomasset, 1986; Sheldrick, 2008; Spek, 2009).
mikrobielle kulturer
mikrobiel kultur af C. aphidicola ATCC 28300 og F. lini NRRL 2204 blev opnået fra henholdsvis American Type Culture Collection (ATCC) og Northern Regional Research Laboratories (NRRL). Kulturer blev dyrket på sabouraud-dekstrose-agar (SDA) skrå og opretholdt ved 4 liter C.
Mediepræparat
fire liter medier til vækst af C. aphidicola ATCC-28300 blev fremstillet ved blanding af 200 g glucose, 4 g KH2PO4, 8 g glycin, 4 g KCl, 8 g MgSO4.7h2o og 8 mL sporstoffer i 4 L destilleret vand. Tilsvarende blev fire liter medier fremstillet til F. lini NRRL 2204 ved blanding af 40 g glucose, 20 g gærekstrakt, 20 g pepton, 20 g KH2PO4, 20 g NaCl og 40 mL glycerol i 4 L destilleret vand.
fermentering af Drostanolone Enanthate (1) med C. aphidicola ATCC 28300 og F. lini NRRL 2204
Medium til vækst af C. aphidicola og F. lini blev fremstillet ved blanding af ovennævnte ingredienser i 4 L destilleret vand for hver svamp, som derefter blev dispenseret ligeligt i 40 Erlenmeyer kolber på 250 mL (100 mL i hver kolbe). Alle disse kolber blev autoklaveret ved 121 kr. C og blev podet med SDA-skråninger af C. aphidicola ATCC 28300 og F. lini NRRL 2204 under steriliserede betingelser. Disse svampekulturer indeholdende kolber blev efterladt på den roterende ryster (121 omdr. / min.) ved 26 liter 2 liter C i 3-4 dage for at opnå maksimal vækst af C. aphidicola og F. lini. Forbindelse 1 (1 g) blev opløst i 20 mL acetone for hver svamp og blev dispenseret 0,5 mL i hver kolbe og igen anbragt på roterende ryster i 12 dage. En negativ kontrol (medium + svampekultur) såvel som positiv kontrol (medium + substrat) blev også fremstillet analogt til evaluering af henholdsvis svampemetabolitterne og nedbrydningen af forbindelse 1. Efter inkubation af 12 dage blev alle kolberne filtreret og ekstraheret med 20 L dichlormethan (DCM), organisk fase blev adskilt og derefter fordampet under reduceret tryk på roterende fordamper. Dette gav 1,5 g lysegult fast råstof. Dette råmateriale blev fraktioneret over silicagelkolonnekromatografi ved eluering med gradientheksaner og acetoneopløsningssystemer. Søjlekromatografi gav fire hovedfraktioner (1-4), som derefter blev oprenset ved genanvendelse af HPLC. Metabolitter 2 (tR = 16 min, 8 mg, 0,8%), 3 (tR = 19 min, 11 mg, 1,1%), 4 (tR = 17 min, 35 mg, 3,5%), 5 (tR = 23 min, 42 mg, 4,2%), 6 (tR = 20 min, 9 mg, 0,9%), 7 (tR = 21 min, 12 mg, 1,2%) og 9 (tR = 18 min, 5 mg, 0,5%) blev oprenset fra fraktioner 1-7 henholdsvis gennem revers fase genanvendelse HPLC under anvendelse af methanol – vand som opløsningsmiddel system (meoh: H2O; 70: 30). Der henviser til, metabolit 8 blev opnået fra fraktion 8 gennem normal fase genanvendelse HPLC (tR = 32 min, CHCl3: MeOH; 95: 5, 7.5 mg, 0, 75%).
2 liter-Methyl-3 liter,14 liter, 17 liter-trihydroksi-5 liter-androstan (2)
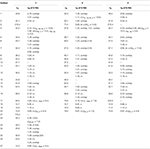
tabel 1. 13C-og 1H-NMR kemiske skiftdata (J og H1/2 i HS) af forbindelser 1-3 (liter ppm).
2α-Methyl-7α-hydroxy-5α-androstan-3,17-dion (3)
2α-Methyl-3α,17β-dihydroxy-5α-androstan (4)
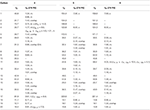
Tabel 2. 13C-og 1H-NMR kemiske skiftdata (J og H1/2 i HS) af forbindelser 4-6 (liter ppm).
2-Methylandrosta-1,4-dien-3,17-dion (5)
2-Methylandrosta-11-3,17-dion (7)
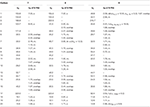
tabel 3. 13C-og 1H-NMR kemiske skiftdata (J og H1/2 i HS) af forbindelser 7-9 (liter ppm).
2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
Experimental Protocol for Cytotoxicity
The cytotoxicity of samples was measured against HeLa (human cervical carcinoma ATCC CCl-2), PC-3 (human prostate cancer ATCC CRL-1435), NCl-H460 (human lung carcinoma ATCC HTB-177), HCT116 (human colon cancer ATCC CCl-247), and 3T3 (control fibroblast normal ATCC CRL-1658) cell lines by using standard MTT assay. Cellelinjer blev dyrket i DMEM F12-medier suppleret med 10% FBS under en 5% CO2-atmosfære ved 37 liter C i en inkubator.
det kolorimetriske assay MTT blev anvendt til evaluering af cellemetabolsk aktivitet. I dette assay reduceres den gule MTT til lilla formason i mitokondrierne i de levende celler (Gerlier og Thomasset, 1986). Jo mere levende celler, jo mere observeres farven og dermed mere absorbans af kolorimeter (Fesahat et al., 2015). Vi har brugt denne metode til at analysere effekten af vores transformerede produkter på cellulær cytotoksicitet mod kræftceller. Omkring 10.000 celler i hver cellelinie (HeLa, PC3, H460, hct116 kræftformer og 3T3 normale) blev podet i 96-brøndsplader. Efter at have nået 80-90% konfluens blev de behandlet med forskellige koncentrationer af forbindelser (25, 50, 75, 100 og 200 liter) i 24 h. alle forbindelser blev opløst i steril DMSO for at fremstille en 200 mM stamopløsning. Opløsningen blev filtreret, og serielle fortyndinger blev lavet i vækstmedium. 600 liter af hver fortynding blev anvendt til at behandle 3 brønde (tre eksemplarer af hver) af 96 brøndplade, dvs.200 liter hver. Hvert eksperiment blev udført i tre biologiske replikater. MTT blev tilsat og inkuberet i 4 timer.efter fjernelse af MTT blev de lilla formasonkrystaller opløst i DMSO, og aflæsning blev observeret ved henholdsvis 540 og 570 nm for normale celler og kræftceller. 540 nm i DMSO-behandlede 3T3 fibroblastceller (der er mere sammenflydende i morfologi), mens 570 nm giver i tilfælde af kræftceller (Bonmati-Carrion et al., 2013; Danihelov Kurt et al., 2013). En bred vifte af epitelcarcinomcellelinjer blev anvendt i dette eksperiment, hvor cisplatin var et almindeligt valg af lægemiddel. Det er målrettet mod DNA, forstyrrer celledeling under mitose og inducerer apoptose (Eastman, 1999). IC50-værdier blev beregnet for at bestemme den mindste koncentration, der kræves for at dræbe 50% af cellerne.
mens
at = Absorbansværdi af testforbindelse
Ab = Absorbansværdi af blank
Ac = Absorbansværdi af kontrol
resultater og diskussion
strukturbelysning
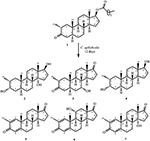
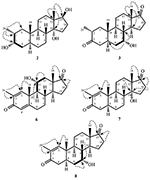
figur 1. Biotransformation af drostanolone enanthate (1) med cephalosporium bladlus.
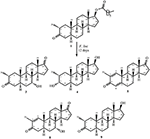
figur 2. Biotransformation af drostanolone enanthate (1) med Fusarium lini.
metabolit 2 blev isoleret som hvide krystaller. Molekylformlen C20H30O3 var baseret på HREI-MS, som viste at m/å 322,2517 (calcd. 322.2508, C20H34O3), hvilket antyder tilsætning af tre brint og et iltatom, reduktion af C-3 ketonisk carbonylog hydrolytisk spaltning af heptanoat sidekæde i substrat 1. Ir-absorbansen ved 3.531 og 3.423 cm – 1 skyldtes tilstedeværelsen af hydroksylgrupper. 1H-NMR-spektret viste et yderligere metinprotonsignal ved kr. 3,69 (tabel 1) (datablad 2). Signalerne for heptanoat sidekæde blev også fundet mangler i 1H-NMR spektrum af forbindelse 2. 13C-NMR-spektret viste signaler for et nyt methinkulstof ved karbon 71,4 og et nyt kvaternært karbon ved karbon 84,8. Kulstofsignaler for heptanoatkæde og ketonisk carbonyl blev også fundet manglende i 13C-NMR-spektret. Dette antydede reduktion af C-3 carbonyl, hydrolytisk tab af heptanoatkæde og tilsætning af en OH ved C-14 (tabel 1). OH-gruppen blev placeret ved C-3 på basis af hmbc-korrelationer af H3-20 (0,91, d) med C-3 (71,4) (figur 3). Dette skyldtes reduktionen af C-3 carbonyl. Anden OH-gruppe blev placeret ved C-14, baseret på hmbc-korrelationen af H3-18 (0,81, s) med C-14 (84,8). Den tredje OH var ved C-17, skyldtes hydrolytisk tab af heptanoatdel. O – H-gruppen ved C-3 blev udledt til at være kursorienteret baseret på NOESY-korrelationerne af H-3 (Kurt 3.69, br. s) med kursorienteret H – 2 (kur 1,64, overlapning) og kursorienteret H3-20 (kur 0,91, d) (figur 4). OH – 14 blev udledt til at være Kristian-orienteret, baseret på NOESY-korrelationer af H-9 (Kurt 1,32, m) med OH-14 (Kurt 2,66, s) (acetone-D6). Enkeltkrystal røntgendiffraktionsanalyse understøttede yderligere strukturen af metabolit 2, bestående af tre ringe i stolkonformation (A, B og C) og en i envelopkonformation (D). Tre OH-grupper ved C-3, C-14 og C-17 blev tildelt, kr. -, kr. – og kr.-orientering (figur 5). Enkeltkrystaldiffraktionsdata for metabolit 2 blev forelagt Cambridge Crystallographic Data Collection (CCDC 1500706). Strukturen af metabolitten 2 blev således udledt som 2 liter-methyl-3 liter,14 liter, 17 liter-trihydroksi-5 liter-androstan.
figur 3. Nøgle HMBC (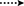 ) og Cosy (
) og Cosy ( ) korrelationer i nye metabolitter.
) korrelationer i nye metabolitter.
figur 4. Nøgle NOESY korrelationer i nye metabolitter.
metabolit 3 blev opnået som et hvidt fast stof. HREI-MS viste at m / å 318.2192 (calcd. 318.2195, C20H30O3). Dette repræsenterede tabet af heptanoat sidekæde, og tilsætning af et iltatom i substrat 1. Ir-spektret viste absorbanser for OH (3.436 cm−1) og ketoncarbonyler (1.711 cm−1). I 1H-NMR-spektret blev signaler fra heptanoatkæde og C-17 metinproton fundet manglende, hvorimod et nyt metinprotonsignal i nedfeltfeltet blev observeret ved kur 3,92 (tabel 1) (datablad 3). Dette foreslog hydroksylering af steroidskelet og oksidativ spaltning af heptanoatdelen. 13C-NMR-spektret understøttede også ovenstående slutninger. Carbon signaler for heptanoat del blev fundet mangler, hvorimod en ny ketoncarbonyl og en oksy-methin signaler dukkede op i 13C-NMR spektrum (tabel 1). Dette indikerede iltning af heptanoatkæden og hydroksylering i substrat 1. Den nyligt fremkomne metinproton ved Kurt 3.92 (H-7) viste hmbc-korrelationer med C-5 og C-8, hvilket tyder på en OH ved C-7 (Figur 3). Hmbc-korrelationerne af H3-18 og H2-16 med et kulstof ved 223,8-kr.foreslog et ketonisk kulstof ved C-17. OH ved C – 7 blev yderligere understøttet af hyggelige korrelationer af H-7 med H2-6 og H-8. H – 7 (Kurt 3.92, s) viste NOESY korrelationer med aksialt orienteret H-8 (Kurt 1.70, overlapning), som foreslog en kurr-orientering af OH ved C-7 (Figur 4). Således blev strukturen af metabolit 3 udledt som 2-l-methyl-7-L-5-L-androstan-3,17-dion.
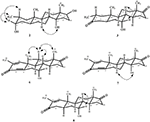
enkeltkrystal Røntgendiffraktionsanalyser blev også udført på forbindelser 1 og 5. Forbindelse 1 bestod af fire ringe, dvs. A, B, C og D med stol, stol, stol og konvolutkonformationer. En methyl var til stede ved C-2 med Ækvatorial orientering. Heptanoatester kæde var til stede ved C-17 af ring D (figur 6). Mens metabolit 5 indeholder ringe A, B, C og D i planer, stol, stol og indhyllingskonformationer. Heptanoat sidekæde var fraværende i metabolit 5 (Figur 7). Enkeltkrystaldiffraktionsdata for metabolitterne 1 og 5 blev indsendt til Cambridge krystallografisk dataindsamling (henholdsvis CCDC 1500705 og CCDC 1500707). Enkeltkrystal Røntgendiffraktionsanalysedata for forbindelser 1, 2 og 5 er vist i tabel 4.
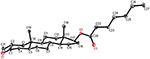
figur 6. Computergenereret ORTEP-tegning af den endelige Røntgenmodel af forbindelse 1. Farvekoder: kulstof, sort; ilt, rød.
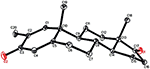
Figur 7. Computergenereret ORTEP-tegning af den endelige Røntgenmodel af forbindelse 5. Farvekoder: kulstof, sort; ilt, rød.

Tabel 4. Enkeltkrystal røntgendiffraktionsanalyse af forbindelser 1, 2 og 5.
cytotoksicitet mod HeLa -, PC3 -, H640-og HCT116-kræft og 3T3 normale cellelinjer
naturlige produkter, f.eks. flavonoider, steroider, terpener osv. kan tjene som en fremragende kilde til produktion af mange lægemidler, da de rapporteres for mange biologiske aktiviteter såsom anticancer, antiinflammatorisk, anti-leishmanial, antibakteriel aktivitet osv. Derfor er det nødvendigt at derivatisere dem for at studere struktur-aktivitetsforhold, som kan være nyttigt til syntese af sikre og effektive lægemidler. På nuværende tidspunkt syntetiseres mange farmaceutiske produkter effektivt via mikrobiel biotransformation på grund af tilstedeværelsen af en række forskellige stoffer i dem. Baseret på rapporteret anticanceraktivitet af Drostanolon (9), drostanolonpropionat og drostanolonheptanoat (1) blev forbindelser 1-9 evalueret for cytotoksicitet mod hela, PC-3, H460 og HCT116 kræftcellelinjer. Interessant nok viste alle forbindelser en moderat til potent anticanceraktivitet. Anticanceraktiviteten af forbindelser 1-9 blev udledt fra IC50-værdierne mod HeLa (humant livmoderhalscarcinom), PC-3 (human prostatacancer), H460 (human lungekræft) og HCT116 (human tyktarmskræft) (tabel 5). Baseret på disse resultater blev cytotoksiciteten af disse forbindelser også evalueret mod 3T3 (musefibroblast) normal cellelinie, hvor alle forbindelser, undtagen 8 (IC50 = 74,6 liter 3,7 liter) og 9 (IC50 = 62,1 liter 1,2 liter), viste sig at være ikke-cytotoksiske.

tabel 5. Cytotoksicitet af forbindelser 1-9 mod HeLa -, PC3 -, H460-og HCT116-kræft og 3T3 normale cellelinjer.
struktur-aktivitetsforhold
variationer i metabolitternes strukturer påvirkede deres anticanceraktivitet. Metabolit 2 med fravær af esterdel, og to Ao-h grupper ved C-3, og C-14, og en larso-h gruppe ved C-17 viste en lavere cytotoksicitet mod hela, H460, og hct116 cancercellelinjer, men dens anti-cancer aktivitet var højere mod PC-3 cancercellelinie, sammenlignet med forbindelse 1. Metabolit 3 med tabet af estergruppe og to ketogrupper ved C-3 og C-17 og Ao-h-gruppe ved C-7 viste også en lavere aktivitet mod hela -, H460-og HCT116-kræftcellelinjer, men øget aktivitet mod PC-3-kræftcellelinie sammenlignet med substrat 1. Reduktion af C-3 carbonyl til O-H og hydrolytisk spaltning af esterdel i forbindelse 4 øgede sin aktivitet mod både HeLa og PC-3 kræftcellelinjer til en vis grad, men dens anticanceraktivitet mod H460 og HCT116 kræftcellelinjer faldt sammenlignet med substrat 1. Tilstedeværelse af C = C mellem C-1/C-2 og C-4 / C-5 sammen med C = O ved C-3 og C-17 gjorde metabolit 5 til et potent anticancermiddel mod HeLa-kræftcellelinie sammenlignet med substrat 1 og standardlægemidlet (cisplatin). Desuden blev dets anticanceraktivitet mod PC-3 kræftcellelinie også øget sammenlignet med substrat 1. Interessant nok var dets anticanceraktivitet mod h460 og HCT116 kræftcellelinjer lavere sammenlignet med forbindelse 1. Tilstedeværelse af C = C mellem C-1/C-2 og C-4 / C-5, C = O ved C-3 og C-17 sammen med ao-H-gruppen ved C-11 i metabolit 6 øgede sin anticanceraktivitet mod HeLa og PC-3 kræftcellelinjer sammenlignet med substrat 1 og viste lignende anticancerpotentiale mod HeLa kræftcellelinie som standardlægemiddel (cisplatin). Imidlertid faldt dets anticanceraktivitet mod h460 og hct116 kræftcellelinjer i sammenligning med forbindelse 1. Tilstedeværelse af C = C mellem C-1/C-2 og C-4 / C-5, C = O ved C-3 og C-17 sammen med ao-H-gruppen ved C-14 i metabolit 7 øgede igen sin anticanceraktivitet mod HeLa og PC-3 kræftcellelinjer og nedsatte dens anticanceraktivitet mod H460 og hct116 cellelinjer sammenlignet med substrat 1. Tilstedeværelse af C = C ved C-1 / C-2, C = o Ved C-3 og C-17 og aOH ved C-7 gjorde metabolit 8 til den mest potente anticancer mod HeLa-kræftcellelinie sammenlignet med substrat 1 og standardlægemidlet (cisplatin). Det viste også en god aktivitet mod PC – 3 kræftcellelinie, men nedsat anticanceraktivitet mod H460 og HCT116 kræftcellelinjer sammenlignet med substrat 1. Metabolit 9 med kun hydrolyse ved C-17 viste øget anticanceraktivitet mod hela -, PC-3-og HCT116-kræftcellelinjer, men nedsat cytotoksicitet mod h460-kræftcellelinie sammenlignet med substrat 1 og standardlægemidlet (cisplatin). På baggrund af ovenstående diskussion kan det konkluderes, at øget anticanceraktivitet af forbindelser 5-8 mod HeLa og PC-3 kræftcellelinjer sandsynligvis skyldtes tilstedeværelsen af C = C ved C-1/C-2 og carbonylketon ved C-3 og C-17 i sammenligning med substrat 1.
konklusion
Forfatterbidrag
begrebet præsenteret forskning blev udviklet og designet af MIC. MIC var også projektleder. Alle data blev analyseret og fortolket af MIC, A-T-H og HC. MS, SY, MA og NF udførte eksperimenterne. MIC, A-T-H og MS skrev manuskriptet. Alle forfatterne reviderede manuskriptet. Den endelige version af manuskriptet blev også godkendt af MIC inden indsendelse.
interessekonflikt Erklæring
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
anerkendelser
A-T-H, og MIC anerkender den muliggørende rolle for Higher Education Commission, Islamabad, Pakistan, gennem en økonomisk støtte under “undersøgelser af kemoprævention af Brystcarcinogenese af diætmidler, (20-3790/NRPU/R&D/HEC/13 / 793).”SY anerkender den økonomiske støtte fra Organisationen for forbud mod kemiske våben gennem et forskningsprojekt med titlen “strukturelle og biologiske undersøgelser af nye anabolske steroider opnået ved biotransformation.”HC anerkender den økonomiske støtte fra” Dekanship of Scientific Research (DSR), Kong Abdulas Universitet, Undervisningsministeriet, Saudi-Arabien.”
supplerende materiale
Eastman, A. (1999). “Virkningsmekanismen for cisplatin: fra addukter til apoptose,” i Cisplatin: Kemi og biokemi af et førende lægemiddel mod kræft, ed B. Lippert (Verlag Helvetica Chimica Acta), 111-134. doi: 10.1002 / 9783906390420. ch4
CrossRef fuldtekst/Google Scholar
Vardar, E., Vardar, S. A. og Cengis, T. (2002). Anabolske-androgen steroid misbrug. Anato. J. Psykiatri 3, 104-107.