doseringsform: injektion
medicinsk gennemgået af Drugs.com. sidst opdateret den 22. december 2020.
- bivirkninger
- dosering
- professionel
- interaktioner
- graviditet
- mere
rks kun.
steril intravenøs opløsning
- Inamrinon beskrivelse
- Inamrinon – Klinisk Farmakologi
- farmakokinetik
- farmakodynamik
- indikationer og anvendelse til inamrinon
- kontraindikationer
- advarsler
- forholdsregler
- generelt
- laboratorieundersøgelser
- lægemiddelinteraktioner
- kemiske interaktioner
- carcinogenese, mutagenese, nedsat fertilitet
- graviditet
- ammende mødre
- pædiatrisk anvendelse
- bivirkninger
- håndtering af bivirkninger
- overdosering
- Inamrinon Dosering og Administration
- kemiske interaktioner
- sådan leveres Inamrinon
- VIAL LABEL
- More about inamrinone
- Related treatment guides
Inamrinon beskrivelse
INAMRINONINJEKTION USP repræsenterer en ny klasse af hjerte-inotrope midler, der adskiller sig fra digitalis glycosider eller catecholaminer. Inamrinonlactat betegnes kemisk som 5-Amino-6(1h)-et 2-hydroksypropanat og har følgende struktur:
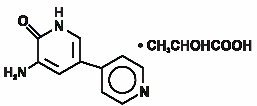
Inamrinon er en lysegul krystallinsk forbindelse med en molekylvægt på 187,20 og en molekylformel på C10H9N3O. hver mol mælkesyre har en molekylvægt på 90,08 og en molekylvægt på empirisk formel af c3h6o3. Opløselighederne af Inamrinon ved pH 4,1, 6,0 og 8,0 er henholdsvis 25, 0,9 og 0,7 mg/mL.
inamrinoninjektion er en klar gul steril opløsning tilgængelig i 20 mL hætteglas til intravenøs administration. Hver mL indeholder Inamrinonlactat svarende til 5 mg Inamrinon og 0, 25 mg natriummetabisulfit tilsat som konserveringsmiddel i vand til injektion. Alle doser udtrykt i indlægssedlen udtrykkes i form af basen, Inamrinon. PH-værdien justeres til mellem 3,2 og 4,0 med mælkesyre eller natriumhydroksid. Den samlede koncentration af mælkesyre kan variere mellem 5 mg og 7,5 mg.
Inamrinon – Klinisk Farmakologi
Inamrinon er et positivt inotrop middel med vasodilatoraktivitet, forskellig i struktur og virkemåde fra enten digitalisglykosider eller catecholaminer.
mekanismen for dens inotrope og vasodilatorvirkninger er ikke blevet belyst fuldt ud.
med hensyn til dets inotrope virkning indikerer eksperimentelle beviser, at det ikke er en beta-adrenerg agonist. Det hæmmer myocardial cyklisk adenosinmonophosphat (C-AMP) phosphodiesterase aktivitet og øger cellulære niveauer af c-AMP. I modsætning til digitalis hæmmer det ikke natrium-kaliumadenosintriphosphataseaktivitet.
Med hensyn til dets vasodilatoriske aktivitet reducerer Inamrinon afterload og preload ved sin direkte afslappende virkning på vaskulær glat muskel.
farmakokinetik
efter intravenøs bolus (1 til 2 minutter) injektion på 0,68 mg/kg til 1,2 mg/kg til normale frivillige forsøgspersoner havde Inamrinon et fordelingsvolumen på 1,2 liter / kg, og efter en halveringstid på ca.4,6 minutter i plasma havde Inamrinon en gennemsnitlig tilsyneladende terminal eliminationshalveringstid på ca. 3,6 timer. Hos patienter med kongestiv hjerteinsufficiens, der fik infusioner af Inamrinon, var den gennemsnitlige tilsyneladende førsteordens terminale eliminationshalveringstid ca.5,8 timer.
Inamrinon er i en undersøgelse vist at være 10% til 22% bundet til humant plasmaprotein ved ultrafiltrering in vitro og i en anden undersøgelse 35% Til 49% bundet af enten ultrafiltrering eller ligevægtsdialyse.
den primære udskillelsesvej hos mennesker er via urinen som både Inamrinon og flere metabolitter (N-glycolyl, N-acetat, O-glucuronid og N-glucuronid). 63% af en oral dosis af 14C-i-mærket Inamrinon udskilles i urinen over en 96-timers periode. I de første 8 timer var 51% af radioaktiviteten i urinen Inamrinon med 5% som N-acetat, 8% som N-glycolat og mindre end 5% for hvert glucuronid. Cirka 18% af den indgivne dosis blev udskilt i fæces på 72 timer.
i en 24-timers nonradioaktiv intravenøs undersøgelse blev 10% til 40% af dosis udskilt i urinen som uomdannet Inamrinon, hvor n-acetylmetabolitten udgjorde mindre end 2% af dosis.
hos patienter med kongestiv hjerteinsufficiens kunne steady-state plasmaniveauer på ca.2,4 mcg/mL efter en bolusdosis opretholdes ved en infusion på 5 mcg/kg/Min til 10 mcg/kg/Min. Hos nogle patienter med kongestiv hjertesvigt med tilhørende kompromitteret nyre-og leverperfusion er det muligt, at plasmaniveauerne af Inamrinon kan stige i infusionsperioden; derfor kan det hos disse patienter være nødvendigt at overvåge det hæmodynamiske respons og/eller lægemiddelniveau. De vigtigste mål for patientrespons inkluderer hjerteindeks, pulmonalt kapillært kiletryk, centralt venetryk og deres forhold til plasmakoncentrationer. Derudover kan målinger af blodtryk, urinproduktion og kropsvægt vise sig nyttige, ligesom sådanne kliniske symptomer som orthopnea, dyspnø og træthed.
farmakodynamik
hos patienter med deprimeret myokardiefunktion producerer Inamrinon en hurtig stigning i hjerteproduktionen på grund af dets inotrope og vasodilatorvirkninger.
efter en enkelt intravenøs bolusdosis af Inamrinon på 0.75 mg / kg til 3 mg/kg hos patienter med kongestiv hjerteinsufficiens forekommer dosisrelaterede maksimale stigninger i hjertets minutvolumen (ca.28% ved 0,75 mg/kg til ca. 61% ved 3 mg/kg). Den maksimale effekt forekommer inden for 10 minutter ved alle doser. Effektens varighed afhænger af dosis, der varer ca.1/2 time ved 0,75 mg/kg og ca. 2 timer ved 3 mg/kg.
i samme doseringsområde viser pulmonalt kapillært kiletryk og total perifer resistens dosisrelaterede fald (gennemsnitligt maksimalt fald på 29% i pulmonalt kapillært kiletryk og 29% i systemisk vaskulær resistens). Ved doser op til 3 mg/kg er der observeret dosisrelaterede fald i diastolisk tryk (op til 13%). Det gennemsnitlige arterielle tryk falder (9,7%) i en dosis på 3 mg/kg. Hjertefrekvensen er generelt uændret.
ændringerne i hæmodynamiske parametre opretholdes under kontinuerlig intravenøs infusion og i flere timer derefter.
Inamrinon er effektivt hos fuldt digitaliserede patienter uden at forårsage tegn på hjerteglykosidtoksicitet. Dens inotrope virkninger er additive til digitalis. I tilfælde af atrieflagren/fibrillering er det muligt, at Inamrinon kan øge ventrikulær responsrate på grund af dens lille forbedring af A / V-ledning. I disse tilfælde anbefales forudgående behandling med digitalis.
forbedring i venstre ventrikulær funktion og lindring af kongestiv hjertesvigt hos patienter med iskæmisk hjertesygdom er blevet observeret. Forbedringen er sket uden at fremkalde symptomer eller elektrokardiografiske tegn på myokardisk iskæmi.
Ved konstant hjerterytme og blodtryk forekommer stigninger i hjerteproduktion uden målbare stigninger i myokardielt iltforbrug eller ændringer i arteriovenøs iltforskel.
inotrop aktivitet opretholdes efter gentagne intravenøse doser af Inamrinon. Administration af inamrinon giver hæmodynamiske og symptomatiske fordele for patienter, der ikke kontrolleres tilfredsstillende ved konventionel behandling med diuretika og hjerteglykosider.
indikationer og anvendelse til inamrinon
inamrinoninjektion er til kortvarig håndtering af kongestiv hjertesvigt. På grund af begrænset erfaring og potentiale for alvorlige bivirkninger (se bivirkninger) bør Inamrinon kun anvendes til patienter, som kan overvåges nøje, og som ikke har responderet tilstrækkeligt på digitalis, diuretika og/eller vasodilatorer. Erfaringen med intravenøs Inamrinon i kontrollerede forsøg strækker sig ikke ud over 48 timers gentagne boluser og/eller kontinuerlige infusioner.
uanset om det gives oralt, kontinuerligt intravenøst eller intermitterende intravenøst, er hverken Inamrinon eller nogen anden cyklisk-AMP-afhængig inotrope vist i kontrollerede forsøg at være sikker eller effektiv til langvarig behandling af kongestiv hjertesvigt. I kontrollerede forsøg med kronisk oral terapi med forskellige sådanne midler (inklusive Inamrinon) blev symptomerne ikke konsekvent lindret, og de cyklisk-AMP-afhængige inotroper var konsekvent forbundet med øgede risici for indlæggelse og død. Patienter med NYHA klasse IV symptomer syntes at være i særlig risiko.
kontraindikationer
Inamrinon er kontraindiceret hos patienter, der er overfølsomme over for det.
det er også kontraindiceret hos de patienter, der vides at være overfølsomme over for bisulfitter.
advarsler
indeholder natriummetabisulfit, en sulfit, der kan forårsage allergiske reaktioner, herunder anafylaktiske symptomer og livstruende eller mindre alvorlige astmatiske episoder hos visse modtagelige mennesker. Den samlede forekomst af sulfitfølsomhed i den generelle befolkning er ukendt og sandsynligvis lav. Sulfitfølsomhed ses hyppigere hos astmatikere end hos ikke-astmatiske mennesker.
forholdsregler
generelt
Inamrinon bør ikke anvendes til patienter med svær aorta-eller pulmonal valvulær sygdom i stedet for kirurgisk lindring af obstruktionen. Ligesom andre inotrope midler kan det forværre obstruktion af udstrømningskanalen ved hypertrofisk subaortisk stenose.
under intravenøs behandling med Inamrinon overvåges blodtryk og hjertefrekvens, og infusionshastigheden nedsættes eller stoppes hos patienter, der viser for store blodtryksfald.
patienter, der har modtaget kraftig diuretisk behandling, kan have utilstrækkeligt hjertepåfyldningstryk til at reagere tilstrækkeligt på Inamrinon, i hvilket tilfælde forsigtig liberalisering af væske-og elektrolytindtag kan indikeres.
supraventrikulære og ventrikulære arytmier er blevet observeret i den behandlede meget højrisikopopulation. Mens Inamrinon i sig selv ikke har vist sig at være arytmogent, kan potentialet for arytmi, der er til stede i selve kongestiv hjertesvigt, øges med ethvert lægemiddel eller kombination af lægemidler.
trombocytopeni og hepatotoksicitet er set (se bivirkninger).
anvendelse ved akut myokardieinfarkt
der er ikke udført kliniske forsøg hos patienter i den akutte fase af postmyokardieinfarkt. Derfor anbefales Inamrinon ikke i disse tilfælde.
laboratorieundersøgelser
væske og elektrolytter
ændringer i væske og elektrolyt og nyrefunktion bør overvåges nøje under Inamrinonbehandling. Forbedring af hjertets output med resulterende diurese kan nødvendiggøre en reduktion i dosis af diuretikum. Kaliumtab på grund af overdreven diurese kan prædisponere digitaliserede patienter for arytmier. Derfor bør hypokalæmi korrigeres ved kaliumtilskud før eller under Inamrinonbrug.
lægemiddelinteraktioner
i en relativt begrænset erfaring er der ikke observeret uheldige kliniske manifestationer hos patienter, hvor inamrinon blev anvendt samtidig med følgende lægemidler: digitalis glycosider; lidocain, kinidin; metoprolol, propranolol;; furosemid, furosemid, spironolacton; captopril; heparin, varfarin; kaliumtilskud; insulin.
der er rapporteret om en tilfælde af overdreven hypotension, når Inamrinon blev anvendt samtidig med disopyramid.
indtil yderligere erfaring er tilgængelig, skal samtidig administration med disopyramid udføres med forsigtighed.
kemiske interaktioner
en kemisk interaktion forekommer langsomt over en 24-timers periode, når den intravenøse opløsning af Inamrinon blandes direkte med glucoseholdige opløsninger. Derfor bør Inamrinon ikke fortyndes med opløsninger, der indeholder glucose (Glucose) før injektion.
en kemisk interaktion forekommer straks, hvilket fremgår af dannelsen af et bundfald, når furosemid injiceres i en intravenøs infusionslinje af Inamrinon. Derfor bør furosemid ikke administreres i intravenøse linjer indeholdende Inamrinon.
carcinogenese, mutagenese, nedsat fertilitet
Der var ingen antydning af et carcinogent potentiale med Inamrinon, når det blev administreret oralt i op til to år til rotter og mus ved dosisniveauer op til den maksimalt tolererede dosis på 80 mg/kg / dag.
musemikronukleustesten (ved 7, 5 til 10 gange den maksimale humane dosis) og den kinesiske hamsters ovariekromosomaberrationsanalyse var positive, hvilket indikerede både klastogent potentiale og undertrykkelse af antallet af polykromatiske erytrocytter. Imidlertid, Ames Salmonella assay, muselymfomstudie, og dyrket human lymfocytmetafaseanalyse var alle negative. De klastogene virkninger er i modsætning til negative resultater opnået i fertilitetsstudierne hos han-og hunrotter og et tre-generations studie med rotter, begge med oral dosering.
let forlængelse af drægtighedsperioden hos rotter blev set i disse studier ved dosisniveauer på 50 mg/kg/dag og 100 mg/kg/dag. Dystocia forekom hos dæmninger, der fik 100 mg/kg/dag, hvilket resulterede i øget antal dødfødsler, nedsat Kuldstørrelse og dårlig overlevelse af hvalpen.
graviditet
teratogene virkninger – graviditetskategori C
hos hvide kaniner har Inamrinon vist sig at frembringe føtale skelet-og grove ydre misdannelser ved orale doser på 16 mg/kg og 50 mg / kg, som var toksiske for kaninen. Undersøgelser på franske hy / Cr-kaniner med orale doser på op til 32 mg/kg/dag bekræftede ikke dette fund. Der blev ikke set misdannelser hos rotter, der fik inamrinon intravenøst ved den maksimale anvendte dosis, 15 mg/kg/dag (ca.Den anbefalede daglige intravenøse dosis til patienter med kongestiv hjertesvigt). Der er ingen tilstrækkelige og velkontrollerede undersøgelser hos gravide kvinder. Inamrinon bør kun anvendes under graviditet, hvis den potentielle fordel berettiger den potentielle risiko for fosteret.
ammende mødre
der skal udvises forsigtighed, når Inamrinon administreres til ammende kvinder, da det ikke vides, om det udskilles i modermælk.
pædiatrisk anvendelse
sikkerhed og effektivitet hos pædiatriske patienter er ikke fastlagt.
bivirkninger
trombocytopeni: Intravenøs injektion af Inamrinon resulterede i reduktion af trombocyttallet til under 100.000/mm3 eller normale grænser hos 2,4 procent af patienterne.
det er mere almindeligt hos patienter, der får langvarig behandling. Til dato er der i nøje overvågede kliniske forsøg ikke observeret blødningsfænomener hos patienter, hvis blodpladetælling ikke fik lov til at forblive deprimeret.
Blodpladereduktion er dosisafhængig og vises på grund af et fald i blodpladeoverlevelsestid. Flere patienter, der udviklede trombocytopeni, mens de fik Inamrinon, havde knoglemarvsundersøgelser, som var normale. Der er ingen evidens for reduktion af blodplader i forhold til immunrespons eller en blodpladeaktiverende faktor.gastrointestinale bivirkninger rapporteret med Inamrinon under klinisk brug omfattede kvalme (1, 7%), opkastning (0, 9%), mavesmerter (0, 4%) og anoreksi (0, 4%).
kardiovaskulære virkninger: kardiovaskulære bivirkninger rapporteret med Inamrinon inkluderer arytmi (3%) og hypotension (1, 3%).
levertoksicitet: Hos hunde viste Inamrinon ved IV-doser mellem 9 mg/kg/dag og 32 mg/kg/dag dosisrelateret hepatotoksicitet manifesteret enten som forhøjet levercellenekrose eller begge dele. Hepatotoksicitet er observeret hos mennesker efter langvarig oral dosering og er i en begrænset erfaring (0, 2%) observeret efter intravenøs administration af Inamrinon. Der har også været sjældne rapporter om forhøjet bilirubin og gulsot.
overfølsomhed: der har været rapporter om flere tilsyneladende overfølsomhedsreaktioner hos patienter behandlet med oral Inamrinon i cirka to uger. Tegn og symptomer var variable, men omfattede pericarditis, pleuritis og ascites (1 tilfælde), myositis med interstitiel skygge på røntgenbillede af brystet og forhøjet sedimenteringshastighed (1 tilfælde) og vaskulitis med nodulær lungetæthed, hypoksæmi og gulsot (1 tilfælde). Den første patient døde, ikke nødvendigvis af den mulige reaktion, mens de sidste to forsvandt med seponering af behandlingen. Ingen af tilfældene blev gentaget, så tilskrivning til Inamrinon ikke er sikker, men mulige overfølsomhedsreaktioner bør overvejes hos enhver patient, der opretholdes i en længere periode på Inamrinon.
generelt: yderligere bivirkninger observeret i intravenøse inamrinon kliniske studier inkluderer feber (0, 9%), brystsmerter (0, 2%) og forbrænding på injektionsstedet (0, 2%).
håndtering af bivirkninger
reduktion af trombocyttal: Asymptomatisk reduktion af trombocyttal (til <150.000/mm3) kan vendes inden for en uge efter et fald i lægemiddeldosis. Yderligere, uden ændring i lægemiddeldosering, kan antallet stabilisere sig ved lavere niveauer end præ-lægemiddel uden kliniske følger. Blodpladetællinger før lægemidlet og hyppige blodpladetællinger under behandlingen anbefales for at hjælpe med beslutninger vedrørende dosisændringer.
Hvis der forekommer et blodpladetal mindre end 150.000/mm3, kan følgende handlinger overvejes:
• Oprethold den samlede daglige dosis uændret, da tællingerne i nogle tilfælde enten er stabiliseret eller vendt tilbage til forbehandlingsniveauer. * Reducer den samlede daglige dosis. * Afbryd Inamrinon, hvis risikoen efter lægens kliniske vurdering overstiger den potentielle fordel. gastrointestinale bivirkninger: mens gastrointestinale bivirkninger blev set sjældent ved intravenøs behandling, hvis der skulle forekomme alvorlige eller svækkende bivirkninger, kan lægen ønske at reducere dosis eller afbryde lægemidlet baseret på de sædvanlige benefit-to-risk-overvejelser.
levertoksicitet: I klinisk erfaring til dato med intravenøs administration er hepatotoksicitet blevet observeret sjældent. Hvis der forekommer akutte markante ændringer i leverfunktionen sammen med kliniske symptomer, der tyder på en idiosynkratisk overfølsomhedsreaktion, bør Inamrinonbehandling straks seponeres.hvis der forekommer mindre end markante ændringer uden kliniske symptomer, skal disse uspecifikke ændringer evalueres individuelt. Klinikeren ønsker muligvis at fortsætte Inamrinon, reducere dosis eller afbryde lægemidlet baseret på de sædvanlige benefit/risk-overvejelser.
overdosering
der er rapporteret om dødsfald ved en massiv utilsigtet overdosis (840 mg over tre timer ved initial bolus og infusion) af Inamrinon, selvom årsagssammenhængen er usikker. Der skal udvises omhu under klargøring og administration af produktet.
doser af Inamrinon kan producere hypotension på grund af dets vasodilatorvirkning. Hvis dette sker, skal administration af Inamrinon reduceres eller seponeres. Der kendes ingen specifik modgift, men der bør træffes generelle foranstaltninger til cirkulationsstøtte.
hos rotter var LD50 af Inamrinon som lactatsaltet 102 mg/kg eller 130 mg/kg intravenøst i to forskellige undersøgelser og 132 mg/kg oralt (intragastrisk); som en suspension i vandig gummitragacanth var den orale LD50 239 mg/kg.
Inamrinon Dosering og Administration
Indlæsningsdoser af inamrinoninjektion skal administreres som leveret (ufortyndet). Infusioner af Inamrinon kan indgives i normal eller halv normal saltopløsning til en koncentration på 1 mg/mL til 3 mg/mL. Fortyndede opløsninger skal anvendes inden for 24 timer.
inamrinoninjektion kan indgives i løbende glucoseinfusioner via et Y-stik eller direkte i slangen, hvor det foretrækkes.
kemiske interaktioner
en kemisk interaktion forekommer langsomt over en 24-timers periode, når den intravenøse opløsning af Inamrinon blandes direkte med glucoseholdige opløsninger. Derfor bør Inamrinon ikke fortyndes med opløsninger, der indeholder glucose (Glucose) før injektion.
en kemisk interaktion forekommer straks, hvilket fremgår af dannelsen af et bundfald, når furosemid injiceres i en intravenøs infusionslinje af Inamrinon. Derfor bør furosemid ikke administreres i intravenøse linjer indeholdende Inamrinon.
følgende procedure anbefales til administration af inamrinoninjektion:
1. Start behandling med en 0,75 mg/kg ladningsdosis givet langsomt over 2 til 3 minutter.
|
LOADING DOSE DETERMINATION 0.75 mg/kg (undiluted) |
||||||||||
|
Patient Weight in kg |
||||||||||
|
mL of undiluted Inamrinone Injection |
||||||||||
2. Continue therapy with a maintenance infusion between 5 mcg/kg/min and 10 mcg/kg/min.
3. Based on clinical response, an additional loading dose of 0.75 mg/kg may be given 30 minutes after the initiation of therapy.
4. Infusionshastigheden varierer normalt fra 5 mcg/kg/min til 10 mcg/kg/min, således at den anbefalede samlede daglige dosis (inklusive belastningsdoser) ikke overstiger 10 mg / kg. Et begrænset antal patienter undersøgt ved højere doser understøtter et doseringsregime på op til 18 mg/kg/dag for forkortet behandlingsvarighed.
følgende infusionshastighedskort kan bruges til at sikre, at beregningerne er foretaget korrekt.
for at udnytte diagrammet skal koncentrationen af den anvendte inamrinoninfusionsopløsning være 2,5 mg/mL (2500 mcg / mL). Denne koncentration fremstilles ved at blande Inamrinonopløsningen med et lige stort volumen fortyndingsmiddel (normal eller halv normal saltvand).
| * fortynding: til fremstilling af den anbefalede koncentration på 2,5 mg / mL til infusionsblanding Inamrinon med et lige volumen fortyndingsmiddel. Bland for eksempel tre 20 mL hætteglas Inamrinon (3 * 20 mL = 60 mL) med 60 mL fortyndingsmiddel til et samlet volumen på 120 mL af den endelige 2,5 mg/mL opløsning af Inamrinon. | ||||||||||
|
Inamrinone IV INFUSION RATE (mL/hr) CHART Using 2.5 mg/mL Infusion Concentration* |
||||||||||
|
Patient Weight in kg |
||||||||||
|
Dosage: 5.0 mcg/kg/min |
||||||||||
|
7.5 mcg/kg/min |
||||||||||
|
10.0 mcg/kg/min |
||||||||||
Example: A 70 kg patient would require a loading dose of 10.5 mL of undiluted Inamrinone. If the physician selects a dose of 7.5 mcg/kg/min for infusionen ville strømningshastigheden være 13 mL/time ved 2, 5 mg / mL koncentrationen af Inamrinon.
5. Indgivelseshastigheden og behandlingsvarigheden bør justeres i henhold til patientens respons. Lægen kan ønske at reducere eller titrere infusionen nedad baseret på klinisk respons eller uheldige virkninger.
ovennævnte doseringsregimer kan forventes at placere de fleste patienters plasmakoncentration af Inamrinon på ca.3 mcg / mL. Stigninger i hjerteindeks viser et lineært forhold til plasmakoncentration i et interval på 0.5 mcg / mL til 7 mcg / mL. Der er ikke foretaget observationer ved højere plasmakoncentrationer.
patientforbedring kan afspejles af stigninger i hjerteudgang, reduktion i pulmonalt kapillært kiletryk og sådanne kliniske reaktioner som en mindskelse af dyspnø og en forbedring af andre symptomer på hjertesvigt, såsom orthopnea og træthed.
overvågning af centralt venetryk (CVP) kan være værdifuldt i vurderingen af hypotension og væskebalancestyring. Forudgående korrektion eller justering af væske/elektrolytter er afgørende for at opnå tilfredsstillende respons med Inamrinon.
parenterale lægemidler bør inspiceres visuelt og bør ikke anvendes, hvis der observeres partikler eller misfarvning.
sådan leveres Inamrinon
Inamrinoninjektion USP leveres i enkeltdosis hætteglas med 20 mL steril, klar gul opløsning individuelt pakket. NDC 55390-042-10.
hver 1 mL indeholder Inamrinonlactat svarende til 5 mg Inamrinon.
Beskyt mod lys. Emballagen er lys resistent til beskyttelse under opbevaring. Opbevares i karton indtil brugstidspunktet.
opbevares ved kontrolleret stuetemperatur 15 g til 30 g C (59 g til 86 g F).
Manufactured by: Manufactured for:
Ben Venue Laboratories, Inc. Bedford Laboratories™
Bedford, OH 44146 Bedford, OH 44146
August 2002 AMR-P01
VIAL LABEL

Vial Label 100 mg/20 mL
| Inamrinone Inamrinone injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Bedford Laboratories (884528407)
Registrant – Ben Venue Laboratories (004327953)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Ben Venue Laboratories Inc. | 004327953 | MANUFACTURE(55390-042) | |
More about inamrinone
- Side Effects
- During Pregnancy
- Dosage Information
- Drug Interactions
- Drug class: inotropic agents
Related treatment guides
- Heart Failure
Medical Disclaimer