nøgleord
lægemiddelterapi; Epidermal vækstfaktor; erlotinib; pankreatiske neoplasmer; panitumumab; proteinkinasehæmmere; Receptor, Epidermal vækstfaktor
forkortelser
ADL: dagliglivets aktiviteter; BSA: kropsoverfladeareal; CTC: fælles toksicitetskriterier; CTCAE: fælles terminologi kriterier for bivirkninger; CTG: kliniske forsøg gruppe; HR: fareforhold; NCI National Cancer Institute, USA. National Institute of Health; NCIC: National Cancer Institute of Canada; SPF: solbrændingsbeskyttelsesfaktor
interessekonflikt
forfatterne har ingen potentielle interessekonflikter
introduktion
med cirka 37.680 nye tilfælde og 34.290 dødsfald estimeret i 2008 repræsenterer pancreas adenocarcinom den fjerde førende årsag til kræftrelaterede dødsfald i USA . På diagnosetidspunktet er 80% af patienterne til stede med lokalt avanceret, inoperabel eller metastatisk sygdom, hvilket repræsenterer et signifikant terapeutisk dilemma . Kirurgi er den eneste helbredende behandling for kræft i bugspytkirtlen, men selv da er langvarig overlevelse mindre end 20%, hvilket antyder behovet for adjuverende behandling (kemoterapi eller/og strålebehandling). Gemcitabin, en nukleosidanalog , har vist beskeden fordel i den samlede overlevelse og symptomkontrol, mens tilsætningen af et andet cytotoksisk middel (5-FU, cisplatin, oksaliplatin) viste en signifikant fordel med hensyn til responsrater og progressionsfri overlevelse, men gav ikke en signifikant samlet overlevelsesfordel .for nylig har fase III National Cancer Institute of Canada Clinical Trials Group (NCIC-CTG) – undersøgelsen vist en statistisk signifikant overlevelsesfordel ved kombinationen af gemcitabin plus epidermal vækstfaktorreceptor (EGFR) hæmmer erlotinib sammenlignet med gemcitabin alene . Den kombinerede behandlingsarm viste en 18% reduktion i risikoen for død eller en samlet 22% forbedring i overlevelse end gemcitabin alene-armen, og den var statistisk overlegen i 1-års overlevelse (23,8% vs. 19,4%; P=0,028) og i median overlevelse (6,4 vs. 6,0 måneder) . Baseret på disse data Har US Food and Drug Administration (FDA) godkendt, at erlotinib skal administreres i kombination med gemcitabin til behandling af avanceret kræft i bugspytkirtlen.
erlotinib er en meget specifik epidermal vækstfaktorreceptor (HER1/EGFR) tyrosinkinasehæmmer . Det hæmmer ATP-bindingen til HER1 / EGFR tyrosinkinase i normale celler og tumorceller. Flere humane maligniteter er forbundet med afvigende ekspression af epidermal vækstfaktorreceptor. Sidstnævnte har været relateret til kemoresistens og dårlig prognose . Tyrosinkinase HER1 / EGFR er et potentielt mål for terapeutisk intervention i ovarie -, hoved -, nakke -, lunge -, bryst -, blære-og andre pladecellecancer .
den hyppigste bivirkning hos patienter, der får erlotinib, er hududslæt, som beskrevet nedenfor, og diarre. Andre rapporterede bivirkninger omfattede interstitiel lungesygdom, især efter behandling med gemcitabin og erlotinib, muligvis på grund af lægemiddelinteraktion .
hududslæt er den mest almindelige bivirkning ved administration af erlotinib hos patienter med metastatisk bugspytkirtelkræft, hvilket undertiden fører til seponering af denne potentielt gavnlige behandling. Desuden er behandling af denne særlige patientgruppe hovedsageligt palliativ, og bevarelse af livskvaliteten bør være den behandlende læges hovedprioritet. Hududslæt hæmmer ofte livskvaliteten betydeligt og har derfor brug for insisterende ledelse. I dette manuskript gennemgår vi de eksisterende data vedrørende patogenesen af det erlotinib-inducerede hududslæt, og vi giver retningslinjer for dets behandling
erlotinib-induceret hududslæt
forekomst
hududslæt er dokumenteret som en af de mest almindelige bivirkninger hos patienter, der får erlotinib og andre EGFR-hæmmere, der forekommer hos mindst 79% patienter behandlet med erlotinib . Der er faktisk høj forekomst af udslæt hos patienter behandlet med EGFR-hæmmere, der spænder fra 50 til 100% . Grad 3-4 udslæt (forfatterne brugte de fælles Terminologikriterier v2.0 (CTC) klassificering af National Cancer Institute (NCI), US National Institute of Health: https://ctep.cancer.gov/forms/CTCv20_4-30-992.pdf) blev dokumenteret hos 9% af de erlotinib-behandlede patienter, der krævede dosisreduktion hos 6% og seponering hos 1% af patienterne . Lignende resultater (5%) forekom i pancreascancerundersøgelsen med dosisreduktion hos 2% patienter og seponering hos 1% .
patogenese af erlotinib-induceret hududslæt
patogenese underliggende erlotinib-associeret udslæt forbliver ufuldstændigt forstået, men interferens med follikulær og interfollikulær epidermal-vækst signalvej anses for at spille en vigtig rolle. Udslæt udvikler sig så tidligt som tre dage efter påbegyndelse af erlotinib-behandling, med median debut de otte dage . Det ligner acne og er makroskopisk blevet beskrevet såvel afgrænset erythematøs papulopustulær med læsioner, der spænder fra pin-head til linsestørrelse. Skorpedannelse og kløe er også blevet bemærket , nogle gange ligner seborrheisk dermatitis eller Pityrosporum folliculitis. Selvom udslæt almindeligvis betegnes som “acneiform”, er det ikke acne og bør ikke behandles som acne. Almindeligt berørte områder omfatter ansigt, nakke og øvre brystkasse . På et mikroskopisk niveau er lymfocytisk perifolliculitis eller suppurativ overfladisk folliculitis sekundær til follikulær brud blevet visualiseret af Busam et al. .
interferens med den follikulære og interfollikulære epidermal-vækst signalvej anses for at spille en vigtig rolle. Udslæt udvikler sig så tidligt som tre dage efter påbegyndelse af erlotinib-behandling, med median debut de otte dage . Det ligner acne og er makroskopisk blevet beskrevet såvel afgrænset erythematøs papulopustulær med læsioner, der spænder fra pin-head til linsestørrelse. Skorpedannelse og kløe er også blevet bemærket , nogle gange ligner seborrheisk dermatitis eller Pityrosporum folliculitis. Selvom udslæt almindeligvis betegnes som “acneiform”, er det ikke acne og bør ikke behandles som acne. Almindeligt berørte områder omfatter ansigt, nakke og øvre brystkasse . På et mikroskopisk niveau er lymfocytisk perifolliculitis eller suppurativ overfladisk folliculitis sekundær til follikulær brud blevet visualiseret af Busam et al. .
ud over at stimulere epidermal vækst, hæmme differentiering spiller EGFR også en kritisk rolle i beskyttelsen mod UV-induceret skade, hæmme betændelse og fremskynde sårheling. EGFR er kendt for at være udtrykt i epidermale keratinocytter, sebaceous og eccrine kirtler og hårfollikelepitel, og det største udtryk forekommer i prolifererende og udifferentierede keratinocytter, som er placeret i de basale og suprabasale lag af epidermis og den ydre rodkappe af hårsækken. Druginduceret hæmning af EGFR menes at ændre keratinocytproliferation, differentiering, migration og vedhæftning, og dette kan bidrage til at forklare den papulopustulære reaktion og kserose.
erlotinib hæmmer epidermal vækst factordependent celleproliferation ved nanomolær koncentration og blokerer også cellecyklusproliferation . Disse ændringer ledsages in vitro ved frigivelse af inflammatoriske cellekemoattraktanter, der rekrutterer leukocytter, der fører til keratinocytapoptose og efterfølgende ømhed, papulopustuler og periungual inflammation. Disse ændringer kan også favorisere bakteriel overvækst, hvilket forværrer betændelse. Musemodeller antyder, at udslæt er forbigående og forsvinder ved langvarig behandling, måske som et resultat af EGFR-receptorblokade. Mitra og Simcock har vist, at erlotinib inducerede hududslæt skånet hud i tidligere udstrålede felt. Faktisk Lacouture et al. har forklaret, at strålebehandling fører til ødelæggelse af sunde hårsække og talgkirtler. Derfor påvirker EGFR-hæmmere ikke tidligere bestrålede områder. I modsætning hertil kan akut stråling føre til betændelse i målområdet på grund af prolifererende stamcelleafledte hudceller, der er radiosensitive. Langt om længe, Harari et al. har foreslået, at erlotinib kan fungere som en radiosensibilisator: papulopustulært udbrud forekom på et nyligt bestrålet sted efter påbegyndelse af erlotinib-behandling. Mængden af stråling, der er nødvendig for at fremkalde udslæt, er ikke klar. Afslutningsvis ser det ud til, at tidsrammen mellem bestråling og administration af erlotinib er afgørende for udviklingen af udslæt i bestrålede områder.
manifestation af udslæt
i pivotale studier blev sværhedsgraden af udslæt klassificeret i henhold til NCI-CTC version 2.0 – kriterierne (https://ctep.cancer.gov/forms/CTCv20_4 – 30-992.pdf) før 2006 og derefter i henhold til NCI Common Terminology Criteria for Adverse Events (CTCAE) version 3.0 criteria (https://ctep.cancer.gov/forms/ CTCAEv3.pdf) (Figur 1, Tabel 1). Dette kriterium er imidlertid primært designet som et overvågningsværktøj, og dets anvendelse til at vælge interventioner og forudsige deres effektivitet er ikke klart. Derudover er EGFR-hæmmerassocierede udslæt generelt

Figur 1. Erlotinib inducerede grad 2 hududslæt hos apancreatisk cancerpatient. Hududslæt blev graderetifølge National Cancer Institute: CommonTerminology Criteria for Adverse Events (ncictcae)version 3.0 .

begrænset til ansigt og øvre bagagerum og kan være af høj sværhedsgrad på sådanne anatomiske steder. Desuden forekommer misfarvning, pitting og ridging forbundet med Grad 1 negleændringer ikke som reaktion på EGFR-hæmmerbehandling. For at overvinde disse begrænsninger er der foreslået et enklere, mere EGFR-hæmmerfokuseret klassificeringssystem (tabel 2).

klinisk betydning
det er blevet foreslået, at udslæt kunne bruges som et objektivt respons på Terapi og muligvis være forbundet med langvarig overlevelse. Undersøgelser med flere forskellige EGFR-midler viser sammenhæng mellem udslæt og klinisk effektivitet. Kutan udslæt synes at være en surrogatmarkør af klinisk fordel .
i NCIC-CTG-studiet udviklede størstedelen af patienterne (81%) grad 2-udslæt. Patienter, der fik erlotinib og udviklede udslæt, viste medianoverlevelse 7,1 måneder (grad 1) eller 11,1 måneder (grad 2) i modsætning til 3.3 måneder hos patienter, der ikke udviklede udslæt, mens de tog erlotinib. Udslætsudviklingen var forbundet med samlet og progressionsfri overlevelse, og disse korrelationer steg med grad (grad 1 vs. intet udslæt: fareforhold (HR) 0,47, P<0,001; grad 2 eller mere vs. intet udslæt: HR 0,29; P<0,001) . Imidlertid var udslæt også til stede hos 18% af placebo, der tog patienter med median overlevelse 8,2 måneder. Placebotaking patienter, der ikke udviklede udslæt, havde median overlevelse 4,7 måneder. I den kombinerede behandlingsarm (gemcitabin plus erlotinib) udviklede 81% af patienterne udslæt sammenlignet med 30% af patienterne i kontrolgruppen.
resultaterne er vanskelige at analysere, da gemcitabin i sig selv vides at fremkalde hududslæt. Udslæt syntes at korrelere med komplet respons, delvis respons og stabil sygdom (grad 2 eller mere udslæt vs. intet udslæt HR 0,47, P<0,001) . Patienter, der fik erlotinib og gemcitabin, viste en eskalerende medial overlevelse på 10,8 måneder (grad 2 hududslæt), 5,7 måneder (grad 1) og 5,4 måneder (intet udslæt). Peres-Soler et al. har rapporteret, at udslæt blev oplevet af alle patienter med et objektivt respons på erlotinib såvel som hos 95% af 22 patienter med stabil sygdom i modsætning til 54% af 28 patienter med progressiv sygdom . Endelig er hududslæt også blevet beskrevet under behandling med andre EGFR-hæmmere som f.eks.
det er blevet foreslået, at udslæt klinisk forbedres med fortsættelse af behandlingen. Ikke desto mindre kan udvikling af alvorlig udslæt være en afgørende årsag til seponering af behandlingen hos patienter i behandling med erlotinib uden for kliniske forsøg. Hvis udslætsudvikling faktisk er en surrogatmarkør for behandlingssucces, stopper patienter, der afbryder behandlingen, potentielt en livsforlængende behandling. Derfor er det afgørende at udnytte alle tilgængelige midler til behandling af erlotinib-induceret hududslæt for at afskrække patienter fra at stoppe det.
dosisoptrapning
et vigtigt spørgsmål er, om forøgelse af dosis af erlotinib kan fremkalde udslæt eller øge sværhedsgraden af udslæt hos de patienter, der ikke udvikler udslæt ved den indledende ordinerede dosis. Dosis af erlotinib som et enkelt middel og i kombinationsstudier med ikke-småcellet lungekræft er 150 mg pr. I det pivotale NCIC-studie var der 23 patienter behandlet med en startdosis på 150 mg erlotinib, hvoraf 11 krævede protokolordinerede dosisreduktioner for toksicitet, hvilket tyder på, at dette kan være for høj en startdosis . Farmakokinetikken af erlotinib har vist signifikant variation i tidligere studier med clearance og areal under kurven varierende op til syv gange. Det er muligt, at det kan være nyttigt at øge dosis af erlotinib ud over 100 mg hos patienter, der ikke oplever toksicitet.
EGFR polymorfisme
et spørgsmål opstår, hvorfor nogle patienter udvikler udslæt, og andre følger ikke erlotinib. De mulige forklaringer kan omfatte, men ikke begrænset til individuelle forskelle i lægemiddeleksponering, immunsystemets integritet eller EGFR-polymorfier. Som beskrevet tidligere , at udslæt normalt udvikler sig inden for 2 uger efter behandlingsstart, kan udslæt anvendes som en biomarkør i fremtidige undersøgelser, da patienter efter indløbsperioden kunne stratificeres af, om udslæt forekom og randomiseret til forskellige terapier eller doser af erlotinib.
behandling
da data tyder på, at udvikling af udslæt hos patienter, der udvikler udslæt efter erlotinib, tyder på effekt, er det vigtigt at udvikle effektive strategier til håndtering af udslæt, mens behandlingen med erlotinib fortsættes. Optimal håndtering af udslæt hos patienter, der får erlotinib, er fortsat noget kontroversielt, men der bør iværksættes en proaktiv tilgang for at give patienter mulighed for at fortsætte behandlingen uden dosisafbrydelse eller seponering af lægemidlet. Det er også vigtigt at rådgive patienter om de positive aspekter ved at udvikle udslæt på erlotinib som en del af den kliniske behandling af denne bivirkning.
generelle retningslinjer
hudpleje. Alle patienter bør opfordres kraftigt til at bruge et tykt alkoholfrit blødgøringsmiddel for at forhindre og lindre hudens tørhed .
beskyttelse mod sollys. Patienter kan minimere omfanget eller intensiteten af udbruddet ved at undgå solbadning eller direkte, stærkt sollys, høj varme eller fugtighed under behandlingen . Brug solcreme af solbrændingsbeskyttelsesfaktor (SPF) 15 eller højere.
Make-up relaterede emner. Udslæt kan dækkes med makeup. En dermatologistapproved cover-up kan bruges, selvom enhver form for fundament kan være nyttig. Makeupen skal fjernes med en hypoallergen (hudvenlig) flydende rengøringsmiddel .
lokal terapi. Det meste af lokal terapi involverede brug af topiske antibiotika (clindamycin gel eller lotion) og topiske steroider. Anekdotiske rapporter om fordel ved topiske antiinflammatoriske (acne) præparater er blevet reposteret. Aktuelle antibiotika bruges normalt, når pustler er til stede eller ved at udvikle sig. Anvendelse eller fordele ved topiske steroider er kontroversiel. Producenterne af Cetukab (Bristol-Myers, Co., NY, NY, USA; Imclone Systems, Inc., Ny York, NY, USA) fraråde brugen af topiske steroider på grund af potentialet til at forårsage infektiøse komplikationer. Men andre institutioner har brugt stoffer med høj styrke som clobetasolpropionat i grad 1 eller 2 udslæt for at bekæmpe betændelse og forhindre infektion . Også hydrocortison valerat topisk steroid creme eller salve er blevet brugt i tidlig udslæt med godt resultat. Patologi af udslæt forårsaget af EGFR-hæmmere adskiller sig fra acne vulgaris derfor medicin til acne vulgaris som bensoyloverilte bør ikke anvendes. I en institution blev acnevask brugt og hjalp med at kontrollere udslæt, men førte til tør hud og en brændende fornemmelse og var ikke så effektiv som steroidcremer og topiske antibiotika . Der findes ingen sådanne data for erlotinib.
systemisk terapi. Systemisk terapi sådanne steroider (for at mindske ubehag) og orale antibiotika er blevet anvendt i grad 3 eller 4 udslæt for at genopleve symptomerne eller behandle komplikationen af udslæt. Hvis der er mistanke om infektion fra udslæt, er der mistanke om orale antibiotika såsom tetracycliner (minocyclin) kan bruges til at behandle infektionen. Tetracyclin har svage antiinflammatoriske virkninger og rimelig god aktivitet mod Staphylococcus aureus.
behandling af udslæt med hensyn til Stadium
Hvis patienter udvikler udslæt relateret til erlotinib, foreslås følgende interventioner baseret på reaktionens sværhedsgrad (tabel 3, figur 2) .

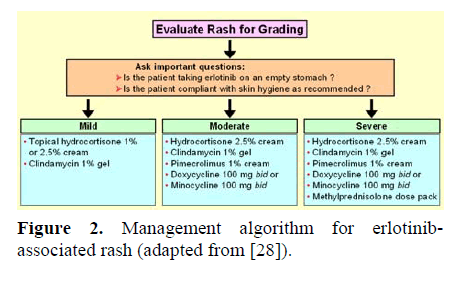 pancreas-management-algoritme
pancreas-management-algoritme figur 2. Ledelsesalgoritme til erlotinibassociatedrash (tilpasset fra ).
milde toksiciteter
erlotinib-dosis bør ikke ændres for milde toksiciteter. Anvendelse af topisk hydrocortison (1% eller 2,5% creme) eller clindamycin (1% gel) kan overvejes.
moderat toksicitet
erlotinib-dosis bør ændres baseret på klinisk vurdering. Behandlingsmuligheder kan omfatte:
• hydrocortison (2,5% creme);
• clindamycin (1% gel);
• pimecrolimus (1% creme);
• doksycyclin (100 mg, po to gange dagligt);
• minocyclin (100 mg, po to gange dagligt).
alvorlige toksiciteter
erlotinib-dosis bør reduceres. Samtidig intervention er den samme som ved moderat toksicitet, men tilsætning af methylprednisolondosispakning kan overvejes. Hvis udslæt ikke forsvinder inden for 2-4 uger, på trods af behandling, anbefales det at afbryde behandlingen med erlotinib.
fremtidsperspektiver
aktuelle data antyder, at mindst en grad 2 udslæt er nødvendig for overlevelsesfordel for patienter med kræft i bugspytkirtlen. Stadig mange problemer forbliver uløste, såsom virkningen af gemcitabin på udslæt udvikling, korrelationen af EGFR status eller tilstedeværelsen af EGFR mutationer med tilstedeværelsen af udslæt. Det er af særlig interesse at undersøge, om en forøgelse af dosis af erlotinib indtil udviklingen af udslæt vil medføre øget klinisk fordel. Specificitet af inhibering med hensyn til andre tyrosinkinasereceptorer er endnu ikke fuldt karakteriseret. Det er endnu ikke fuldt ud forstået, hvorfor patienter, der fik placebo, udviklede udslæt og udviste langvarig overlevelse. Yderligere undersøgelser bør vurdere den type patienter, der sandsynligvis udvikler udslæt. Genotypen hos patienter, der udvikler udslæt og reagerer på behandling, kan spille en væsentlig rolle i behandlingsfremskridt.
konklusion
afslutningsvis skal erlotinib-induceret kutan udslæt håndteres så intensivt som muligt for at fortsætte en potentielt gavnlig behandling. Der er behov for yderligere undersøgelser for at identificere, hvilke patienter der har en øget sandsynlighed for at udvikle udslæt, og om en forøgelse af erlotinib-dosis og derfor potentialet for udslæt udvikling ville give en klinisk fordel.Jemal A, Siegel R, afdeling E, Hao Y, Murray T, Thun MJ. Kræftstatistik, 2008. CA kræft J Clin 2008; 58: 71-96.