
Sau (Larry) Lee, Ph. D., vicedirektør for Office of Testing and Research og formand for det nye Teknologiteam, Office of Pharmaceutical Kvalitet, CDER
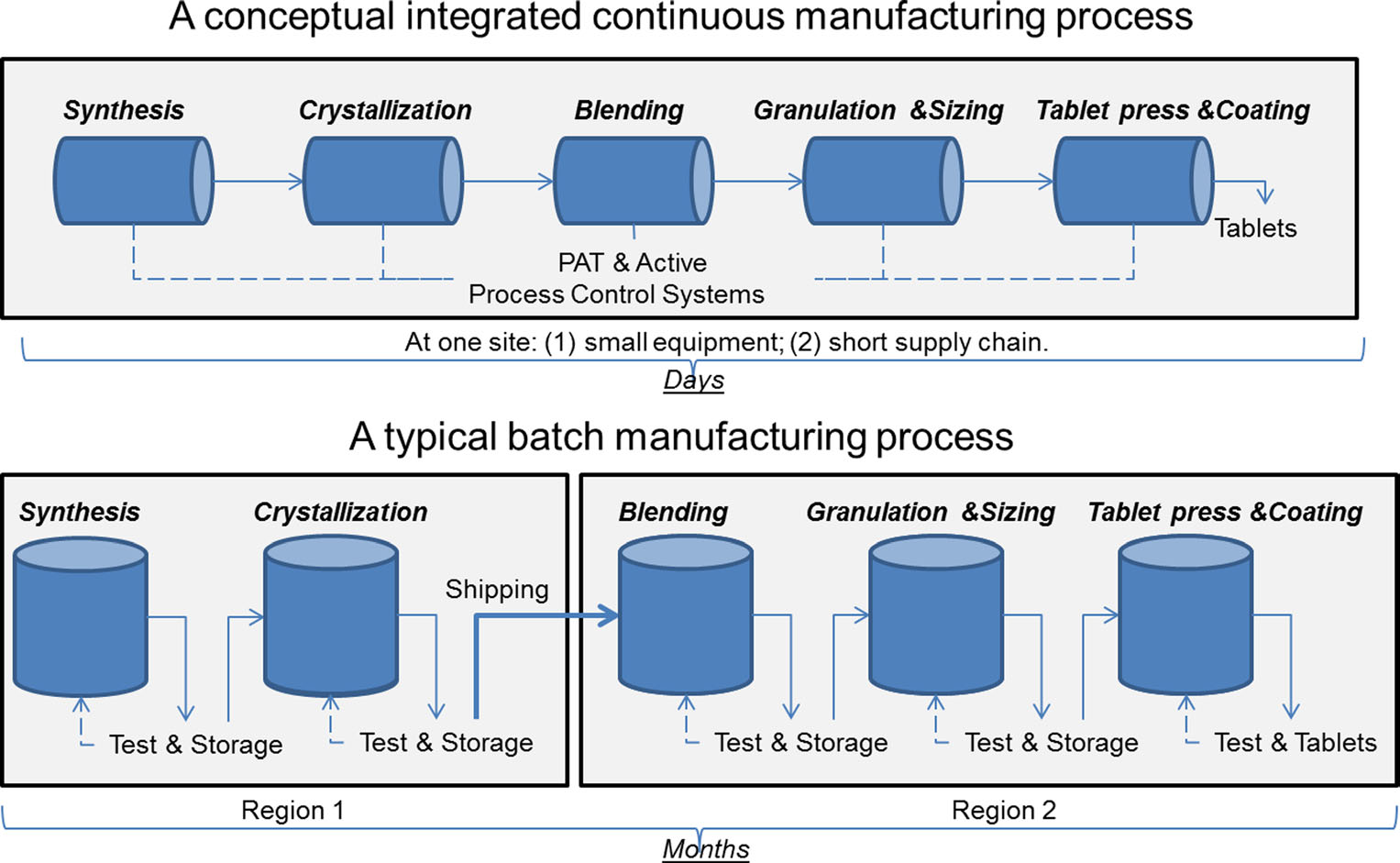 en sammenligning af kontinuerlig fremstilling og batchfremstilling. Billede med tilladelse fra Sau Lee. J. Pharm Innov (2015) 10: 191-199.
en sammenligning af kontinuerlig fremstilling og batchfremstilling. Billede med tilladelse fra Sau Lee. J. Pharm Innov (2015) 10: 191-199.i mere end 50 år er lægemidler produceret ved hjælp af en metode kendt som “batchfremstilling”, en flertrins, langvarig proces, der involverer brugen af ugudeligt, stort udstyr. De seneste fremskridt inden for fremstillingsteknologi har imidlertid fået medicinalindustrien til at overveje at flytte væk fra batchfremstilling til en hurtigere og mere effektiv proces kendt som kontinuerlig fremstilling. FDA tager proaktive skridt for at lette lægemiddelindustriens implementering af nye teknologier, herunder kontinuerlig fremstilling, for at forbedre produktkvaliteten og adressere mange af de underliggende årsager til narkotikamangel og tilbagekaldelser.
Batch vs. kontinuerlig fremstilling
Batchfremstilling involverer flere diskrete trin. Efter hvert trin i processen stopper produktionen typisk, så prøver kan testes offline for kvalitet. Nogle gange i løbet af disse “holdetider” mellem trin kan materialet opbevares i containere eller sendes til andre faciliteter rundt om i verden for at fuldføre fremstillingsprocessen. Dette kan tilføje uger eller måneder til behandlingstiden. For nogle aktive ingredienser, der er følsomme for miljøet, kan det også medføre risiko for nedbrydning. Hertil kommer, at hvis efterspørgslen efter et bestemt lægemiddel stiger, kan øget produktion kræve større udstyr. Denne opskalering af udstyr kræver mere fysisk plads, et større fodaftryk og mere tid og penge.i modsætning hertil flyttes lægemidler, der fremstilles ved kontinuerlig fremstilling, nonstop inden for samme facilitet, hvilket eliminerer holdetider mellem trin. Materialet føres gennem en samlebånd af fuldt integrerede komponenter. Denne metode sparer tid, reducerer sandsynligheden for menneskelige fejl og kan reagere mere smidigt på markedsændringer. For at tage højde for højere efterspørgsel kan kontinuerlig produktion køre i længere tid, hvilket kan reducere sandsynligheden for narkotikamangel.
begge typer produktion er underlagt de samme kvalitetskontrolstandarder, men overvågningen automatiseres i kontinuerlige produktionsfaciliteter og har tendens til at være hyppigere end i batchfremstilling. Som al teknologi kan kontinuerligt produktionsudstyr opleve slid, men automatiseret overvågning kan registrere problemer længe før en fejl opstår. En sådan overvågning kan også hjælpe med at forudsige levetiden for et udstyr, hvilket fører til bedre proaktiv vedligeholdelse.
endelig kan kontinuerlig fremstilling muliggøre mere fleksibel sporing og sporing, hvilket ville være en fordel i tilfælde af produktfejl. For eksempel i batchfremstilling defineres en bestemt mængde (eller batch) af et lægemiddel af størrelsen på det udstyr, der producerede det. Ved kontinuerlig fremstilling kan en mængde (eller batch) afgrænses af et tidsstempel, mængden af produceret lægemiddel eller mængden af rå input materiale. Disse sporingsmetoder gør det muligt for fabrikanten at isolere en mindre mængde defekt materiale i tilfælde af en procesfejl, hvilket fører til mindre affald og mindre chance for mangel.
en udfordrende, men værdifuld overgang
flere industrier—såsom den kemiske og petrokemiske industri—har allerede gennemgået en fremstillingsudvikling og bruger effektive kontinuerlige teknologier til sikkert at fremstille produkter. Men for medicinalindustrien er overgangen til kontinuerlig fremstilling stadig i sine tidlige stadier af flere grunde. For det første kan opstartsomkostninger for en sådan overgang være høje. Pensionering af gammelt batchudstyr, køb af ny teknologi og uddannelse af personale i, hvordan man bruger det, og modernisering af industriinfrastruktur er dyrt, kræver et seriøst engagement fra en lægemiddelproducent. Alligevel har økonomiske analyser vist potentielle betydelige langsigtede besparelser. Derudover skal nogle teknologier stadig modnes, før de er kommercielt levedygtige. For visse typer lægemidler, såsom biologiske produkter, findes teknologien til fremstilling af dem ved kontinuerlig fremstilling muligvis endnu ikke. Forskning er i gang for at løse disse og andre udfordringer. Desuden opfatter lægemiddelproducenter stadig lovgivningsmæssig usikkerhed, der kan forsinke produktgodkendelse, når der anvendes en ny produktionsteknologi.da industrien overvejer, hvordan man skifter, leverer FDA ressourcer og information til at lette overgangen. For eksempel samarbejder agenturet med Biomedical Advanced Research and Development Authority, et program inden for US Department of Health and Human Services, for at hjælpe med at finansiere og støtte forskning på dette område. Vi uddanner også vores gennemgangspersonale og udfører intern forskning på risikoområder forbundet med kontinuerlig produktion, så vi bedre kan vurdere relaterede teknologier.
Jeg leder et tværfagligt team under Emerging Technology-programmet i CDER ‘ s kontor for farmaceutisk kvalitet. Programmet blev oprettet for at hjælpe industrien med at implementere innovative teknologier til at forbedre produktkvaliteten og modernisere branchen i et forsøg på at tackle de underliggende årsager til narkotikamangel eller tilbagekaldelser. Emerging Technology-programmet adresserer ikke kun kontinuerlige produktionsteknologier, men også andre fremskridt som 3D-udskrivning, nye doseringsformer og nye containersystemer. Under dette program, vi engagerer os i industrien tidligt i processen med at udvikle ny teknologi, og diskutere forventede lovgivningsmæssige eller videnskabelige spørgsmål, der kan være en del af en fremtidig applikation.
mange virksomheder har ansøgt om det nye teknologiprogram vedrørende deres interesse for kontinuerlig produktion. FDA-dokumentet med titlen, fremme af nye Teknologiapplikationer til modernisering af den farmaceutiske Fremstillingsbasisvejledning til industrien giver information og rådgivning om, hvordan man arbejder med agenturet tidligt i udviklingsprocessen.
Læs mere om FDA ‘s bestræbelser på at modernisere lægemiddelfremstilling i FDA’ s Voice Blog.