det første biologiske lægemiddel, humaniseret insulin (5,8 kDa), blev tilgængeligt i 1982 efter fremkomsten af bioteknologi, og det markerede en ny æra inden for farmaceutisk industri. Moderne fremskridt inden for bioteknologi tillader store synteser af biologics på en mere eller mindre omkostningseffektiv måde. Efter at have en gang startet med store peptider og rekombinante proteiner, inkluderer biologiske stoffer i dag en lang række andre enheder, såsom antistoffer, monoklonale antistofferog for nylig nanobodier og beslægtede objekter, opløselige receptorer, rekombinant DNA, antistof-lægemiddelkonjugater (ADC ‘ er), fusionsproteiner, immunoterapeutika og syntetiske vacciner.
den ‘stigende stjerne’ af biologiske lægemidler har fanget stigende opmærksomhed hos farmaceutiske fagfolk og brancheanalytikere, da dette alternative lægemiddelopdagelsesparadigme repræsenterer en betydelig forretningsudfordring for mere traditionelt lille molekyle lægemiddelopdagelsesparadigme, der definerer farmaceutisk industri i mere end et århundrede.
så spørgsmålet opstår: mister små molekyler “tiltrækningskraft” som forskningsobjekter til lægemiddelopdagelse i den moderne verden af biologiske fremskridt? Nogle eksperter forbliver optimistiske med hensyn til små molekylers potentiale til at lede løbet i fremtidige farmaceutiske rørledninger, andre opfatter, at “penge skifter lommer”, og forskning i små molekyler vil i stigende grad blive forsømt af aktionærer og investorer til fordel for biologiske stoffer.
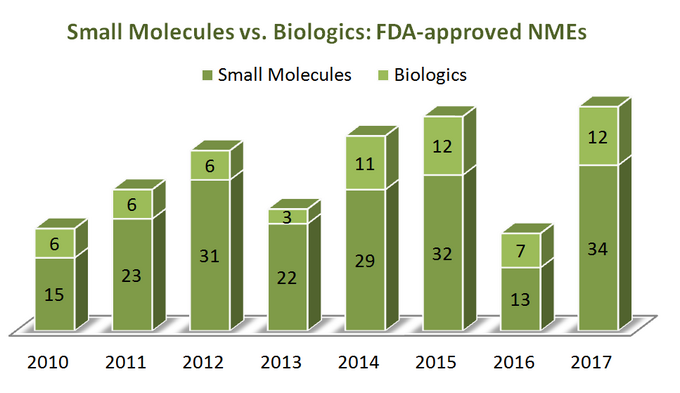
for at finde ud af, hvor branchen er på vej, lad os først starte med en smule statistik. Over en periode på 7 År (2010-2017) USA. Food and Drug Administration (FDA) godkendte i alt 262 nye molekylære enheder (NME ‘ er), eksklusive flere diagnostiske billeddannelsesmidler og 1 insulinanalog (ref). Det ser ud til, at 76% af dem er små molekyler (199), hvor kun en fjerdedel er biologiske. Interessant, der er ingen tilsyneladende vækst i biologiske NMES-godkendelser i forhold til små molekyler, da begge kategorier af terapeutiske stoffer trender på en ret lignende måde, som vist på nedenstående diagram. Men da biologics er prissat meget forskelligt fra små molekyler (de er langt dyrere), er billedet anderledes, når man ser på det samlede salg og omsætningsvækst: i perioden fra 2011 til 2017 er biologiske salgsindtægter vokset med 70% efter at have nået 232 milliarder dollars. Andelen af det samlede lægemiddelmarked, som biologics har, steg fra 16% i 2006 op til 25% i 2016 uden tilsyneladende tegn på afmatning (ref).
mens der er karakteristiske fordele ved biologiske stoffer i forhold til små molekyler på flere måder (for eksempel deres dybe selektivitet), er tingene ikke “sort-hvide”, når man sammenligner disse to kategorier af terapeutiske midler efter deres egenskaber, da de begge har betydelige fordele og ulemper at overveje under strategisk beslutningstagning. Så det virker lidt beklageligt at se, hvor mange rapporter sidelinjede SMs i forhold til biologics i en forfølgelse af “friskhed” af deres synspunkter.
en tabel nedenfor opsummerer nogle stærke og svage aspekter af begge kategorier (ref, ref), der illustrerer udfordringer og muligheder, der er tilgængelige i begge “lejre” (Bemærk farver: grå-ingen åbenbar fordel i hverken lejr; grøn-fordelagtig situation; gul-ufordelagtig situation):
små molekyler |
Biologics |
|---|---|
|
generelle egenskaber |
|
|
lavmolekylære vægte (0,1 – 1 kDa); normalt kemisk og termisk stabil, bred vifte af polaritet. |
meget store molekylvægte > 1 kDa; generelt polær, følsom over for varme, let nedbrudt (med undtagelse af nogle langlivede typer, såsom monoklonale antistoffer) |
|
selektivitet, sikkerhed |
|
|
snarere promiskuøs, binder normalt til forskellige steder uden for målet, hvilket giver bivirkninger eller toksicitet. endelig har biologiske udviklere haft en lettere tid at opnå patenter, fordi der er var lidt eller ingen state-of-art på området, når de nuværende blockbusters blev opdaget. |
meget specifik for målene, generelt med lavere toksicitet (med en væsentlig undtagelse er immunogeniciteten, som alvorligt kan påvirke effektiviteten, sikkerheden og dispositionen af biologiske lægemidler). |
|
cellepermeabilitet |
|
|
SMs binder med mål som G-proteinkoblede receptorer (GPCR ‘ er), ligand-gated ionkanaler og receptor tyrosinkinaser på de ekstracellulære eller intracellulære domæner. De kan få adgang til mål i de intracellulære regioner, cytosoler, kerner og endda CNS-mål, adskilt af den stramme blod-hjerne-barriere (BBB). |
en stor del af farmakologiske mål er indlejret og derfor utilgængelige for biologiske stoffer. Især når det kommer til centralnervesystemet (CNS), er tilstedeværelsen af blod-hjerne-barrieren en stor hindring på vejen for molekyler større end 600 Da, der begrænser op til 98% af SMs og praktisk talt alle biologiske stoffer. |
|
levering |
|
|
falder stort set i “regel om fem” til oral absorption, hvilket gør den velegnet til oral levering. Yderligere permeabilitet via tarmepitel medieres primært af en kombination af passiv diffusion og paracellulær transport. |
iboende ustabilitet og højmolekylære masser gør næsten alle biologiske stoffer oralt inaktive. For det meste invasiv levering eller alternative ikke-invasive teknologier i gang. |
|
Distribution |
|
|
SMs distribueres via blodcirkulationen, hvilket giver mulighed for hurtigt at opnå pick-koncentrationer. |
for større molekyler (f.eks. > 10 kDa) et langsommere (med 100-500 gange) lymfesystem bliver dominerende i distributionsprocessen. Større biologiske stoffer distribueres via både blodet og lymfesystemerne, der bevæger konvektiv transport, receptormedieret endocytose, fagocytoseog pinocytose. Det resultatet af denne situation er, at større biologiske stoffer har længere halveringstider, begrænsede distributionsvolumener og har brug for mere tid til at nå maksimale koncentrationer sammenlignet med SMs. |
|
Disposition (metabolisme) |
|
|
de fleste SMs bortskaffes af ikke-målrettede organer-via cytokrom eller ikke-cytokrommetabolismer, nyrefiltrering, eller fækal udskillelse. |
Biologics har strammere interaktioner med mål, så deres dispositioner påvirkes direkte af deres binding (receptormedieret lægemiddeldisponering), herunder godkendelser af biologiske stoffer ved proteaser og peptidase. |
|
lægemiddelinteraktioner |
|
|
SMs er tilbøjelige til lægemiddelinteraktioner, der kan forekomme på grund af tilstedeværelsen af samtidige lægemidler, der påvirker deres transport, stofskifte, transport og eller eliminationsveje. |
Biologics er mindre tilbøjelige til traditionelle lægemiddelinteraktioner, da de gennemgår metabolisme og eliminering som de endogene substrater. Der er dog dokumenterede cytokinmedierede ændringer i lægemiddelmetaboliserende stoffer, derfor skal lægemiddelbiologiske interaktioner vurderes i tilfælde af, at lægemidlet kan påvirke ekspressionen af metaboliske stoffer. |
|
forretningsaspekter |
|
|
lave priser for SM-stoffer. |
typisk meget høje priser for biologiske behandlinger. Dette betragtes som en af grundene til, at biologics ser ud til at levere bedre samlet økonomisk afkast sammenlignet med SMs. |
|
høj slidhastighed (2009-undersøgelse af KMR Group viste, at kun 7,1% af SMs, der kom ind i præklinisk test, til sidst nåede markedet). |
relativt lav nedslidningshastighed (samme KMR-Gruppestudie afslørede 24,4% af prækliniske biologer overlevede op til markedsstadiet). |
|
Severe competition from chemical generics after patents expiration. |
Biologics developers face less severe competition from biosimilars, after patents expiration. |
|
Simpler drug discovery/development process. |
More expensive and complex drug discovery and development process, compared to biologics. |
i betragtning af ovenstående sammenligning bliver det tydeligt, at biologiske stoffer ikke er en “magisk kugle”, og industrien vil ikke blive domineret af biologiske stoffer i overskuelig fremtid, snarere vil der opretholdes en konkurrencedygtig ligevægt mellem små molekyler, biologiske og hybride former for terapeutiske midler, såsom ADCs-med lokal dominans af hver form i mere egnede terapeutiske områder, brugssager osv.
desuden er nedenfor en liste over flere branchedrivere, der spiller på siden af små molekyler og kan påvirke magtbalancen på det samlede farmaceutiske marked til fordel for kemiske udgangspunkt:
stigningen af kunstig intelligens (AI) i lægemiddelopdagelse
efter gennembrud i dybe læringsalgoritmer (2012) og for nylig oprettelse af generative kontradiktoriske netværk (GANs), der er i stand til at udmærke sig i en række forskningsopgaver, er interessen for forskellige AI-teknologier skyrocket i temmelig stort set alle brancher. Mange AI-drevne værktøjer er hurtigt blevet kommercielle mainstream, som chatbots, Personlige assistenter, autopiloter osv.– hvilket er et virkeligt bevis på begrebet AI gennemførlighed. Lægemiddelopdagelse er ikke en undtagelse fra denne” AI-drevne tendens”, og antallet af startups, der forsøger at anvende AI for at øge lægemiddelopdagelsen på forskellige måder, er vokset betydeligt over blot flere år efter at have nået over hundrede aktive virksomheder til dato (her er en liste over nogle af dem).
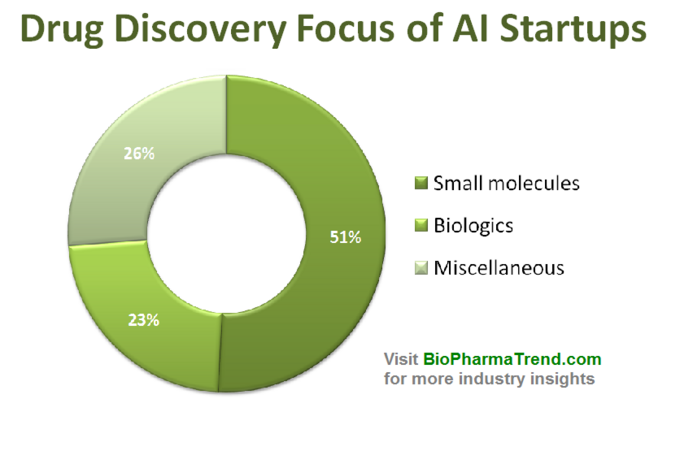
interessant nok er størstedelen af AI-drevne startups fokuseret på små molekyler lægemiddelopdagelse snarere end biologiske stoffer, hvilket sandsynligvis ikke er overraskende. Historisk set blev selv ikke-AI beregningsmetoder (keminformatik) primært brugt til små molekyleterapeutik på grund af deres væsentligt enklere molekylære strukturer og interaktionsmønstre.nedenstående diagram viser en estimeret statistik for 61 aktivt markedsførte lægemiddelopdagelsesstarter, der udvikler eller anvender specialiserede AI-værktøjer i deres forskningsarbejdsgang. Som du kan se, er halvdelen af alle virksomheder (51%, 31 startups) fokuseret på små molekyler, mens kun 23% (14 startups) er involveret i at opdage/udvikle biologiske lægemidler (antistoffer, vacciner osv.). Disproportionen mod små molekyler illustreres også godt af mængden af VC-finansiering, der indsamles kollektivt af 61 gennemgåede AI-drevne startups (kun offentligt offentliggjorte runder) – hvor 770 millioner blev investeret i de virksomheder, der var involveret i små molekyler, og kun lidt mere end 200 millioner blev afsat til biologiske fokuserede startups-som vist nedenfor.
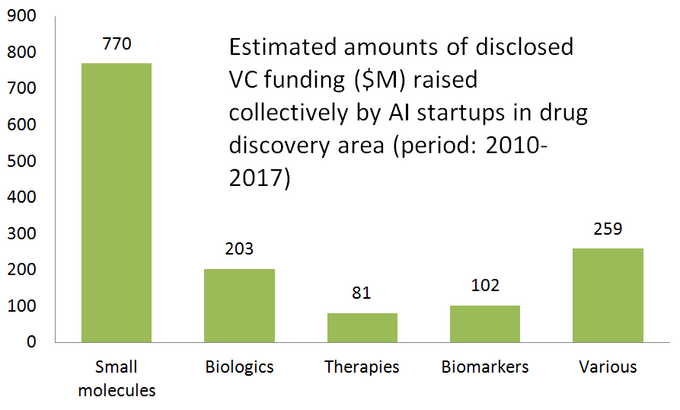
denne situation antyder, at nylige fremskridt inden for AI-algoritmer og en tendens til at anvende maskinindlæring til farmaceutisk forskning i det tidlige stadium har tendens til at drive mere vækst i opdagelse af små molekyler sammenlignet med biologiske opdagelser-i det mindste for nu. Dette kan føre til flere fremtidige investeringer i små molekylefokuserede projekter støttet af AI-drevne teknologier.
at nå “udrugbare” mål
sådanne vigtige mål som for eksempel protein-proteininteraktioner (PPI ‘er) domineres traditionelt af biologics (MAB’ er) som potentielle aktører, mens små molekyler længe var blevet betragtet som uegnede i dette tilfælde på grund af deres lille størrelse.
med fremskridtene inden for farmakogenomik kan denne situation ændre sig ret hurtigt efter godkendelserne maraviroc (514 da) og tirofiban (441 da). Det blev afsløret beregningsmæssigt, at SMs faktisk kan have relativt høje tilhørsforhold til specifikke grænseflader af proteiner, og vigtigst af alt kan de modulere de ‘iboende forstyrrede proteinregioner’, der er knyttet til et sæt komplekse systemsygdomme. Her er en interessant dækning af dette emne, der opsummerer nogle af de vigtige indsigter i PPI-maskiner, der er opnået i de seneste årtier.
et andet hurtigt voksende område til opdagelse af små molekyler er rettet mod ribonukleinsyre (RNA). Dette emne blev opført i “Top 7 Trends in Pharmaceutical Research In 2018”, og der var også en detaljeret gennemgang af emnet i Cellekemisk biologi og en dejlig industri dække op i C&EN.
en anden ny ide om at frigøre kraften i små molekyler blev diskuteret i en nylig artikel ‘målrettede proteinnedbrydere omdefinerer, hvordan små molekyler ser ud og handler’ offentliggjort i C&en i 2018. Strategien her er at udvikle bifunktionelle små molekyler, der er i stand til at dirigere et målrettet protein helt til proteasom, cellens affaldsfjernelsesmaskine, i stedet for blot at hæmme proteinets handling som i en ‘traditionel’ tilgang.
overvinde begrænsninger af screeningsteknologier
meget forskningspotentiale for små molekyler er endnu ikke realiseret på grund af forskellige teknologiske begrænsninger af screeningsmetoder, der anvendes til at identificere udgangspunkt i lægemiddelopdagelsesprogrammer.
et sådant eksempel er fænotypisk screeningsmetode, som oplever renæssance i dag på grund af flere teknologiske fremskridt, herunder den stigende evne til at udvikle fysiologisk relevante cellemodeller, aflæsninger og sofistikerede detektionsteknologier, der hjælper med at afsløre virkningsmekanismer (MoA) mere effektivt og minimere usikkerhed. På den anden side tilbyder implementeringen af store profileringsteknikker og beregningsmetoder et nyt niveau af systemanalyse og forståelse af fænotyper med små molekyler.
et andet lovende screeningsparadigme er via brug af DNA-kodede biblioteker (DELs). På grund af dets unikke arrangement giver Del technology en passende måde at teste hundreder af millioner og endda milliarder af nye molekyler i målbaserede lægemiddelopdagelsesprogrammer. Selvom denne teknologi ikke er uden udfordringer (f.eks. begrænsninger af den DNA-kompatible Kemi, usikkerhed med screening hits osv.), vokser området hurtigt og betragtes endda som ‘revolutionerende’ for opdagelse af små molekyler.
overvinde syntesebarrieren
en af de snublende sten i det tidlige stadium af opdagelse af små molekyler er en begrænsning af syntetisk tilgængeligt kemisk rum-mens mange lovende kemiske ideer kan genereres beregningsmæssigt, eller på anden måde, er der altid en risiko for, at syntetisering af hele sæt forbindelser for at validere sådanne ideer ville være dyrt eller endog umuligt.
de seneste fremskridt på dette område er blevet gjort igen ved hjælp af AI-baserede programmer, der tilbyder synteseplanlægningsydelse på menneskeligt niveau. For eksempel offentliggjorde BenevolentAI for nylig et papir i Nature, der beskriver, hvordan de brugte dybe neurale netværk i kombination med moderne træsøgningsalgoritmer til at planlægge syntesen af nye molekyler med bemærkelsesværdig succesrate og hastighed.
flere interessante cover ups med rige kommentarer blev offentliggjort her og her af Derek lave giver lidt mere indsigt i dette fascinerende område af organisk og medicinsk kemi.
en mere empirisk strategi blev udviklet af en kemisk producent Enamine, der er kendt som REAL Chemical Space, og omfatter i øjeblikket over 3.8 milliarder syntetisk tilgængelige og søgbare molekyler til udforskning af hit og andre medicinske kemiopgaver. Konceptet koger ned til at anvende et sæt interne validerede kemiske ruter (over 100 reaktioner) til en stor pulje af kemiske byggesten, der er tilgængelige i eget lager (over 100 tusind forbindelser)-med det formål at kombinere dem på kombinatorisk måde for at producere en kaskade af større “blylignende” eller “lægemiddellignende” molekyler. Når en vis grad af reproducerbarhed og udbytte er opnået i et stort nok sæt eksperimenter (mindst 80%), finder en yderligere beregningstælling sted for at opbygge et bredere kemisk rum baseret på de eksperimentelt validerede tilfælde.
ny R& d markeder og roller for små molekyler
alt i alt kan man overse eller misforstå størrelsen og vækstpotentialet for små molekylerrørledninger, som det blev nævnt under en paneldiskussion på Interpheks. I øjeblikket er omkring 8000 små molekyler aktive i R&D, en vækst på 25% i løbet af de sidste par år. Ovennævnte vækstdrivere kan føre til en yderligere accelereret vækst i denne sektor.
det er også vigtigt at bemærke, at de små molekyllægemidler kan spille en vigtig rolle i nogle næste generations lægemidler, hvilket gør dem afhængige af små molekylrørledninger. For eksempel i tilfælde af stamcelleterapi kan små molekyler udløse terapeutiske reaktioner.som det blev fremhævet under Cphi Nordamerika af Milliporesigmas Jeffrey Shumvej, har små molekylprodukter tendens til at blive mere komplekse og ændre deres rolle i (bio)farmaceutisk industri.
endelig er det fremtidige område for små molekyler antistof-lægemiddelkonjugater og beslægtede objekter, der fremkom som en lovende klasse af terapeutiske midler på grund af naturlig konvergens mellem to lægemiddelopdagelsesparadigmer og flere teknologiske tendenser.
ansvarsfraskrivelse: oplysningerne er kun til generel bevidsthed og er ikke en juridisk/finansiel/aktiehandel/medicinsk rådgivning af nogen art. Du læser det på egen vilje, og enhver brug af disse oplysninger er på egen risiko. Det er dit ansvar at evaluere nytten og sikkerheden af oplysningerne i dette indlæg, og internettet generelt, og hvordan det gælder for din egen situation og derefter konsultere de relevante eksperter for professionel rådgivning, hvis det kræves.
emner: industri tendenser